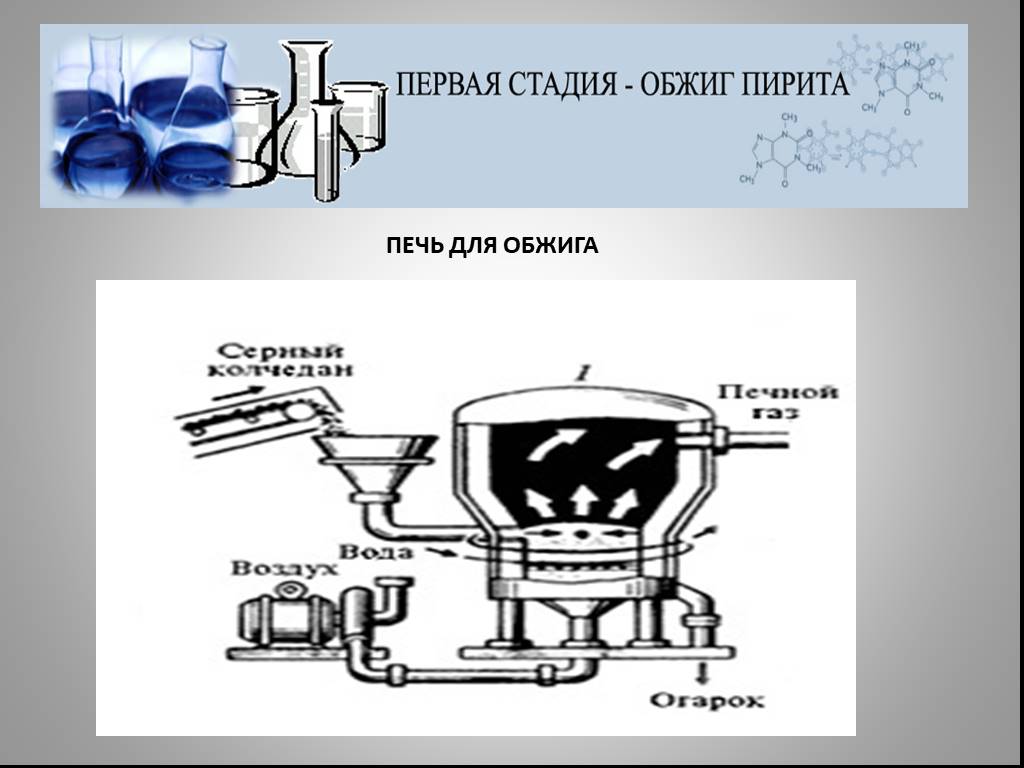
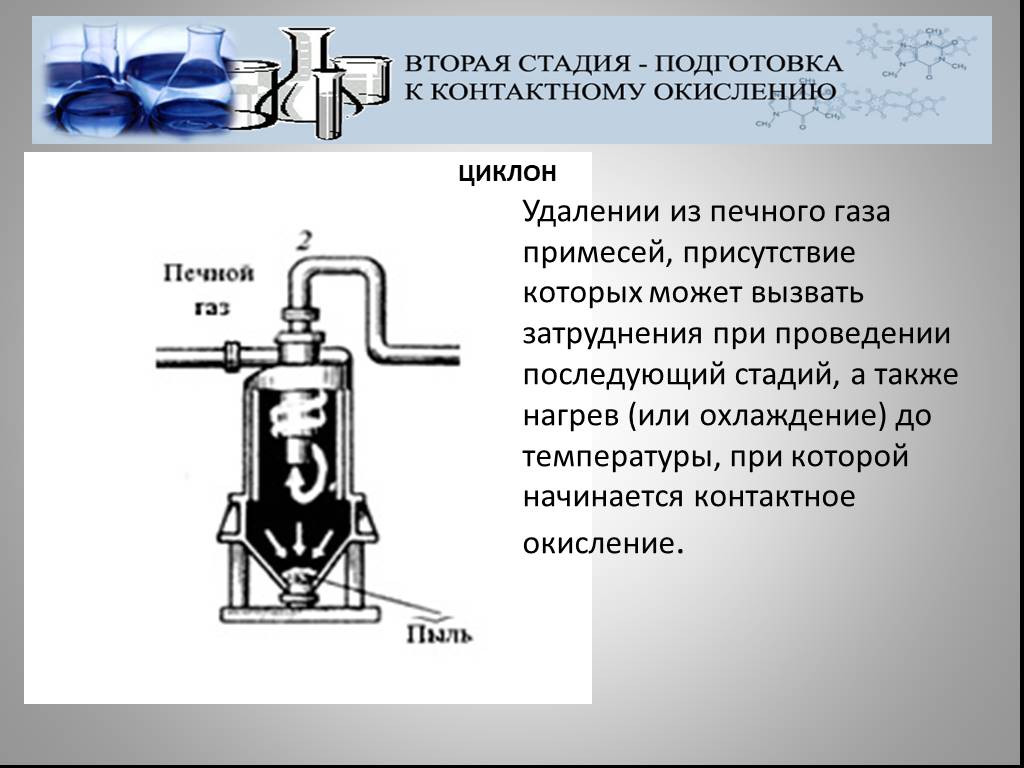
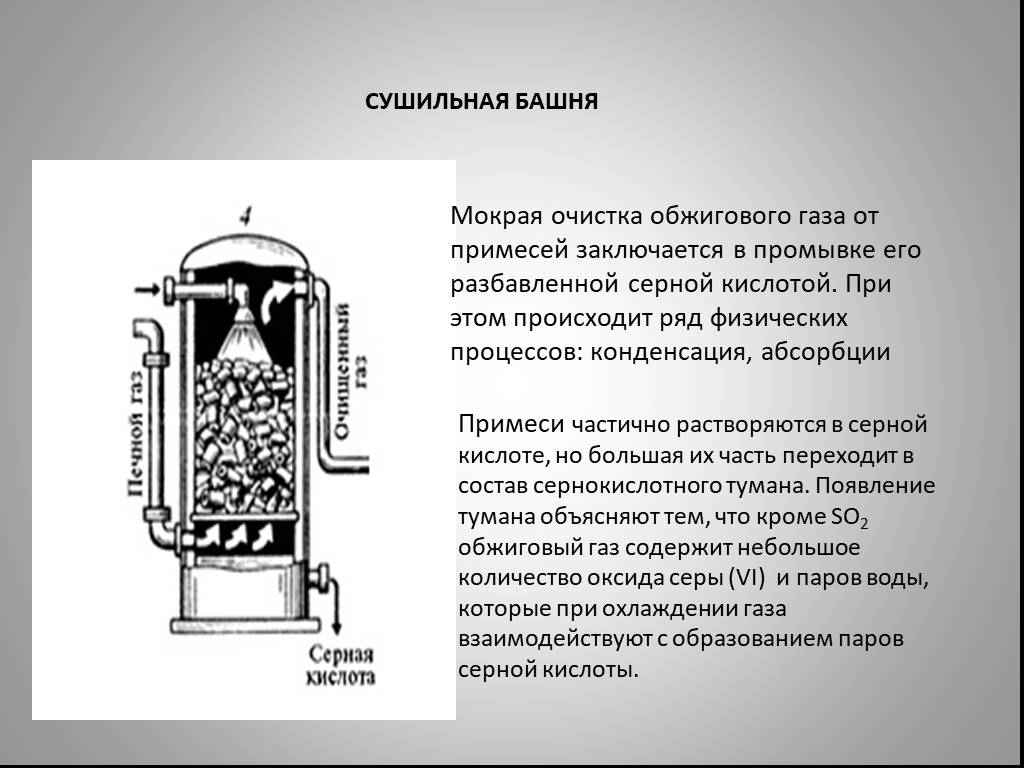
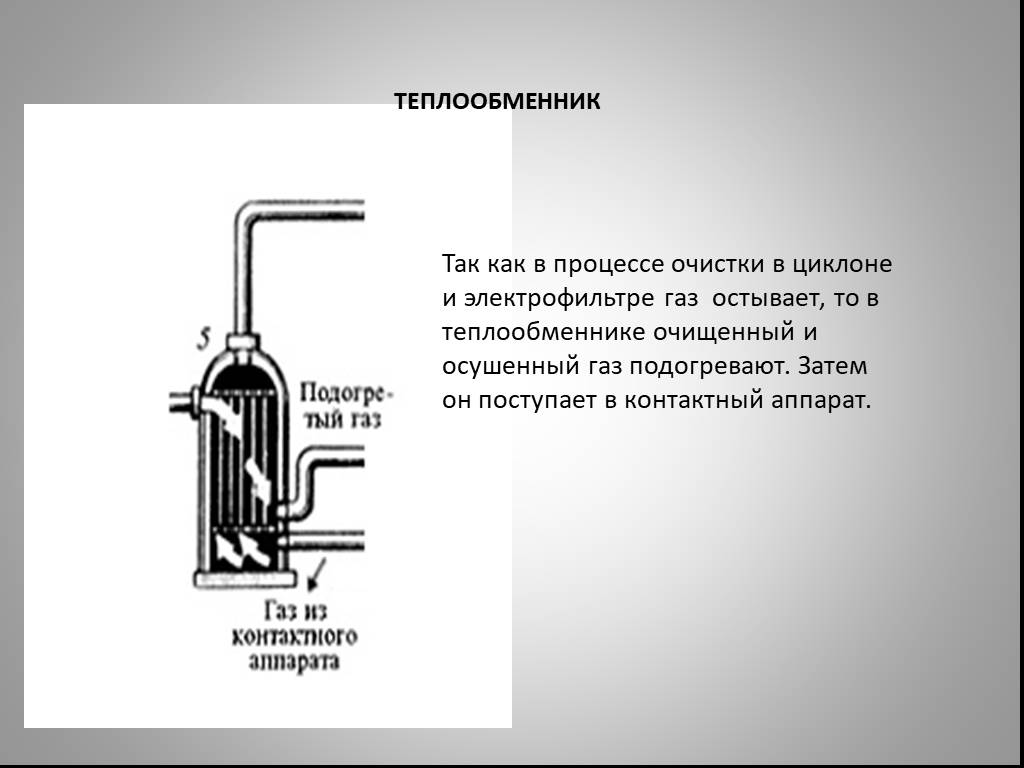
Презентация "Северная кислота и её свойства" по химии – проект, доклад
Презентацию на тему "Северная кислота и её свойства" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 21 слайд(ов).
Слайды презентации
Список похожих презентаций
Азотная кислота и её свойства
Индивидуальная работа. Осуществите превращения 1 вариант: N2 → NO→NO2 2 вариант: N2→NH3→(NH4)SO4 3 вариант: NH3→N2→K3N. HNO. Содержание. Структурная ...Азотная кислота и её соли
Познакомиться с азотной кислотами, её солями- нитратами, их физическими и химическими свойствами ; Экспериментально изучить свойства азотной кислоты ...Вода и её свойства
А почему именно вода? Вода - удивительное химическое соединение, изучаемое не только химиками, но и физиками. Вода - не исключительно самая распространенная, ...Азотная кислота и ее свойства
Сегодня на уроке мы должны:. записать молекулярную и структурную формулы азотной кислоты; изучить химические свойства азотной кислоты в свете ОВР; ...Азотная кислота и её соли
Вспомните! Какие степени окисления проявляет азот в своих оксидах? Какие окислы азота вы знаете? Расскажите о N2O, NO, NO2? Какое из этих соединений ...Окислительно-восстановительные свойства соединений хрома в различных средах
Цель урока:. Сформировать понятие о зависимости свойств соединений хрома от степени окисления элемента через организацию исследовательской деятельности ...Многоликая уксусная кислота
Цели: - расширить кругозор учащихся о веществе, с которым они часто имеют дело в повседневной жизни; - рассмотреть взаимное влияние атомов в молекуле ...Металлы, свойства металлов
Металлы – химические элементы , образующие в свободном состоянии простые вещества с металлической связью. М.В. Ломоносов - металлы «светлое тело, ...Кремний, его физические и химические свойства
Цели урока: - рассмотреть положение кремния в периодической системе Д.И.Менделеева и строении его атома; - рассмотреть нахождение кремния в природе; ...Азотная кислота
Разминка:. А1. Степень окисления азота в азотной кислоте 1) +4 2) +5 3) +2 4) +3. Подготовка к Е Г Э. А 2. По физическим свойствам азот и аммиак 1) ...Различные свойства воды и значение воды в живой и неживой природе
Вода! У тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима ...Получение и свойства алканов
ПОЛУЧЕНИЕ АЛКАНОВ:. ФРАКЦИОННАЯ ПЕРЕГОНКА НЕФТИ Нефть поступает в ректификационные колонны на атмосферную перегонку (перегонку при атмосферном давлении), ...Азотная кислота и ее соли
План изучения азотной кислоты. 1.Состав . 2.Строение. 3.Физические свойства. 4.Химические свойства. 5.Получение и применение. Состав и строение азотной ...азотная кислота
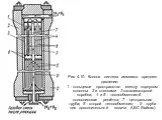
Рисунок 1.2 – Четырехполочная колонна синтеза аммиака мощностью 1360 т/сут 1 – люк для выгрузки катализатора; 2 – центральная труба; 3 – корпус катализа-торной ...Азотная кислота
«Азотная кислота».Тема урока:. I. Строение молекулы.
Электронная формула :O : H :O: N : :O.
Структурная формула O // H ─ O ─ N \\ O.
Молекулярная ...
Азотная кислота
НЕМНОГО ИСТОРИИ. Монах-алхимик Бонавентура в 1270 году в поисках универсального растворителя «алкагеста» решил нагреть смесь железного купороса с ...Оксиды: их свойства и применение
Цели урока:. Блок-схема « Способы получения и химические свойства оксидов». . Получение оксидов. 1 способ: окисление металлов где CuO – оксид меди ...Азотная кислота и ее соли
Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде «Ямщик мудрости», а с ХV века это вещество добывалось ...Оцтова кислота
Найвідоміша карбонова кислота. Оцтова або етанова кислота— органічна речовина з формулою CH3COOH. Слабка, насичена одноосновна карбонова кислота. ...Кислород. Получение кислорода и его физические свойства
Цель. сформировать понятия кислород как атом и молекула; изучить физические и химические свойства кислорода, нахождение его в природе; рассмотреть ...Конспекты
Угольная кислота и её соли
Технологическая карта урока. «Угольная кислота и её соли» в соответствии с ФГОС ООО. Исполнитель: Подгорнова Галина Александровна,. . учитель ...Оксид серы (VI). Серная кислота и её соли
Дата_____________ Класс_______________. Тема: Оксид серы (VI). Серная кислота и её соли. Цели урока:. познакомить учащихся со свойствами серной ...Сера, её физические и химические свойства
Конспект урока химии на тему «Сера, её физические и химические свойства» 9 клас. Цели урока:. 1. дать общую характеристику серы, рассмотреть аллотропные ...Сернистый газ. Сернистая кислота и её соли
Дата_____________ Класс_______________. Тема: Сернистый газ. Сернистая кислота и её соли. Цели урока:. рассмотреть сернистую кислоту и ее соли, ...Азотная кислота: состав молекулы, физические и хими- ческие свойства
Урок по химии разработан к учебнику И. И. Новошинского, Н. С. Новошинской. Технология критического мышления. Тема урока:. «Азотная кислота: состав ...Азотная кислота строение, свойстваи применение
Открытый урок по химии в 9 классе по теме:. . . « Азотная кислота строение, свойстваи применение». Учитель МКОУ СОШ с.п. Кара-Суу Жабоева Раиса ...Азотная кислота и ее соли. Окислительные свойства азотной кислоты
Урок 21. Азотная кислота и ее соли. Окислительные свойства азотной кислоты. Цели урока:. 1. Охарактеризовать азотную кислоту по следующей схеме: ...Азотная кислота и ее свойства, получение и применение. Соли азотной кислоты
Тема: «Азотная кислота и ее свойства, получение и применение. Соли азотной кислоты» (урок – исследование). Цели урока. Образовательная:. ...Угольная кислота и её соли
Урок химии в 9-м классе по теме "Угольная кислота и её соли". Тип урока:. изучение и первичное закрепление новых знаний. Цели. :. Образовательная. ...Азот. Положение в периодической системе и свойства
Кульметенова Айнагуль Саматовна. учитель химии, І категории. стаж работы: 12лет. Калиновской средней школы. Кобдинского района. Актюбинской ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:6 марта 2019
Категория:Химия
Содержит:21 слайд(ов)
Поделись с друзьями:
Скачать презентацию