Конспект урока «Азот. Положение в периодической системе и свойства» по химии для 9 класса
Кульметенова Айнагуль Саматовна
учитель химии, І категории
стаж работы: 12лет
Калиновской средней школы
Кобдинского района
Актюбинской области
Дата: 22.11.14
Класс: 9 «б»
Тема урока: Азот. Положение в периодической системе и свойства.
Цели урока:
Обучающая: Объяснить с позиции строения атома в ПСХЭ Д.И.Менделеева, характеристики атома азота, свойства, применение, биологическая роль.
Развивающая: Развивать знания и умения учащихся; прогнозировать химические свойства веществ по их формулам; пользоваться знаниями о строении и свойства веществ для описания способов их получения и применения.
Воспитывающая: Развивать умения учащихся сравнивать, анализировать, обобщать, делать выводы и применять полученные знания на практике.
Оборудование: ПСХЭ Д.И.Менделеева; схемы.
Межпредметная связь: биология, история, экология.
Тип урока: Новая тема.
Метод урока: Комбинированный.
Девиз урока:
«Свои способности человек может узнать, только попытавшись приложить их».
Сенека
План урока:
І. Организационный момент. (психологический настрой: тренинг, флеш-тренинг);
ІІ.Проверка домашнего задания. (Актуализация знаний – «Снежный ком»);
ІІІ. Новая тема. (самостоятельное изучение и обсуждение в группах с помощью стратегии «ДЖИГСО»)
1 группа:
а/ «Азот. Положение в периодической системе и свойства»
б/ Получение.
2 группа:
в/ Физические свойства.
г/ Химические свойства
3 группа:
д/ Биологическое значение.
е/ Применение.
ж/ Закрепление ЗУН «Мозговая атака», «Перестрелка»
з/ Домашнее задание: 17 (58-60);
Рефлексия
е/ Оценки за урок:
Ход урока:
І. Организационный момент:
- Здравствуйте, дорогие ребята.
-Садитесь. Прежде чем приступить к изучению нового материала, повторим и обобщим пройденный материал. Для этого, вам, потребуется ответить на вопросы, пройденного материала, написать химический диктант, уравнения химических реакций и решить расчетные задачи.
А. /Вопросы для устного опроса:
1. Степени окисления серы.
Ответ: -2, +4, +6.
2. Аллотропные видоизменения серы.
Ответ: 3- ромбическая, пластическая, моноклинная.
3. Кислородсодержащие соединения серы.
Ответ: оксид серы (), оксид серы(), сернистая кислота, серная кислота и их классификация.
4. Сера типичный НеМе она проявляет как
Ответ: восстановительные, так и окислительные свойства.
5. Серная кислота по основности является -
Ответ: двухосновная сильная кислота
6. Соли серной кислоты?
Ответ: Сульфаты.
7. Физические свойства серы. Применение.
Ответ:
Оценочный лист графического диктанта на тему: «Сера»
| Ошибки | Оценка | |
| 6 | 0 | «5» |
| 6 | 1-2 | «4» |
| 6 | 3 | «3» |
| 6 | 4 | «3» |
| 6 | 5-6 | «2» |
Задача №1
4 FeS+11O2 2Fe2SO3+8SO2. Сколько молей потребуется для получения 64г. по этой реакции.
FeS+11O2 2Fe2SO3+8SO2. Сколько молей потребуется для получения 64г. по этой реакции.
Дано: Решение:
m (SO2)=64
(SO2)=64
FeS-
m (FeS)-? Ответ:
(FeS)-? Ответ:
А) 0,4 моль
В) 0,5 моль
С) 3,2 моль
Д) 6,0 моль
Задача №2
При взаимодействии концентрированной серной кислоты с цинком кислота восстанавливается до оксида серы ().Сколько граммов оксида серы образуется при взаимодействии цинка с раствором серной кислоты, содержащей 245г. вещества?
Д ано: Решение:
ано: Решение:
m (H2SO4) =245гр
Z n
n
m (SO2)-? Ответ:
Новый материал:
Итак, мы обобщили пройденный пройденный материал теперь мы приступаем к изучению новой темы, а тема нашего урока
«Азот. Положение в периодической системе и свойства».
-Здесь мы познакомимся с многообразием азота. Приготовьтесь внимательно слушать и записывать.
Азот был открыт в 1772г. Шотландским химиком Д. Резерфордом впервые описал свойства газа той части воздуха,т которая не поддерживала дыхания и горения. Французкий химик А. Лавуазье, доказавший, что открытый Резерфордом газ является самостоятельным элементом, назвал его азотом – безжизненным – от греч. Отрицательной частицы «а» и слова – живой. Термин «азот», укоренившийся только в русском и французском языках, был заменен французским химиком Ж. Шапталем на от греч. –селитра и –рождающийся. Английское название этого элемента , немецкое- (удушающее вещество).
Азот- элемент 2-го периода главной подгруппы Ү группы Ү А, порядковый номер 7. В ядре атома находятся 7 протонов и 7 нейтронов А 14, общее число электронов 7. Эти электроны расположены на двух энергетических уровнях следующим образом:
Поэтому азот в соединениях трехвалентен, в основном состоянии степени окисления азота -3, 0, +3; соответствующие этим степеням соединения: NH.N.NO
Из-за отсутствия d–орбитали у атома азота, при образовании химических связей один электрон с 2s-орбитали смещается к более электроотрицательному элементу, при этом азот проявляет степень окисления +1, далее +2, +3, +4, +5.
Соответствующие этим степеням окисления соединения:
NH3, N2, N2O, NO, N2O3, NO2, N2O5.
Из этих оксидов являются несолеобразующими оксидами. Остальным оксидам соответствуют кислоты: азотистая-НNO2, азотная –HNO3.
Получение. В промышленности азот получают ректификационным ректификация – очищение разделением сжиженного воздуха.
t(O2)= -185
t(N2)= - 196
Физические свойства.
Азот-газ без цвета и запаха, по объему составляет 78% воздуха; (воздух)=0,97, ()=14, плохо растворяется в воде, не поддерживает горения и дыхания. В молекуле азота два атома соединены между собой тройной связью, поэтому молекула азота неактивна.
Азот в обычных условиях не взаимодействует даже с кислородом воздуха, эта реакция идет при электрическом разряде:
Природные соединения азота: чилийская селитра NaNO3, индийская селитра KNO3.
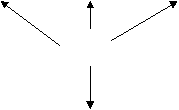
Строение молекулы азота
Химические свойства
В химических реакциях азот проявляет и окислительные, и восстановительные свойства. При взаимодействии с кислородом и фтором азот проявляет восстановительные свойства; а с фосфором, алюминием и водородом – окислительные.
NH3 NO NF3
N
AlN
Биологическое значение. Азот является жизненно важным элементом, так как входит в состав белков и НК. Непосредственно из воздуха его способны усваивать лишь некоторые бактерии, а все другие организмы усваивают только соединения азота. Растения извлекают азот из почвы с неорганическими веществами-нитратами и солями аммония. Животные усваивают органически связанный азот при потреблении животной и растительной пищи. Человек потребляет азот при приеме азотсодержащей пищи. В организме животных содержании азота составляет от 1-10%, в организме человека – до 3 %, в роговице глаза, шерсти – до 15 %.
Применение. Азот используют в химическом синтезе для создания инертной среды. Его применяют в основном для получения аммиака и азотных удобрений. В электротехнике и других отраслях промышленности он используется как инертная среда (для заполнения электрических лампочек, при перекачке горючих жидкостей и т.д.). Жидкий азот используется в качестве охлаждающего реагента. Соединения азота находят применение в производстве минеральных удобрений
Закрепление ЗУН:
1. распространение азота в природе?
2. Физические свойства азота?
А теперь, ребята если у вас нет вопросов по новой теме, то закрепим знания. Откройте страницу 75 вашего учебника. А теперь послушайте внимательно, мы с вами напишем графический диктант по теме «Азот»
1.Химический знак азота .
2. Молекулярная формула – Н
3.Относительная атомная масса азота – 14
4. Азот в ПСХЭ Д.И.М находится в периоде А .
5. Азот реагируя с металлами образует нитраты.
6.В промышленности азот получают разделением сжиженного воздуха.
7Термин «азот» в переводе с греч.безжизненный.
8. Азот твердое вещество желтого цвета.
9. В состав воздуха входит 78 % азота.
10. Азот был открыт в 1972 году
Ответ:
/----1----/----2----/---3---/---4----/---5---/----6---/---7----/---8----/----9----/----10---/
(----) – нет
-
 да
да
Ответ:
10 / 0 - «5»;
10 / 2 – 10 / 3 - «4»;
10 / 4, 10 / 5, 10 / 6 – «3»
10 / 7, 10 / 8, 10 / 9, 10 / 10 –«2»;
Рефлексия:
-А теперь, ребята, заполните таблицу ЗУХ (с помощью заклеивания стикеров…)
| Умею | Хочу знать | |
Домашнее задание: 17 (58-60);
Оценивание: суммативное и формативное /жетон, взаимооценивание, самооценивание, «3 хлопка», «2 звезды и одно пожелание»;
-Вот и заканчивается наше занятие и закончить его хочется высказыванием великого русского ученого Д.И.Менделеева:
«Посеянное на поле научном, взойдет на пользу народа».
-До свидания до следующего урока.
Здесь представлен конспект к уроку на тему «Азот. Положение в периодической системе и свойства», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

