Конспект урока «Сернистый газ. Сернистая кислота и её соли» по химии
Дата_____________ Класс_______________
Тема: Сернистый газ. Сернистая кислота и её соли
Цели урока: рассмотреть сернистую кислоту и ее соли, сернистый газ
Ход урока
1. Организационный момент
Задание №1
Определите объём сероводорода (н.у.), образовавшегося при взаимодействии соляной кислоты с 25% - ым раствором сульфида железа (II) массой 2 кг?
2. Изучение нового материала
SO2 (сернистый ангидрид; сернистый газ)
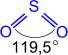
Физические свойства
Бесцветный газ с резким запахом; хорошо растворим в воде (в 1V H2Oрастворяется 40V SO2 при н.у.); более чем в два раза тяжелее воздуха, ядовит;tпл. = -75,5C; tкип. = -10С.
Обесцвечивает многие красители, убивает микроорганизмы.
Получение
1) При сжигании серы в кислороде:
S + O2 → SO2
2) Окислением сульфидов:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
3) Обработкой солей сернистой кислоты минеральными кислотами:
Na2SO3 + 2HCl → 2NaCl + SO2 + H2O
4) При окислении металлов концентрированной серной кислотой:
Cu + 2H2SO4(конц) → CuSO4 + SO2 + 2H2O
Химические свойства
1) Сернистый ангидрид - кислотный оксид.
взаимодействие с водой
При растворении в воде образуется слабая и неустойчивая сернистая кислотаH2SO3 (существует только в водном растворе)
Видео - эксперимент "Получение сернистой кислоты"
Сернистая кислота диссоциирует ступенчато:
H2SO3 ↔ H+ + HSO3- (первая ступень, образуется гидросульфит – анион)
HSO3- ↔ H+ + SO32- (вторая ступень, образуется анион сульфит)
H2SO3 образует два ряда солей - средние (сульфиты) и кислые (гидросульфиты).
Качественной реакцией на соли сернистой кислоты является взаимодействие соли с сильной кислотой, при этом выделяется газ SO2 с резким запахом:
Na2SO3 + 2HCl → 2NaCl + SO2 ↑+ H2O
2H+ + SO32- → SO2 ↑+ H2O
Свойства сернистой кислоты
Раствор сернистой кислоты H2SO3 обладает восстановительными свойствами. Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.
H2SO3 + I2 + H2O = H2SO4 + 2НI
Как и все кислоты, сернистая кислота меняет цвет растворов индикаторов. Метиловый оранжевый в растворе кислоты становится красным. В старину дамские соломенные шляпки отбеливали сернистой кислотой. Раствор сернистой кислоты отбеливает ткани из растительного материала, шерсти, шелка.
Видео "Свойства сернистой кислоты"
взаимодействие со щелочами
Ba(OH)2 + SO2 → BaSO3↓(сульфит бария) + H2O
Ba(OH)2 + 2SO2 (избыток)→ Ba(HSO3)2(гидросульфит бария)
взаимодействие с основными оксидами
SO2 + CaO = CaSO3
2) Реакции окисления, SO2 - восстановитель (S+4 – 2ē → S+6)
2 SO2 + O2 → 2 SO3 (катализатор – V2O5)
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
Водные растворы сульфитов щелочных металлов окисляются на воздухе:
2Na2SO3 + O2 → 2Na2SO4;
2SO32- + O2 → 2SO42-
3) Реакции восстановления, SO2 - окислитель (S+4 + 4ē → S0)
SO2 + С → S + СO2 (при нагревании)
SO2 + 2H2S → 3S + 2H2O
3. Закрепление изученного материала
Задание №1.
Закончите уравнения химических реакций, составьте электронный баланс, укажите процессы окисления и восстановления, окислитель и восстановитель:
А) SO2 + Br2 + H2O→
Б) PbS + O2 →
Задание №2
Осуществите превращения по схеме:
S → H2S → SO2 → Na2SO3 → BaSO3 → SO2
Уравнения реакций ионного обмена напишите в полном и кратком ионном виде.
4. Домашнее задание
П. 12, упр. 3-5 на стр.34
Здесь представлен конспект к уроку на тему «Сернистый газ. Сернистая кислота и её соли», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

