Конспект урока «Угольная кислота и ее соли» по химии для 9 класса
 Муниципальное общеобразовательное учреждение
Муниципальное общеобразовательное учреждение
«Гимназия №32»
г.Нижнекамск Республика Татарстан
Конспект урока по химии
в 9 классе
«Угольная кислота и ее соли»
Подготовила:
учитель химии
Валеева Елена Николаевна
Нижнекамск 2011
Цели урока:
Образовательная: формирование представлений о строении, свойствах и применении угольной кислоты; ее солях, жесткости воды.
Развивающая: создать условия для развития умений учащихся анализировать, обобщать, делать выводы, сравнивать.
Воспитательная: способствовать развитию навыков коммуникативного общения учащихся.
Тип урока: изучение нового материала
Ход урока
-
Орг. момент
-
Изучение нового материала
Учитель: В романе Г.Г. Хаггарда «Клеопатра» написано: «… она вынула из уха одну из 3-х огромных жемчужин и опустила жемчужину в уксусную кислоту? Наступило молчание, потрясённые гости, замерев, наблюдали, как несравненная жемчужина медленно растворяется, Вот от неё не осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая, и выпила всё до последней капли».
Объяснить растворение жемчужины мы сможем в ходе урока, изучив свойства солей самой распространённой в природе кислоты: угольной.
Тема нашего урока: «Угольная кислота и её соли».
+1 +4 -2
а) Молекулярная формула: H2CO3
Угольная кислота – двухосновная кислота, потому будет диссоциировать ступенчато
1 ст. H2CO3  H+ + HCO3-
H+ + HCO3-
IIcт. HCO3-  H+ + CO32- диссоциация по второй ступени практически не идёт
H+ + CO32- диссоциация по второй ступени практически не идёт
б) Физические свойства:
Угольная кислота существует только в растворе т.к. она очень легко разлагается на углекислый газ и воду
H2CO3  CO2
CO2  + H2O
+ H2O
любая газированная вода представляет собой раствор угольной кислоты в воде.
в) Химические свойства:
Как электролит – очень слабая кислота, диссоциирует на ионы в малой степени, поэтому изменяет окраску индикатора слабо. Например, лакмус в растворе угольной кислоты становится только розовым.
1 ст. H2CO3  H+ + HCO3-
H+ + HCO3-
Взаимодействует в растворе со щелочами.
H2CO3+ 2NaOH
При написании уравнения реакции нужно учитывать, что угольная кислота – слабый электролит, поэтому ее расписывать на ионы нельзя.
учащиеся записывают уравнение реакции в молекулярной и ионной форме
H2CO3+ 2NaOH Na2CO3 + 2H2O
Na2CO3 + 2H2O
H2CO3+2Na+ + 2OH- 2Na+ + CO32- +2H2O
H2CO3+2OH- 2Na+ +2H2O
Соли угольной кислоты- карбонаты.
Угольная кислота – двухосновная и поэтому может образовывать два вида солей:
Na2CO3 NaHCO3
CaCO3 Ca(HCO3)2
почти все карбонаты, кроме карбонатов все гидрокарбонаты растворимы
щелочных металлов- нерастворимы
Карбонаты легко превращаются в гидрокарбонаты и наоборот:
СаСO3 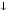 + H2O + CO2
+ H2O + CO2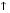
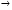 Ca(HCO3)2
Ca(HCO3)2
t
Ca(HCO3)2 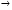 Са СO3
Са СO3  + H2O + CO2
+ H2O + CO2
Качественная реакция на соли угольной кислоты (СО32- или карбонат-ион) – взаимодействие с разбавленной кислотой, например соляной:
Na2CO3 + HCl
учащиеся записывают уравнение реакции в молекулярной и ионной форме
Na2CO3 + 2HCl CO2
CO2 + 2NaCl + H2O
+ 2NaCl + H2O
2Na++ CO32- + 2H+ + 2Cl- CO2
CO2 + 2Na+ +2Cl- + H2O
+ 2Na+ +2Cl- + H2O
CO32- + 2H+  CO2
CO2 + H2O
+ H2O
Жёсткость воды.
Использование жёсткой воды приводит к образованию накипи. Анализ показывает, что жёсткая вода содержит большое количество растворимых солей кальция и магния. Различают временную жёсткость воды и постоянную жёсткость воды.
Ca(HCO3)2 и Mg(HCO3)2 или СaCl2 и MgCl2
временную жёсткость постоянную жёсткость
Временная жёсткость воды или карбонатная, обусловлена присутствием в воде гидрокарбонатов кальция и магния. Она легко устраняется кипячением:
t
Ca(HCO3)2  Са СO3
Са СO3  + H2O + CO2
+ H2O + CO2
или действием известкового молока или соды
Ca(HCO3)2 +Ca(OH)2
Ca(HCO3)2 + Na2CO3
учащиеся записывают уравнения в молекулярной и ионной форме
Ca(HCO3)2 +Ca(OH)2 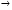 CaCO3
CaCO3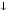 +2H2O
+2H2O
Ca2+ +2(HCO3)- + Ca2+ +2OH- 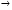 CaCO3
CaCO3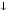 +2H2O
+2H2O
Ca(HCO3)2 + Na2CO3 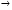 CaCO3 + 2NaHCO3
CaCO3 + 2NaHCO3
Ca2+ +2(HCO3)- + 2Na+ +CO32- 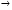 CaCO3 + 2Na+ + 2HCO3-
CaCO3 + 2Na+ + 2HCO3-
Ca2+ +CO32- 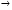 CaCO3
CaCO3
Постоянная или некарбонатная жёсткость, обусловлена присутствием в воде других растворимых солеё кальция или магния. Она устраняется добавлением соды
CaCl2+ Na2CO3 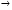
учащиеся записывают уравнения в молекулярной и ионной форме
CaCl2+ NaCO3 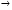 CaCO3
CaCO3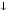 + 2NaCl
+ 2NaCl
Ca2+ + 2Cl- + 2Na+ + CO32- 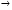 CaCO3
CaCO3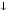 + 2Na+ + 2Cl-
+ 2Na+ + 2Cl-
Ca2+ +CO32- 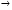 CaCO3
CaCO3
-
Закрепление
А сейчас посмотрите на свои записи и ответьте на вопросы.
– Почему Н2СО3 образует 2 вида солей?
– Как называются эти соли?
Предполагаемый ответ
Угольная кислота – двухосновная кислота, поэтому образует два вида солей: средние, карбонаты и кислые, гидрокарбонаты.
– Назовите формулу мела?
Предполагаемый ответ
Мел – карбонат кальция
– Мрамора?
Предполагаемый ответ
Мрамор– карбонат кальция
– Жемчуга?
Предполагаемый ответ
Жемчуг – карбонат кальция
– Питьевой соды?
Предполагаемый ответ
Питьевая сода – гидрокарбонат калия
– «Что же произошло, когда растворила жемчужину Клеопатра?», запишите уравнение реакции.
Предполагаемый ответ
При растворении жемчуга в уксусной кислоте произошла химическая реакция
СаСО3 +2 СН3СООН (СН3СОО)2Ca + 2 CO2 +2 H2O
Д/з
-
п.30 в.5, 6 с.138
-
Где в природе встречаются реакции, характеризующие жесткость воды (творческое задание)?
Литература
-
Габриелян О.С. Химия 9класс, Дрофа, Москва 2007
-
Горковенко М.Ю. Поурочные разработки по химии, 9 класс, Москва 2005
-
Игнатьева С.Ю. Химия: Нетрадиционные уроки 8-11 класс, Волгоград 2003
Здесь представлен конспект к уроку на тему «Угольная кислота и ее соли», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

