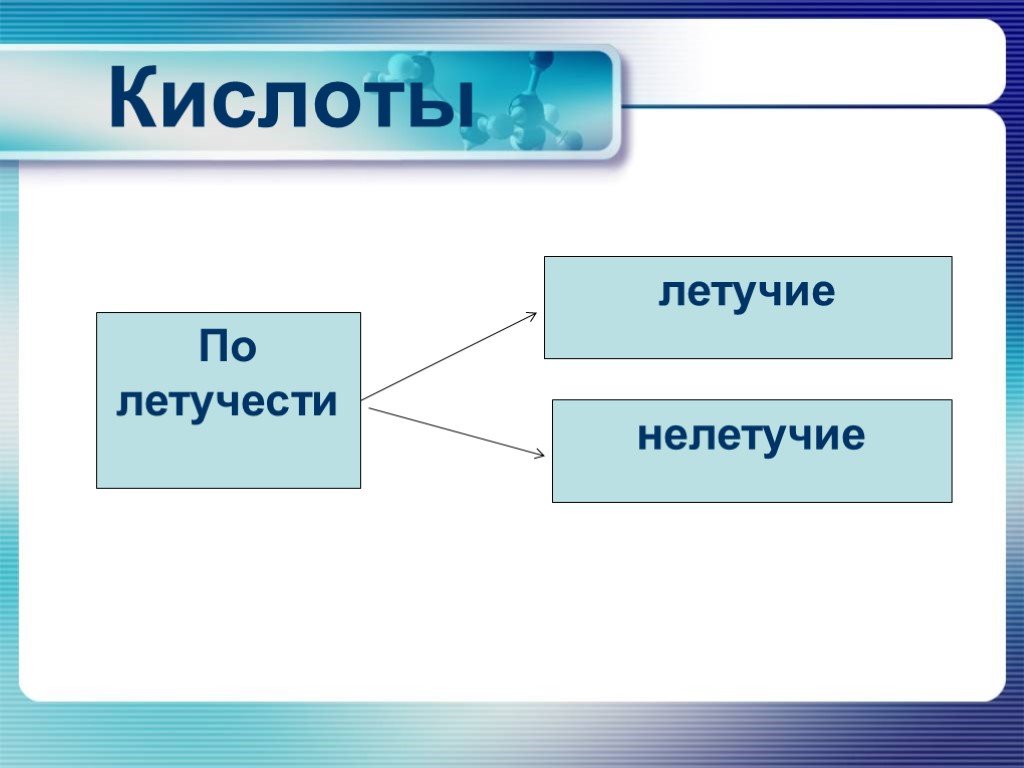
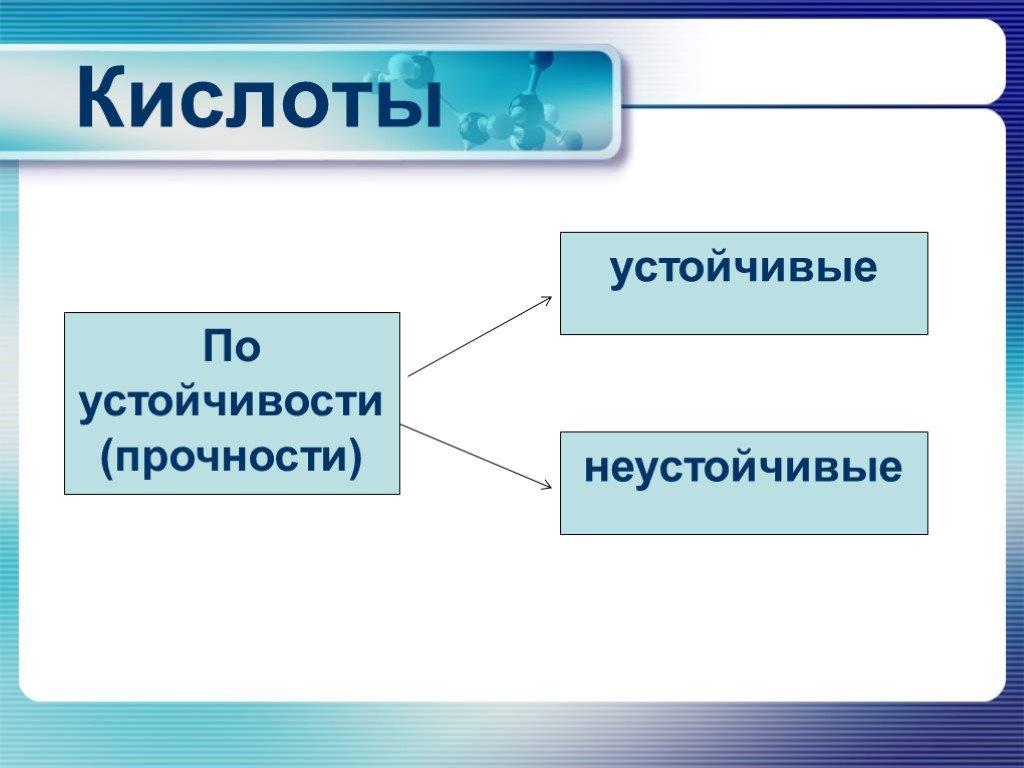
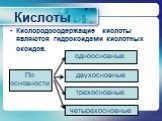
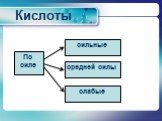
Презентация "Неметаллы. Кислородные соединения неметаллов" по химии – проект, доклад
Презентацию на тему "Неметаллы. Кислородные соединения неметаллов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 19 слайд(ов).
Слайды презентации
Список похожих презентаций
Кислородные соединения углерода
Угарный газ (СО)содержится в выхлопных газах автомобилей. Воздух, окутывающий Землю, содержит около 3 млрд. т. СО2. План изучения веществ. Состав ...Кислородные соединения углерода
Взаимопроверка. Отметка: 10 правильных ответов – «5» 8-9 правильных ответов – «4» 5-7 правильных ответов – «3» Менее 5 – «2». Урок химии в 9 классе ...Кислородные соединения углерода
Без углерода не существует ни одного растения или животного... Кристаллическая решетка графита (плоскостная). Кристаллическая решетка алмаза (тетраэдрическая). ...Неметаллы.Применение неметаллов
Неметаллы– это химические элементы, которые образуют в свободном состоянии простые вещества, не обладающие физическими и химическими свойствам металлов. ...Кислородные соединения азота
Оксиды азота:. . Вещества, образующиеся из оксидов азота:. N2O NO - несолеобразующие N2 N2+3O3-2 HNO2 Соли нитриты NO2 + H2O = HNO3+ HNO2 N2+5O5-2 ...Кислородные соединения азота и их свойства
Цель урока:. Расширить, обобщить, закрепить, оценить знания по теме: «Кислородные соединения азота» Повторить свойства азотной кислоты Закрепить особенности ...Кислородные соединения
Распространенность и минералы. N – 33 место, N2, NaNO3 (селитра) P – 13 место; Ca3(PO4)3 (фосфорит), Ca3(PO4)2.Ca(OH,F)2 (апатит) As – 51 место, FeAsS ...НЕМЕТАЛЛЫ природные соединения применения продуктов их переработки
Элементы в природе. Нахождение в природе. Самородные элементы. Сера Графит С Алмаз С. Азот и кислород, инертные газы в составе воздуха. Нахождение ...Водородные соединения неметаллов
метан аммиак вода сероводород кислоты. Метан. Газ без цвета и запаха, малорастворим в воде, легче воздуха, горит бледным синеватым пламенем. Смесь ...Углерод, соединения углерода
Цель занятия: обобщение, систематизация и углубление знаний по теме «Углерод и его соединения». Вопросник:. Элементы, содержащиеся в живых организмах. ...Сера и ее соединения
Сера и ее соединения. Цель работы: Изучение физических и химических свойства серы и ее соединений. Выявление отрицательного воздействия на окружающую ...Примеры неметаллов
Цели и задачи урока. рассмотреть положение неметаллов в ПСХЭ Д.И.Менделеева и на основе строения атомов сделать вывод о физических и химических свойствах ...Бинарные соединения
Классификация сложных веществ. Бинарные соединения – это вещества, состоящие из двух разных атомов. Как составить формулу бинарного соединения. Знать ...Бинарные соединения
17.09.2018. Бинарные соединения: определение. Многообразие природных бинарных соединений. Вода Хлорид натрия Углекислый газ. Бинарные вещества состоят ...Неметаллы
Проработать ключевые моменты изученной темы и подготовиться к контрольной работе. Цель. 1. Систематизировать и обобщить знания особенностей строения ...Аллотропные видоизменения неметаллов
Аллотропия неметаллов. Кислород, Озон. Кислород О2 при обычных условиях –газ без цвета и запаха, немного тяжелее воздуха в воде малорастворим. Жидкий ...Галогены и их соединения
Цели урока:. Рассмотреть свойства и применение важнейших соединений галогенов. Изучить качественные реакции на галогенид-ионы. Рассмотреть свойства ...Галогены и их соединения
Опыт и наблюдение- таковы величайшие источники мудрости, доступ к которым открыт для каждого человека. (Чаннинг.). Вопросы:. Что такое «вытеснительный ...Все о железе и его соединения
Урок-проект в 9 классе подготовила Яскевич В.А. учитель химии МОУ «Кадетская школа «Патриот» г.Энгельса 2010 г. План изучения вещества. Железо как ...Взаимодействие атомов элементов – неметаллов между собой
Что общего в составе частиц:. 1) 11H0, 21H0, 31H0 2) 168O0 , 168O2- , 178O0 3) 11H-, 21H-, 42He0. Разделите элементы на две группы: Cl, Mg, O, P, ...Конспекты
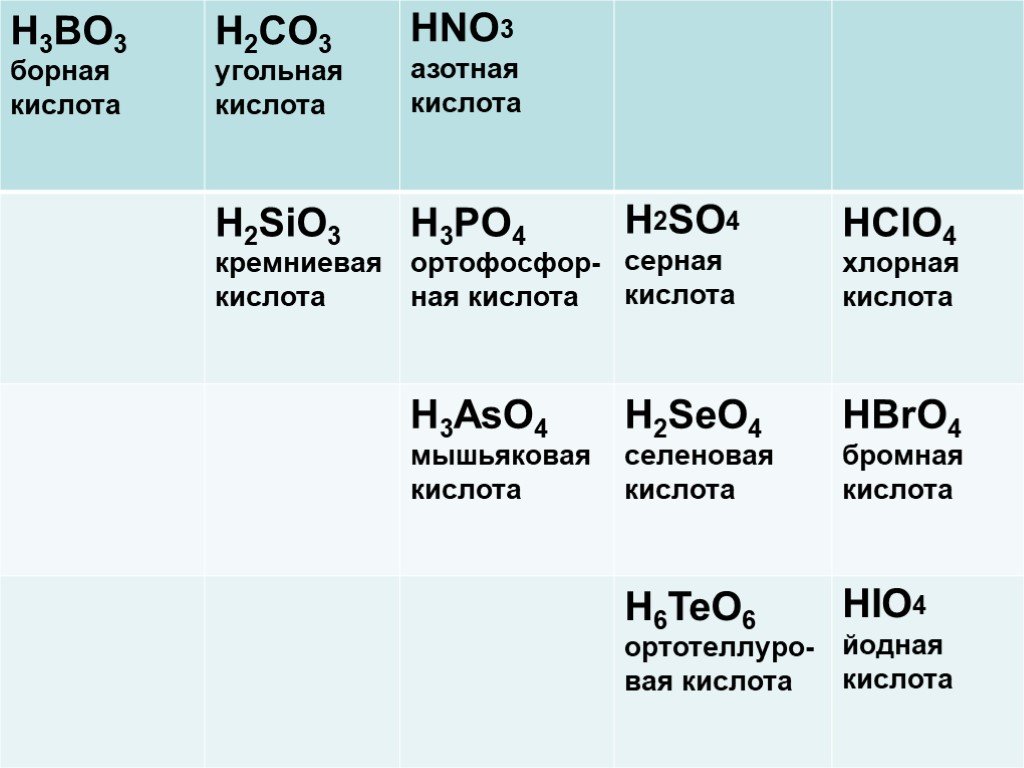
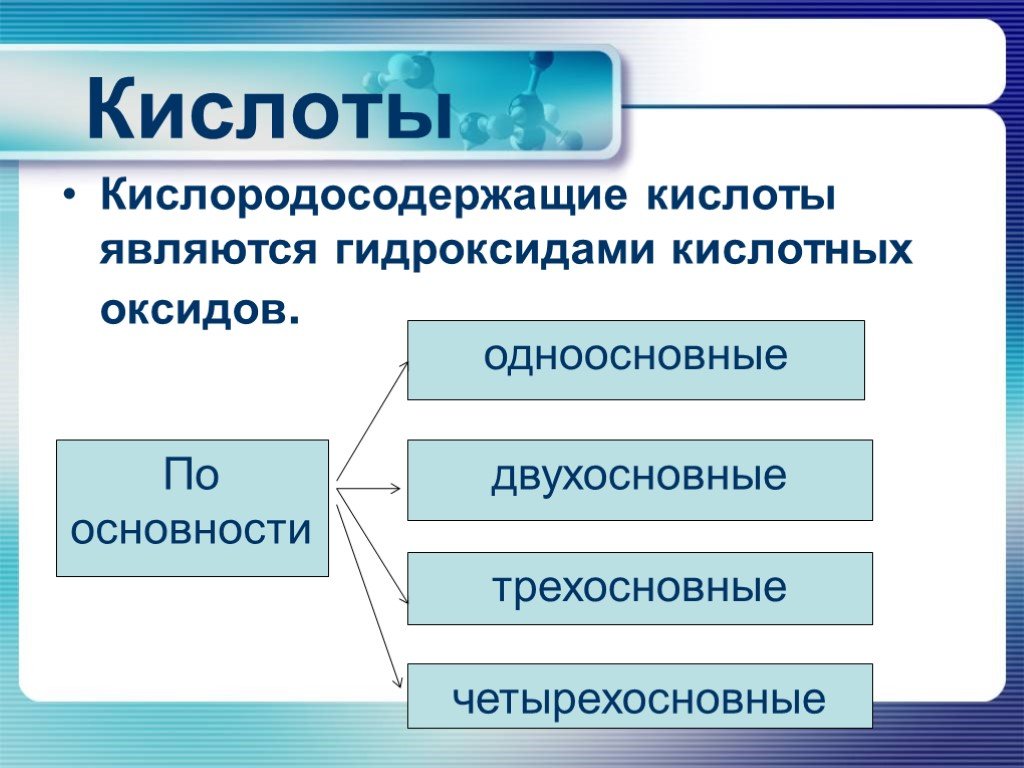
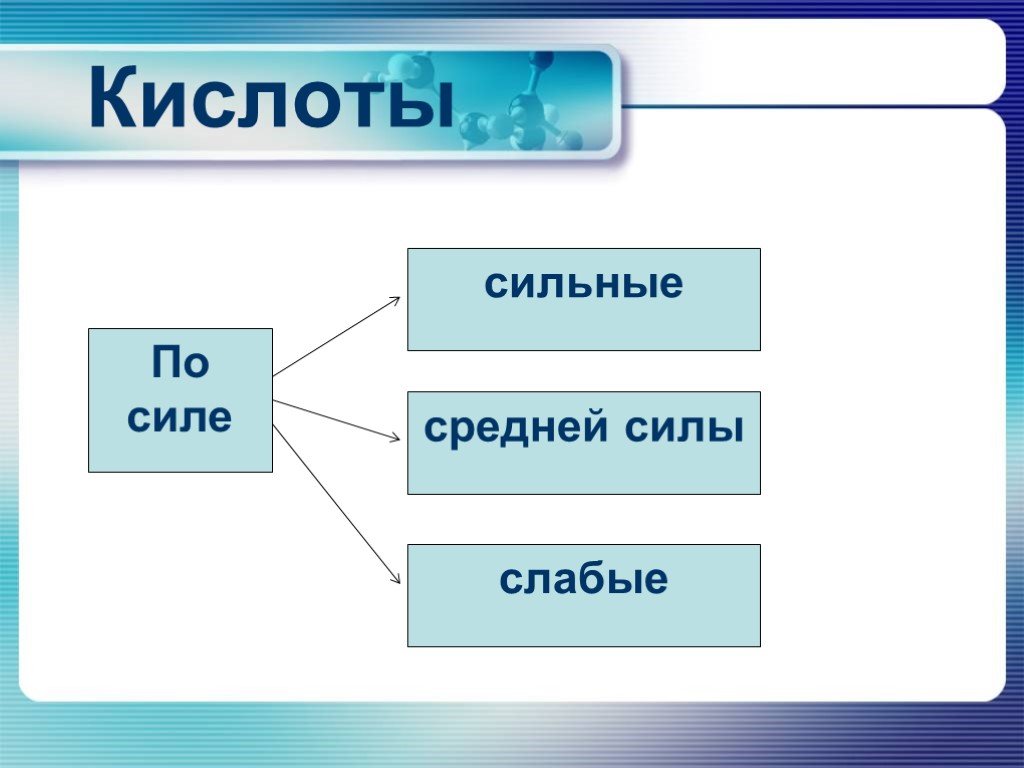
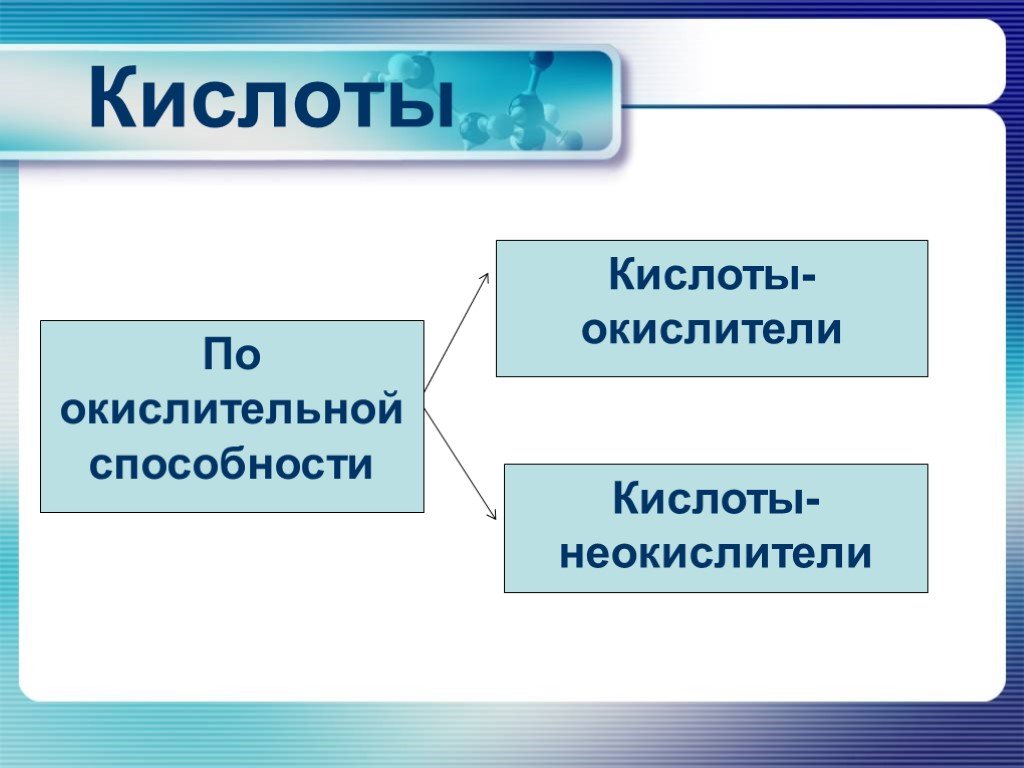
Водородные и кислородные соединения неметаллов
Описание методической разработки урока по химии. 1.Район: Кукморский. 2 Ф.И.ОГалимова Суфия Хатимовна. 3.Номинация: Методические материалы ...Кислородные соединения серы
Тема урока: Кислородные соединения серы. Цель урока. : 1. Контроль и оценка усвоения учащимися изученного материала. 2. Способствовать развитию ...Кислородные соединения углерода
Девиз урока:. Удивим мы весь народ, изучая углерод! Тема:. Кислородные соединения углерода. Тип урока:. изучение нового материала. Цель ...Кислородные соединения азота
Технологическая карта урока. Данные об учителе:. Ткачук Татьяна Макаровна , учитель химии МБОУ «Михайловская СОШ, высшая категория. Предмет:. ...Общая характеристика неметаллов. Элементы IV А группы. Углерод, кремний и их соединения
План учебного занятия № 13. Дата Предмет. химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . І. Тема занятия:. Общая характеристика неметаллов. ...Неметаллы. Общая характеристика неметаллов
. План-конспект урока химии в 9 -м классе с использованием ЦОР по теме: «Неметаллы. Общая характеристика неметаллов». Автор: Кобелева Вера Ивановна. ...Общая характеристика неметаллов. Элементы V А группы. Важнейщие соединения азота. Фосфор и его соединения
План учебного занятия № 14. Дата Предмет. химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . І. Тема занятия:. Общая характеристика неметаллов. ...Железо и его соединения
Начальное профессиональное образование. Профессиональное училище №63. Г. Гуково Ростовской области. Конспект урока по химии. . 9 класс. ...Кремний и его соединения
Конспект урока химии «Кремний и его соединения». Приветствую тебя, мой юный исследователь! Предлагаю тебе сегодня обратиться самым настоящим пиратом. ...Неметаллы
ПЛАН-КОНСПЕКТ УРОКА. _Азот и его свойства. . ФИО (полностью). . Кротова Светлана Викторовна. . . . Место работы. . МБУ ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:21 ноября 2018
Категория:Химия
Содержит:19 слайд(ов)
Поделись с друзьями:
Скачать презентацию