Презентация "Кислородные соединения" по химии – проект, доклад
Презентацию на тему "Кислородные соединения" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 32 слайд(ов).
Слайды презентации
Список похожих презентаций
Кислородные соединения углерода
Угарный газ (СО)содержится в выхлопных газах автомобилей. Воздух, окутывающий Землю, содержит около 3 млрд. т. СО2. План изучения веществ. Состав ...Кислородные соединения углерода
Взаимопроверка. Отметка: 10 правильных ответов – «5» 8-9 правильных ответов – «4» 5-7 правильных ответов – «3» Менее 5 – «2». Урок химии в 9 классе ...Кислородные соединения азота и их свойства
Цель урока:. Расширить, обобщить, закрепить, оценить знания по теме: «Кислородные соединения азота» Повторить свойства азотной кислоты Закрепить особенности ...Кислородные соединения углерода
Без углерода не существует ни одного растения или животного... Кристаллическая решетка графита (плоскостная). Кристаллическая решетка алмаза (тетраэдрическая). ...Неметаллы. Кислородные соединения неметаллов
Кислоты. Высшим оксидам неметаллов соответствуют следующие кислоты. . Кислородосодержащие кислоты являются гидроксидами кислотных оксидов. По основности ...Кислородные соединения азота
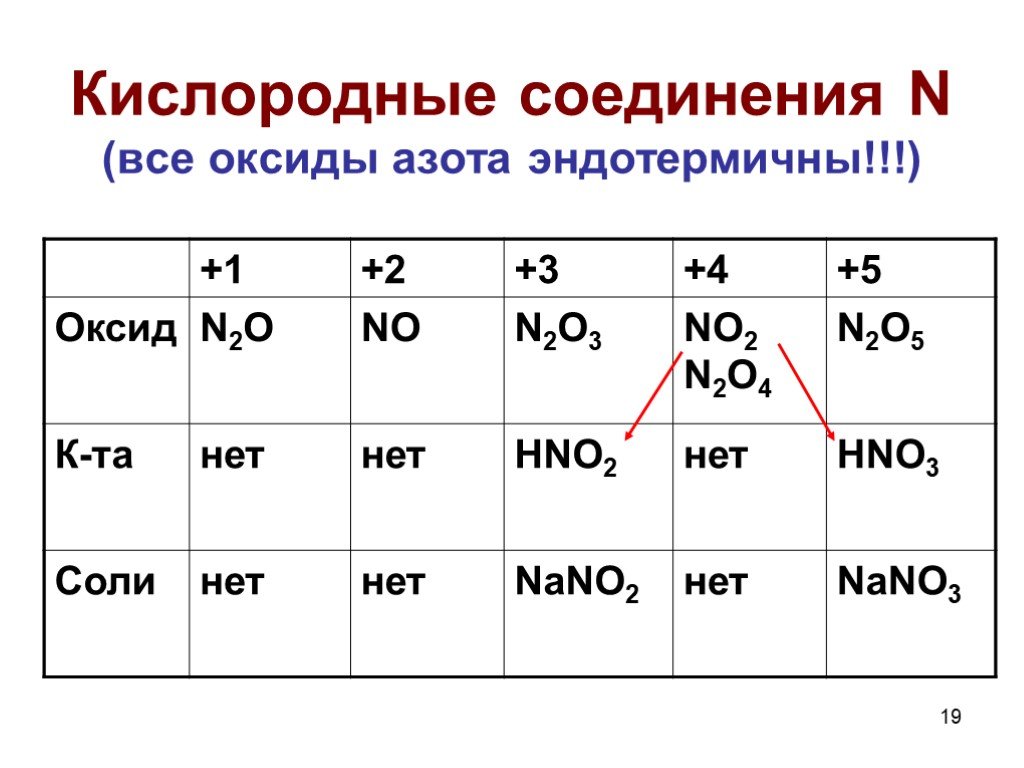
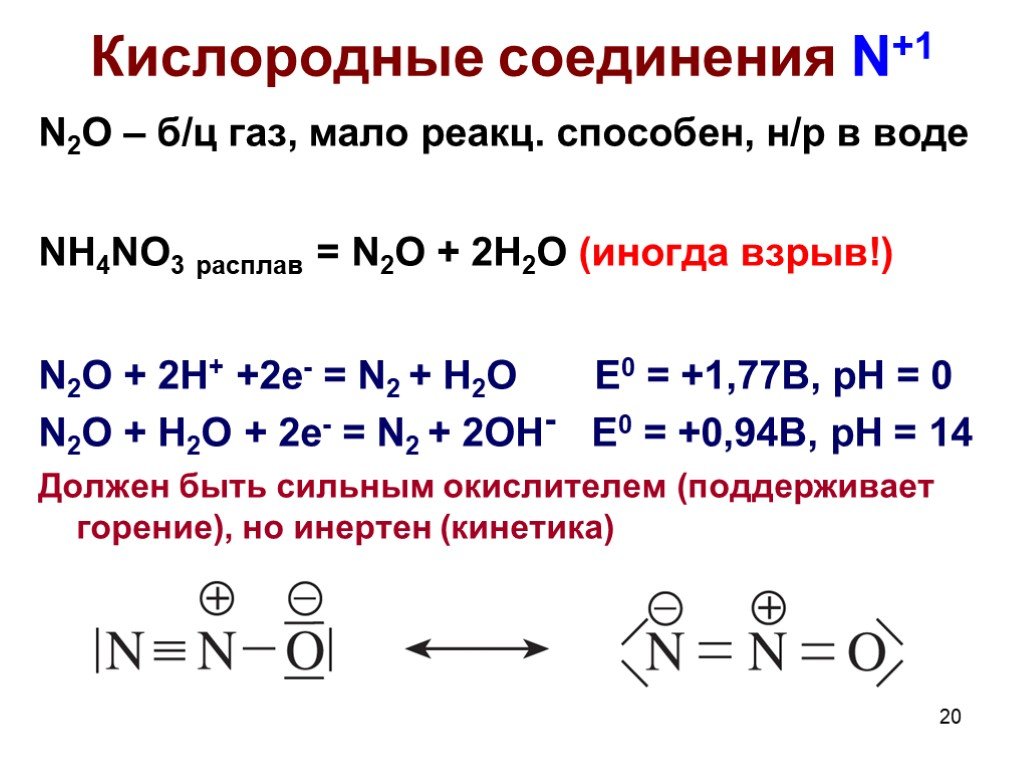
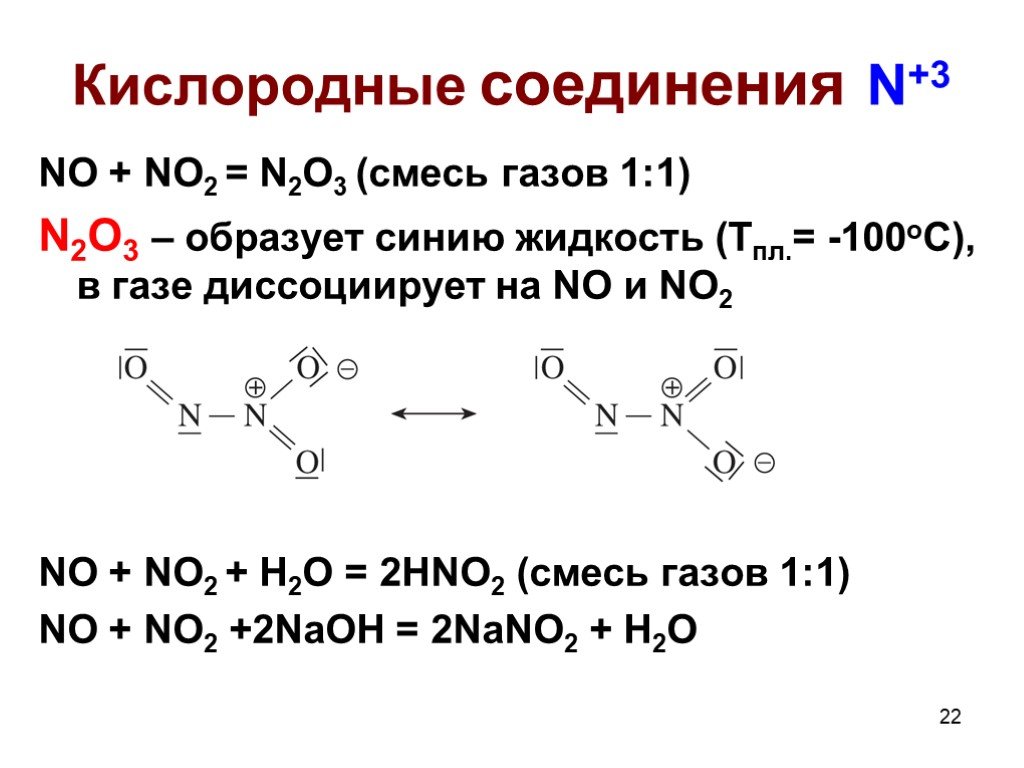
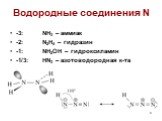
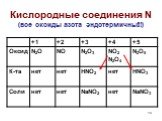
Оксиды азота:. . Вещества, образующиеся из оксидов азота:. N2O NO - несолеобразующие N2 N2+3O3-2 HNO2 Соли нитриты NO2 + H2O = HNO3+ HNO2 N2+5O5-2 ...Комплексные соединения
Соединения,имеющие в своем составе комплексные ионы, относят к комплексным соединениям. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ. N H Cl + - [ * NH4Cl. КОМПЛЕКСООБРАЗОВАТЕЛЬ. ...Фосфор и его соединения и их свойства
Аллотропные модификации фосфора. Чёрный фосфор Красный фосфор Белый фосфор. Химические свойства фосфора. Горение фосфора. Оксиды фосфора. Взаимодействие ...Алюминий и его соединения
Положение в Периодической системе. Алюминий располагается в 3 периоде, в главной подгруппе 3 группы. Порядковый номер элемента – 13 Относительная ...Бинарные соединения
ОПРЕДЕЛЕНИЕ. Бинарные соединения – это соединения, состоящие из двух химических элементов. H2O, NH3, K2S, P2O5, CaC2. Бинарные соединения - хлориды. ...Алюминий и его соединения
Учителя химии: Гершановская Евгения Владимировна ГБОУ СОШ № 880 Город Москва Попова Светлана Анатольевна ГБОУ СОШ № 1465 Город Москва. СОДЕРЖАНИЕ. ...Металлоорганические соединения непереходных металлов
Лекция 2 Характерные типы и энергетика связей металл-углерод Основные синтетические подходы к металлоорганическим соединениям. Характерные типы связей ...Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
SiO2 , H2O , CO2 , AI2O3 , Fe2O3 , CO. Всесильная стихия природы-вода во все времена, во все периоды истории покоряла ум и воображение людей. Человек ...Галогены и их соединения
Опыт и наблюдение- таковы величайшие источники мудрости, доступ к которым открыт для каждого человека. (Чаннинг.). Вопросы:. Что такое «вытеснительный ...Галогены и их соединения
Цели урока:. Рассмотреть свойства и применение важнейших соединений галогенов. Изучить качественные реакции на галогенид-ионы. Рассмотреть свойства ...Водородные соединения неметаллов
метан аммиак вода сероводород кислоты. Метан. Газ без цвета и запаха, малорастворим в воде, легче воздуха, горит бледным синеватым пламенем. Смесь ...Все о железе и его соединения
Урок-проект в 9 классе подготовила Яскевич В.А. учитель химии МОУ «Кадетская школа «Патриот» г.Энгельса 2010 г. План изучения вещества. Железо как ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Важнейшие представители бинарных соединений – оксиды и летучие водородные соединения
Н2О - вода. СО2 углекислый газ. СУХОЙ ЛЁД. NH3 аммиак. HCL хлороводород. Бесцветный газ. Тяжелее воздуха. Хорошо растворяется в воде. Раствор хлороводорода ...Конспекты
Кислородные соединения серы
Тема урока: Кислородные соединения серы. Цель урока. : 1. Контроль и оценка усвоения учащимися изученного материала. 2. Способствовать развитию ...Кислородные соединения углерода
Девиз урока:. Удивим мы весь народ, изучая углерод! Тема:. Кислородные соединения углерода. Тип урока:. изучение нового материала. Цель ...Кислородные соединения азота
Технологическая карта урока. Данные об учителе:. Ткачук Татьяна Макаровна , учитель химии МБОУ «Михайловская СОШ, высшая категория. Предмет:. ...Водородные и кислородные соединения неметаллов
Описание методической разработки урока по химии. 1.Район: Кукморский. 2 Ф.И.ОГалимова Суфия Хатимовна. 3.Номинация: Методические материалы ...Медь и ее соединения
Тема урока: Медь и ее соединения. . Цели урока. : расширить знания учащихся о металлах на примере переходного металла меди, рассмотреть состав и ...Комплексные соединения
. Муниципальное общеобразовательное учреждение. средняя общеобразовательная школа № 9. Урок в 11 классе. «Комплексные соединения». ...Кремний и его соединения
Т.В.Кузнецова,учитель химии, школа № 53. . ПЛАН-КОНСПЕКТ УРОКА. . «Кремний и его соединения». (тема урока). . ФИО Кузнецова Татьяна ...Кислородсодержащие органические соединения
Е.А.Кудравец, учитель химии. МОУ гимназии № 32. . Дидактическая разработка урока. . Тема:. «Кислородосодержащие органические соединения». ...Комплексные соединения
МОУ «Бишевская средняя общеобразовательная школа». Апастовского муниципального района РТ. Конспект урока ...Сера и её соединения
Конспект урока с использованием ЭОР. Тема:. Сера и её соединения. Класс: 9. Цель:. изучить строение, свойства серы и его соединений. Задачи:. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:1 апреля 2019
Категория:Химия
Содержит:32 слайд(ов)
Поделись с друзьями:
Скачать презентацию














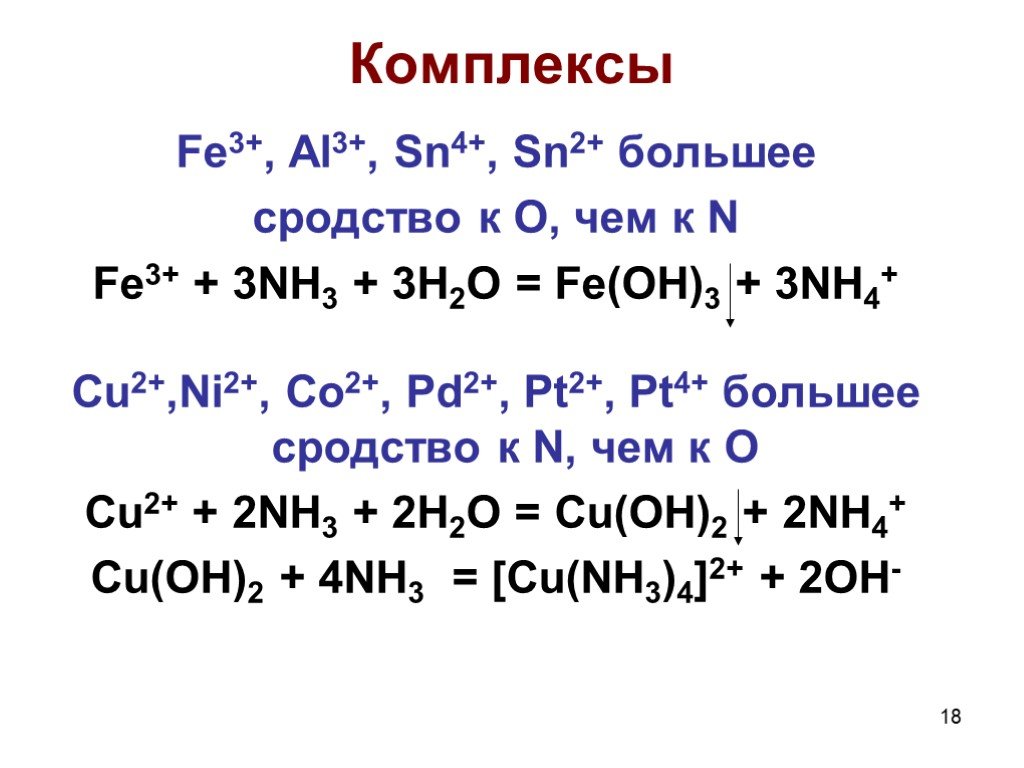























![Комплексы. Fe3+, Al3+, Sn4+, Sn2+ большее сродство к O, чем к N Fe3+ + 3NH3 + 3H2O = Fe(OH)3 + 3NH4+ Cu2+,Ni2+, Co2+, Pd2+, Pt2+, Pt4+ большее сродство к N, чем к O Cu2+ + 2NH3 + 2H2O = Cu(OH)2 + 2NH4+ Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH- Комплексы. Fe3+, Al3+, Sn4+, Sn2+ большее сродство к O, чем к N Fe3+ + 3NH3 + 3H2O = Fe(OH)3 + 3NH4+ Cu2+,Ni2+, Co2+, Pd2+, Pt2+, Pt4+ большее сродство к N, чем к O Cu2+ + 2NH3 + 2H2O = Cu(OH)2 + 2NH4+ Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH-](https://prezentacii.org/upload/cloud/19/04/138352/images/thumbs/screen18.jpg)



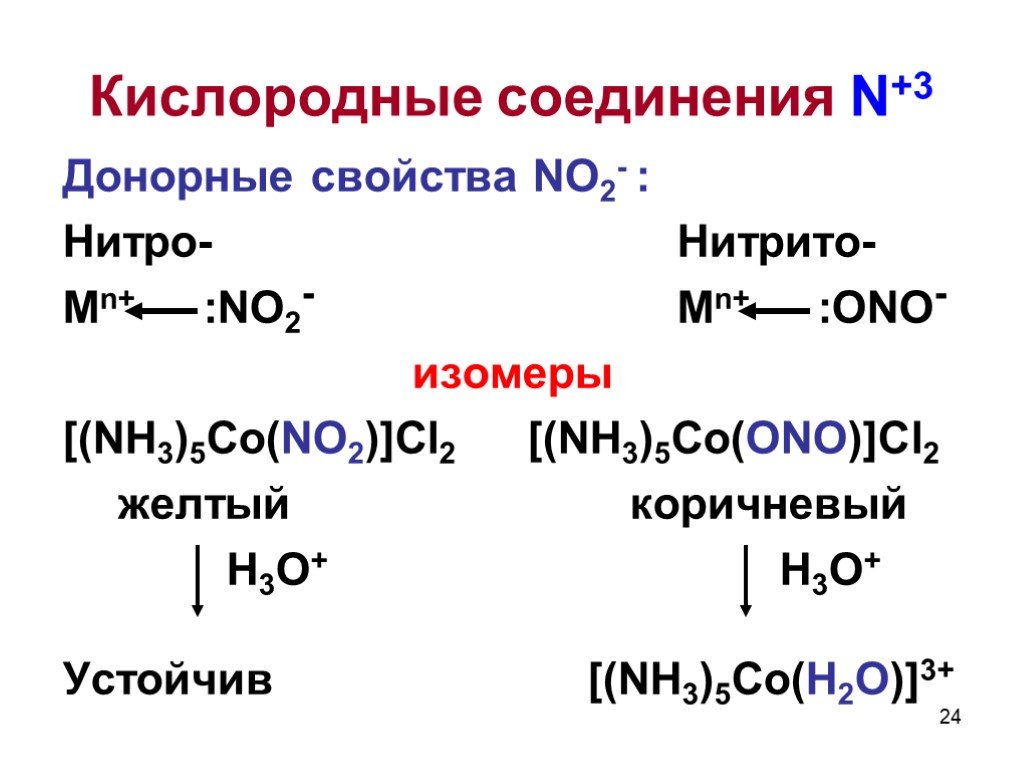
![Донорные свойства NO2- : Нитро- Нитрито- Mn+ :NO2- Mn+ :ONO- изомеры [(NH3)5Co(NO2)]Cl2 [(NH3)5Co(ONO)]Cl2 желтый коричневый Н3О+ Н3О+ Устойчив [(NH3)5Co(H2O)]3+ Донорные свойства NO2- : Нитро- Нитрито- Mn+ :NO2- Mn+ :ONO- изомеры [(NH3)5Co(NO2)]Cl2 [(NH3)5Co(ONO)]Cl2 желтый коричневый Н3О+ Н3О+ Устойчив [(NH3)5Co(H2O)]3+](https://prezentacii.org/upload/cloud/19/04/138352/images/thumbs/screen24.jpg)


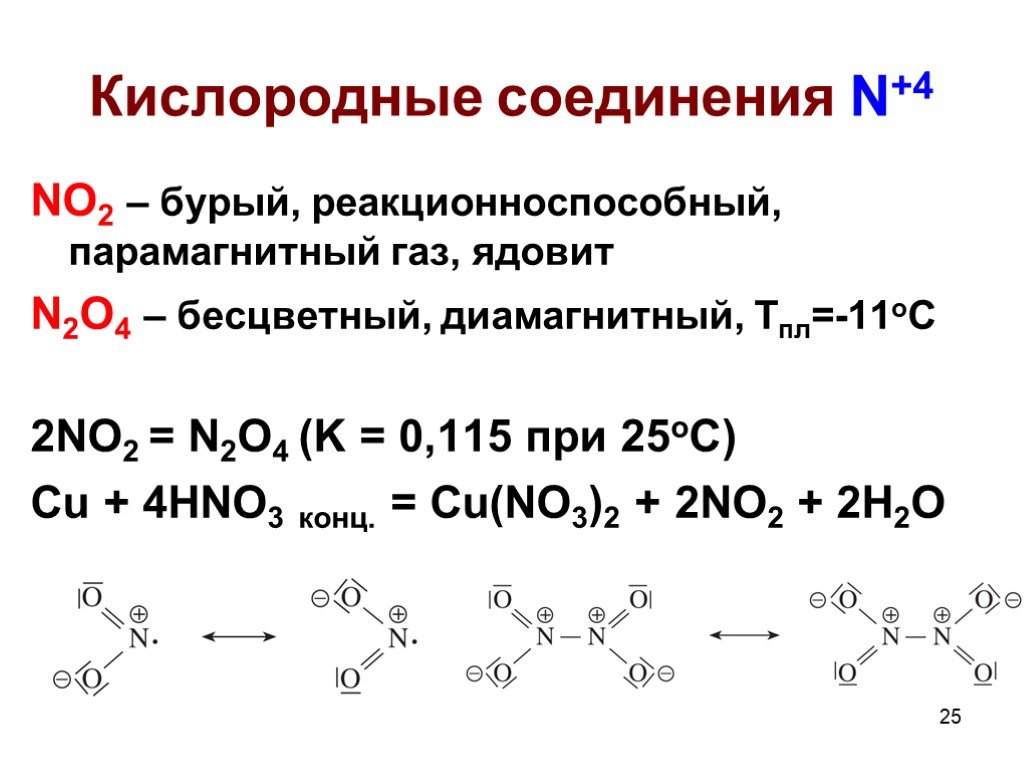
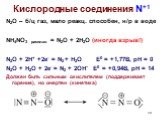
![Кислородные соединения N+5. N2O5 – б/ц тв., неустойчив, [NO2]+[NO3]-, в газе O2N-O-NO2, сильный окислитель 2HNO3 конц. + P2O5 = 2HPO3 + N2O5 HNO3 – сильный окислитель Нитраты – сильные окислители только в расплавах Кислородные соединения N+5. N2O5 – б/ц тв., неустойчив, [NO2]+[NO3]-, в газе O2N-O-NO2, сильный окислитель 2HNO3 конц. + P2O5 = 2HPO3 + N2O5 HNO3 – сильный окислитель Нитраты – сильные окислители только в расплавах](https://prezentacii.org/upload/cloud/19/04/138352/images/thumbs/screen27.jpg)

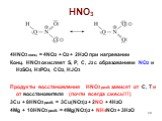

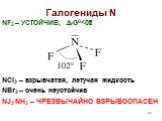
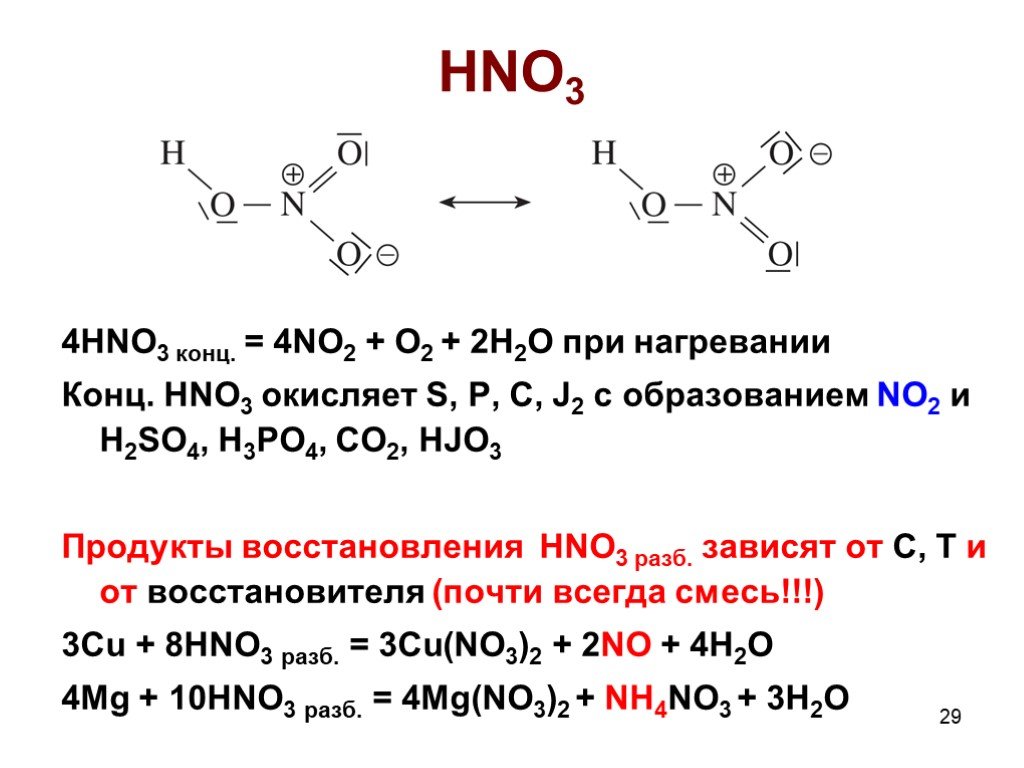
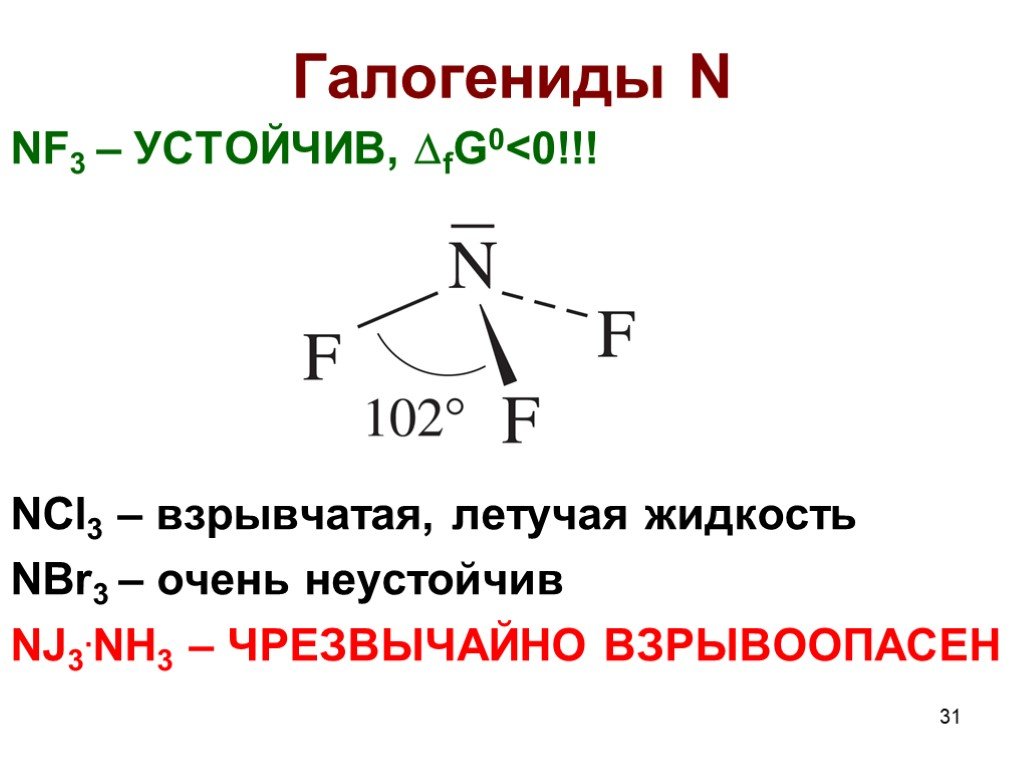
![Гидролиз: NCl3 + H2O = NH3 + HClO NOГ (Г = F, Cl, Br) нитрозилгалогениды NOГ + H2O = HNO2 + HГ NO2Г (F, Cl) нитрилгалогениды NO2Г + H2O = HNO3 + HГ Солеобразные соединения [NO]+X- (X = ClO4-, HSO4-) соли нитрозония [NO2]+X- (X = ClO4-, HSO4-) соли нитрония [NO2]+[NO3]- нитрат нитрония Гидролиз: NCl3 + H2O = NH3 + HClO NOГ (Г = F, Cl, Br) нитрозилгалогениды NOГ + H2O = HNO2 + HГ NO2Г (F, Cl) нитрилгалогениды NO2Г + H2O = HNO3 + HГ Солеобразные соединения [NO]+X- (X = ClO4-, HSO4-) соли нитрозония [NO2]+X- (X = ClO4-, HSO4-) соли нитрония [NO2]+[NO3]- нитрат нитрония](https://prezentacii.org/upload/cloud/19/04/138352/images/thumbs/screen32.jpg)






























