Презентация "Металлоорганические соединения непереходных металлов" по химии – проект, доклад
Презентацию на тему "Металлоорганические соединения непереходных металлов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 26 слайд(ов).
Слайды презентации
Список похожих презентаций
Неметаллы. Кислородные соединения неметаллов
Кислоты. Высшим оксидам неметаллов соответствуют следующие кислоты. . Кислородосодержащие кислоты являются гидроксидами кислотных оксидов. По основности ...Соединения щелочноземельных металлов
Цели:. Обобщить и систематизировать знания о щелочноземельных металлах Уметь характеризовать элементы по положению в периодической таблице Знать физические ...Водородные соединения неметаллов
метан аммиак вода сероводород кислоты. Метан. Газ без цвета и запаха, малорастворим в воде, легче воздуха, горит бледным синеватым пламенем. Смесь ...Соединения щелочноземельных металлов
Соединения щелочноземельных металлов. Тип и класс веществ. Физические свойства. Химические свойства. Оксиды щелочноземельных металлов. . 15.03.2019. ...Алюминий и его соединения
Положение в Периодической системе. Алюминий располагается в 3 периоде, в главной подгруппе 3 группы. Порядковый номер элемента – 13 Относительная ...Химические свойства металлов
Цель урока:. обобщить знание учащихся, полученные ранее при рассмотрении общих химических свойств металлов; повторить особенности протекания реакций ...Физические свойства металлов
Модель строения атома. «Крестики-нолики». Na Fe B He F Al Ca Ba C Li Na Ca P Al F P Cu N. Цель урока:. изучить общие физические свойства металлов, ...Способы получения металлов
Электрометаллургический способ. Электрометаллургия методы получения металлов, основанные на выделении металлов из растворов или расплавов их соединений ...Руды металлов
Полезные ископаемые России, бывшего Советского Союза. . Гематит Гарниерит Лимонит Магнетит Халькопирит Галенит Пирит Боксит Сфалерит Пиролюзит. Формула ...Положение металлов в таблице Д.И. Менделеева. Особенности строения атомов, свойства
Цель урока: 1. на основе положения металлов в ПСХЭ прийти к пониманию особенностей строения их атомов и кристаллов (металлической химической связи ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Важнейшие представители бинарных соединений – оксиды и летучие водородные соединения
Н2О - вода. СО2 углекислый газ. СУХОЙ ЛЁД. NH3 аммиак. HCL хлороводород. Бесцветный газ. Тяжелее воздуха. Хорошо растворяется в воде. Раствор хлороводорода ...Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
SiO2 , H2O , CO2 , AI2O3 , Fe2O3 , CO. Всесильная стихия природы-вода во все времена, во все периоды истории покоряла ум и воображение людей. Человек ...Бинарные соединения
17.09.2018. Бинарные соединения: определение. Многообразие природных бинарных соединений. Вода Хлорид натрия Углекислый газ. Бинарные вещества состоят ...Бинарные соединения
ОПРЕДЕЛЕНИЕ. Бинарные соединения – это соединения, состоящие из двух химических элементов. H2O, NH3, K2S, P2O5, CaC2. Бинарные соединения - хлориды. ...Бинарные соединения
Классификация сложных веществ. Бинарные соединения – это вещества, состоящие из двух разных атомов. Как составить формулу бинарного соединения. Знать ...Нахождение металлов и их соединений в природе
«Человек не может обойтись без металлов. Если бы не металлы, человек влачил бы самую жалкую жизнь среди диких зверей» Г. Агрикола XVI век. Альманах ...Алюминий и его соединения
Учителя химии: Гершановская Евгения Владимировна ГБОУ СОШ № 880 Город Москва Попова Светлана Анатольевна ГБОУ СОШ № 1465 Город Москва. СОДЕРЖАНИЕ. ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Применение металлов
Применение металлов. Каждый металл используется по-своему: Алюминий. Легкий и прочный металл, особенно в сплавах. Основной материал при создании самолётов. ...Конспекты
Соединения щелочноземельных металлов
Урок. Соединения щелочноземельных металлов. . Урок на основе технологии критического мышления. Цель:. Рассмотреть важнейшие соединения элементов ...Общая характеристика неметаллов. Элементы IV А группы. Углерод, кремний и их соединения
План учебного занятия № 13. Дата Предмет. химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . І. Тема занятия:. Общая характеристика неметаллов. ...Водородные и кислородные соединения неметаллов
Описание методической разработки урока по химии. 1.Район: Кукморский. 2 Ф.И.ОГалимова Суфия Хатимовна. 3.Номинация: Методические материалы ...Общая характеристика металлов. Металлы главных и побочных подгрупп. Щелочные металлы и их важнейшие соединения
План учебного занятия № 10. Дата Предмет. химия. группа. Ф.И.О. преподавателя. : Кайырбекова И.А. . І. Тема занятия:. Общая характеристика металлов. ...Общая характеристика неметаллов. Элементы V А группы. Важнейщие соединения азота. Фосфор и его соединения
План учебного занятия № 14. Дата Предмет. химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . І. Тема занятия:. Общая характеристика неметаллов. ...Фосфор и его соединения
Тема урока: «Фосфор и его соединения». . Цель урока:. . • продолжить формирование понятий «элемент» и «вещество», а также показать многообразие ...Алюминий и его соединения
Технологическая карта урока по химии. подготовила учитель химии МБОУ СОШ № 1 г.Тимашевск. . ИСПАЛОВА НАТАЛЬЯ СЕРГЕЕВНА. Тема урока. . Алюминий ...Роль металлов и их соединений в природной среде и в живых организмах
Дата. . . Предмет химия. . Класс 9 Урок 45. . . . Название занятия. . . Роль металлов и их соединений в природной среде. и в живых ...Получение и свойства соединений металлов
Муниципальное общеобразовательное учреждение лицей. Технологическая карта урока по химии. Практическая работа. «Получение и свойства соединений ...Алюминий и его соединения
КГУ "Общеобразовательная школа-лицей при ПГК им. М. Жумабаева". Урок химии. Тема:. Алюминий и его соединения. 9 ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:1 декабря 2018
Категория:Химия
Содержит:26 слайд(ов)
Поделись с друзьями:
Скачать презентацию



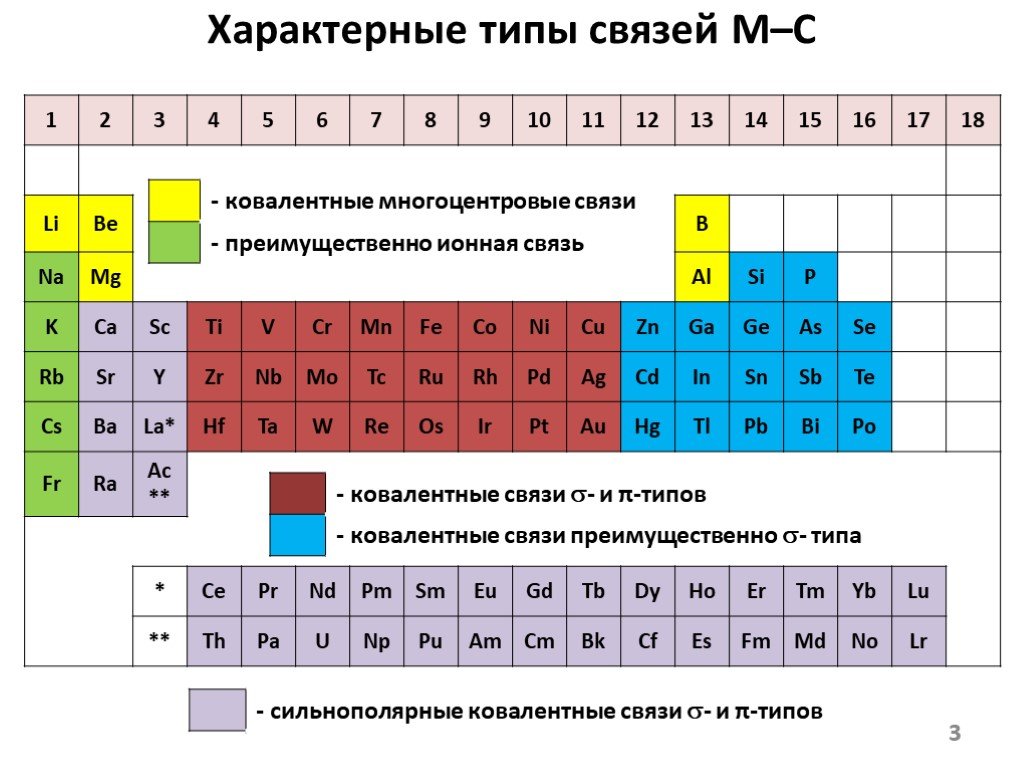
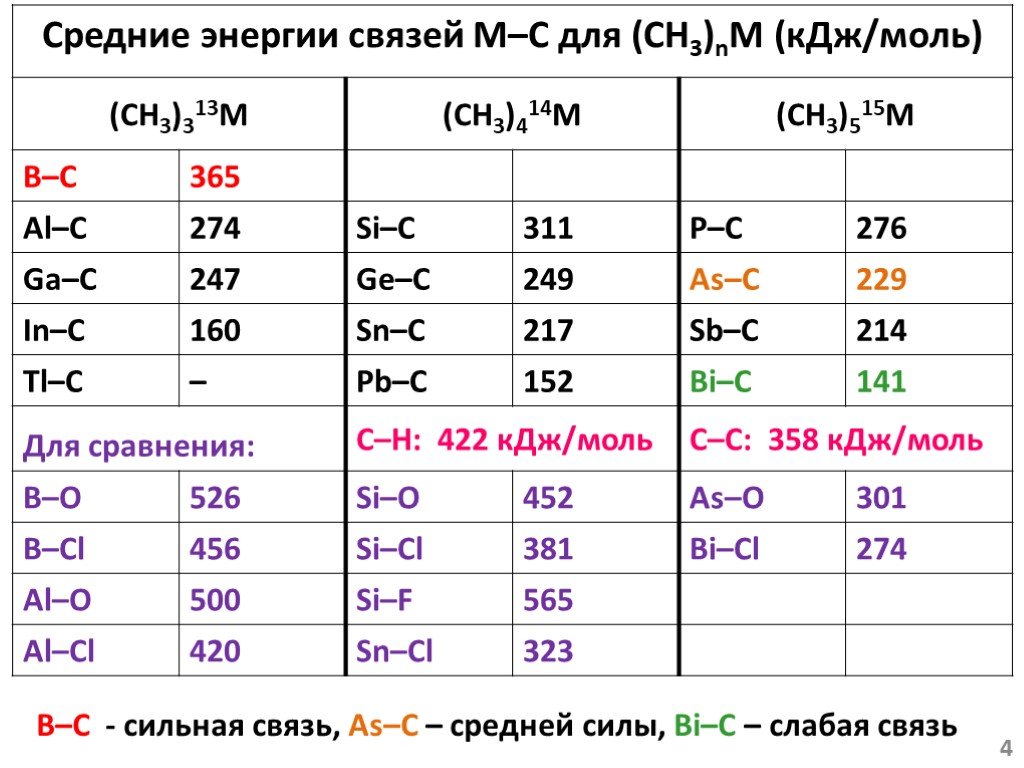

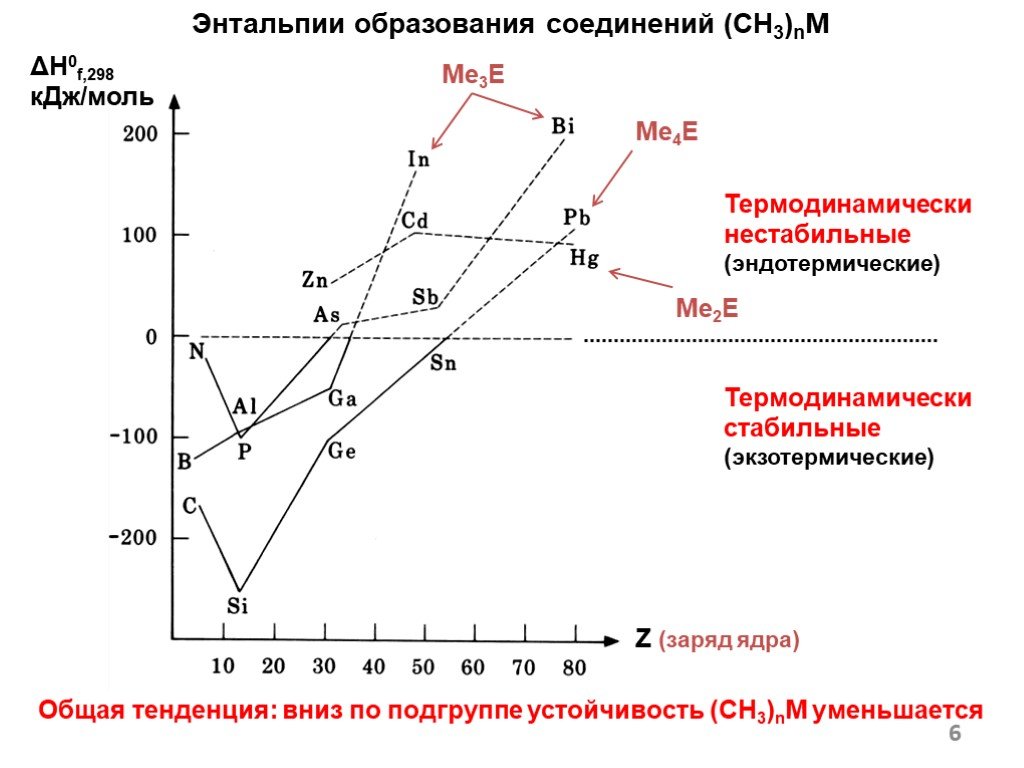






















![Основа подхода – окисление металла галогенуглеводородами 2M + nRX RnM + MXn M0 – ne– Mn+ R1+ + 2e– R–. Окислительное присоединение (подход [1]) Основа подхода – окисление металла галогенуглеводородами 2M + nRX RnM + MXn M0 – ne– Mn+ R1+ + 2e– R–. Окислительное присоединение (подход [1])](https://prezentacii.org/upload/cloud/18/12/108405/images/thumbs/screen9.jpg)
![Подход [1], примеры. Метод [1a] - «прямой синтез» - металл + галогенуглеводород 2Li + C4H9Br C4H9Li + LiBr Mg + C6H5Br C6H5MgBr. Реакции экзотермичны в случае наиболее электроположитель-ных металлов, образующих ионные и сильные ковалентные связи М–С. Метод неприемлем в случае металлов, образующ Подход [1], примеры. Метод [1a] - «прямой синтез» - металл + галогенуглеводород 2Li + C4H9Br C4H9Li + LiBr Mg + C6H5Br C6H5MgBr. Реакции экзотермичны в случае наиболее электроположитель-ных металлов, образующих ионные и сильные ковалентные связи М–С. Метод неприемлем в случае металлов, образующ](https://prezentacii.org/upload/cloud/18/12/108405/images/thumbs/screen10.jpg)
![Метод [1б] - «смешаннометаллический» - смесь металла-восстановителя + металл, соединение которого вы хотите получить: 2Na + Hg + 2CH3Br (CH3)2Hg + 2NaBr H0298 = – 530 кДж/моль H0f,298 (NaBr) = – 361 кДж/моль Удобен, если есть возможность использовать сплавы 4Na/Pb + 4C2H5Cl (C2H5)4Pb +3Pb + 4 Метод [1б] - «смешаннометаллический» - смесь металла-восстановителя + металл, соединение которого вы хотите получить: 2Na + Hg + 2CH3Br (CH3)2Hg + 2NaBr H0298 = – 530 кДж/моль H0f,298 (NaBr) = – 361 кДж/моль Удобен, если есть возможность использовать сплавы 4Na/Pb + 4C2H5Cl (C2H5)4Pb +3Pb + 4](https://prezentacii.org/upload/cloud/18/12/108405/images/thumbs/screen11.jpg)
![Метод [1в] – окисление металлов в промежуточной степени окисления: PbI2 + CH3I (CH3)PbI3. Pb2+ – 2e– Pb4+ (CH3)+ + 2e– (CH3) – Метод [1в] – окисление металлов в промежуточной степени окисления: PbI2 + CH3I (CH3)PbI3. Pb2+ – 2e– Pb4+ (CH3)+ + 2e– (CH3) –](https://prezentacii.org/upload/cloud/18/12/108405/images/thumbs/screen12.jpg)
![Трансметаллирование (подход [2]). Основа подхода – восстановление металлоорганического соединения менее электроположительного металла более электроположительным M + RM’ RM + M’ Пример: Zn + (CH3)2Hg (CH3)2Zn + Hg H0298 = – 35 кДж/моль Метод [2] применим для 1M; 2M; 3M; 13M = Al, Ga; 14M = Sn, Трансметаллирование (подход [2]). Основа подхода – восстановление металлоорганического соединения менее электроположительного металла более электроположительным M + RM’ RM + M’ Пример: Zn + (CH3)2Hg (CH3)2Zn + Hg H0298 = – 35 кДж/моль Метод [2] применим для 1M; 2M; 3M; 13M = Al, Ga; 14M = Sn,](https://prezentacii.org/upload/cloud/18/12/108405/images/thumbs/screen13.jpg)
![Обмен металлов (подход [3]). Основа подхода – вывод одного из продуктов в другую фазу (чаще, в осадок) RM + R’M’ R’M + RM’ Пример: 4PhLi + (CH2=CH)4Sn 4(CH2=CH)Li + Ph4Sn (в не- или малополярных апротонных растворителях) Обмен металлов (подход [3]). Основа подхода – вывод одного из продуктов в другую фазу (чаще, в осадок) RM + R’M’ R’M + RM’ Пример: 4PhLi + (CH2=CH)4Sn 4(CH2=CH)Li + Ph4Sn (в не- или малополярных апротонных растворителях)](https://prezentacii.org/upload/cloud/18/12/108405/images/thumbs/screen14.jpg)
![Метатезис (подход [4]) (нуклеофильное замещение галогена на R). Движущая сила – образование галогенида электроположительного металла nRM + M’Xn RnM’ + nMX Пример: 3(CH3)Li + SbCl3 (CH3)3Sb + 3LiCl Один из наиболее распространенных подходов! Имеется возможность «играть» на нерастворимости галог Метатезис (подход [4]) (нуклеофильное замещение галогена на R). Движущая сила – образование галогенида электроположительного металла nRM + M’Xn RnM’ + nMX Пример: 3(CH3)Li + SbCl3 (CH3)3Sb + 3LiCl Один из наиболее распространенных подходов! Имеется возможность «играть» на нерастворимости галог](https://prezentacii.org/upload/cloud/18/12/108405/images/thumbs/screen15.jpg)
![Замещение галогена на металл в реакции арилгалогенидов с алкиллитием (подход [5]). RLi + ArX RX + ArLi Пример: n-BuLi + PhX n-BuX + PhLi (X = Br, I очень редко Cl, но не F!) Реакция замещения галогена на литий очень быстрая, поэтому метод может быть использован для замещенных арилов (NO2, CONR2, Замещение галогена на металл в реакции арилгалогенидов с алкиллитием (подход [5]). RLi + ArX RX + ArLi Пример: n-BuLi + PhX n-BuX + PhLi (X = Br, I очень редко Cl, но не F!) Реакция замещения галогена на литий очень быстрая, поэтому метод может быть использован для замещенных арилов (NO2, CONR2,](https://prezentacii.org/upload/cloud/18/12/108405/images/thumbs/screen16.jpg)
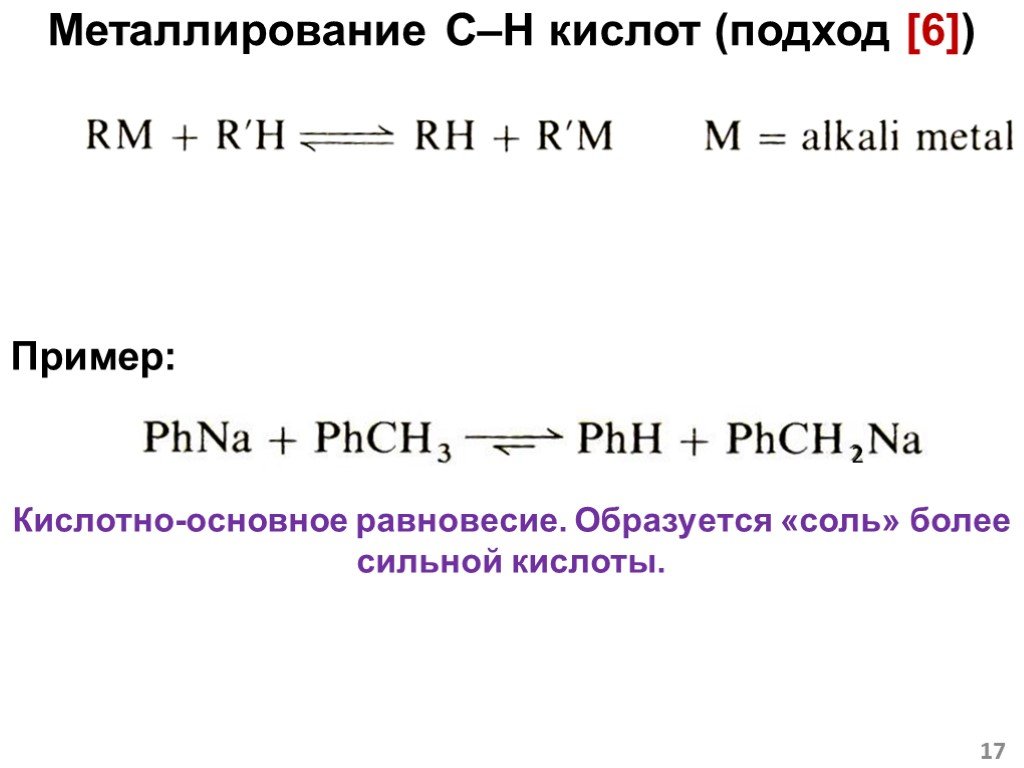
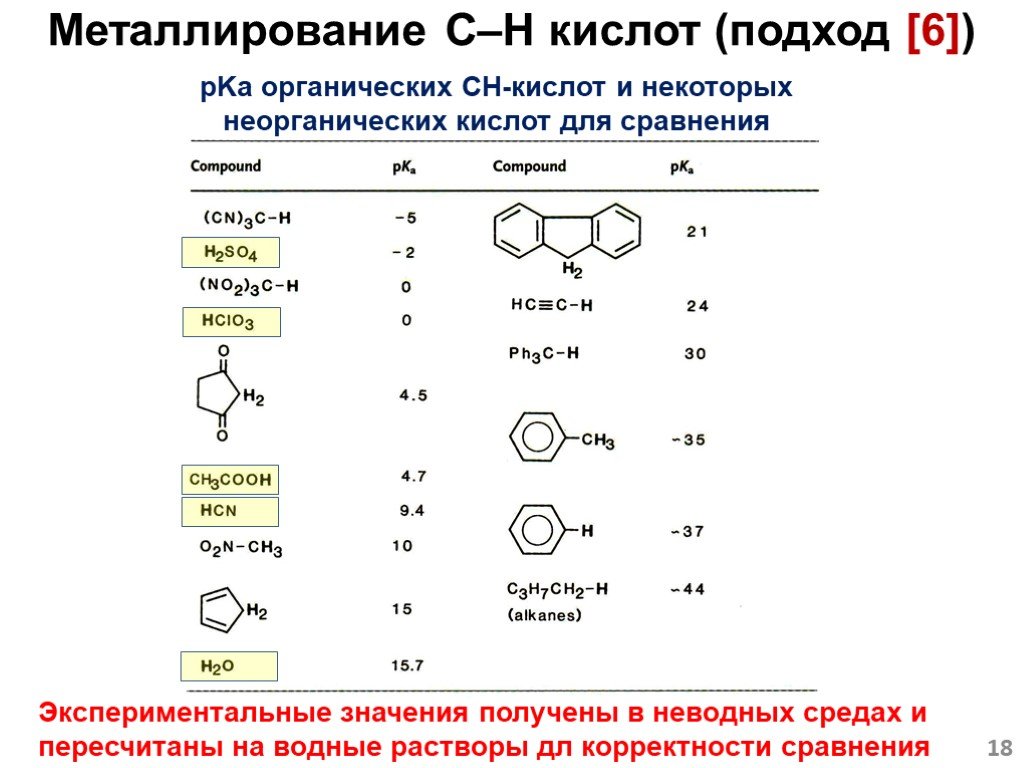
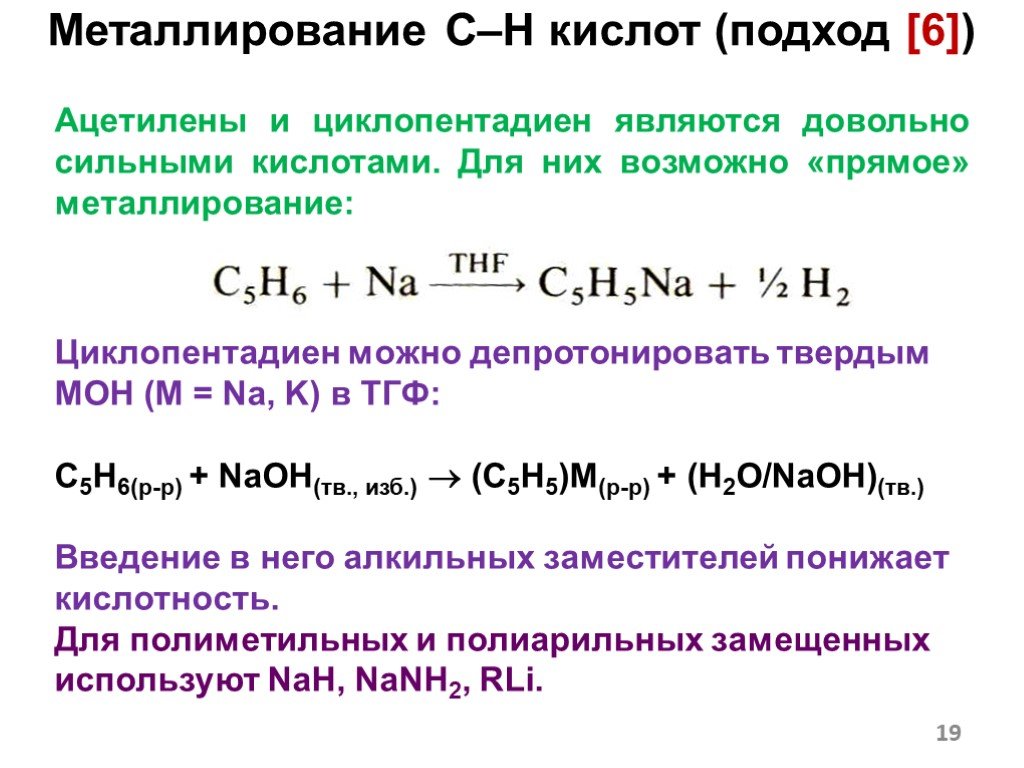
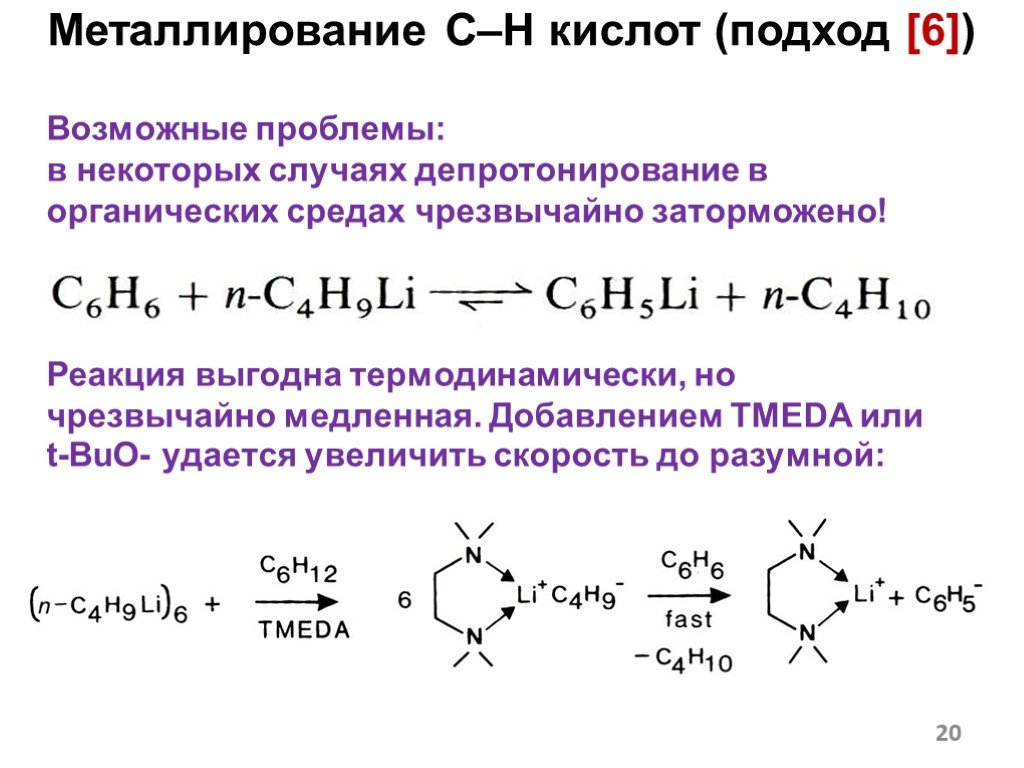
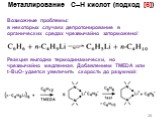
![Металлирование C–H кислот (подход [6]). Пример: Кислотно-основное равновесие. Образуется «соль» более сильной кислоты. 2 Металлирование C–H кислот (подход [6]). Пример: Кислотно-основное равновесие. Образуется «соль» более сильной кислоты. 2](https://prezentacii.org/upload/cloud/18/12/108405/images/thumbs/screen17.jpg)


![Меркурирование C–H кислот (подход [7]) (особый случай металлирования!). Первая стадия – легко, вторая требует более жестких условий. Пример: Реакция протекает в протонных средах, не требует тщательной защиты от воздуха и влаги, а ртуть позже может быть «трансметаллирована»! Меркурирование C–H кислот (подход [7]) (особый случай металлирования!). Первая стадия – легко, вторая требует более жестких условий. Пример: Реакция протекает в протонных средах, не требует тщательной защиты от воздуха и влаги, а ртуть позже может быть «трансметаллирована»!](https://prezentacii.org/upload/cloud/18/12/108405/images/thumbs/screen21.jpg)
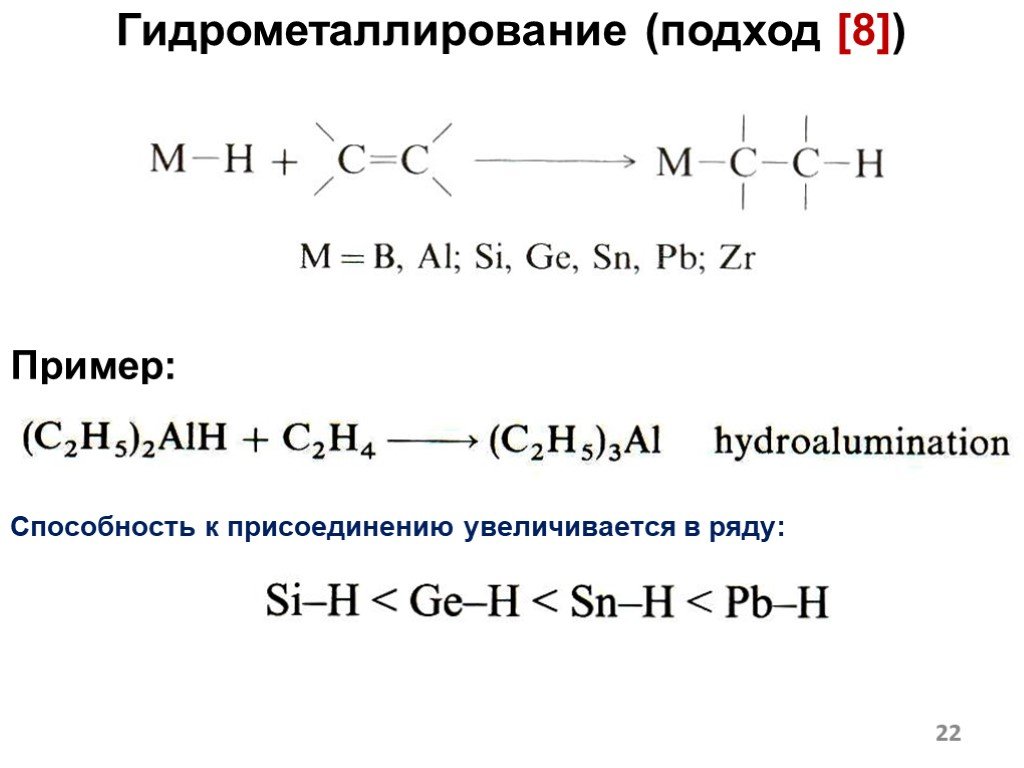
![Гидрометаллирование (подход [8]). Пример: Способность к присоединению увеличивается в ряду: Гидрометаллирование (подход [8]). Пример: Способность к присоединению увеличивается в ряду:](https://prezentacii.org/upload/cloud/18/12/108405/images/thumbs/screen22.jpg)
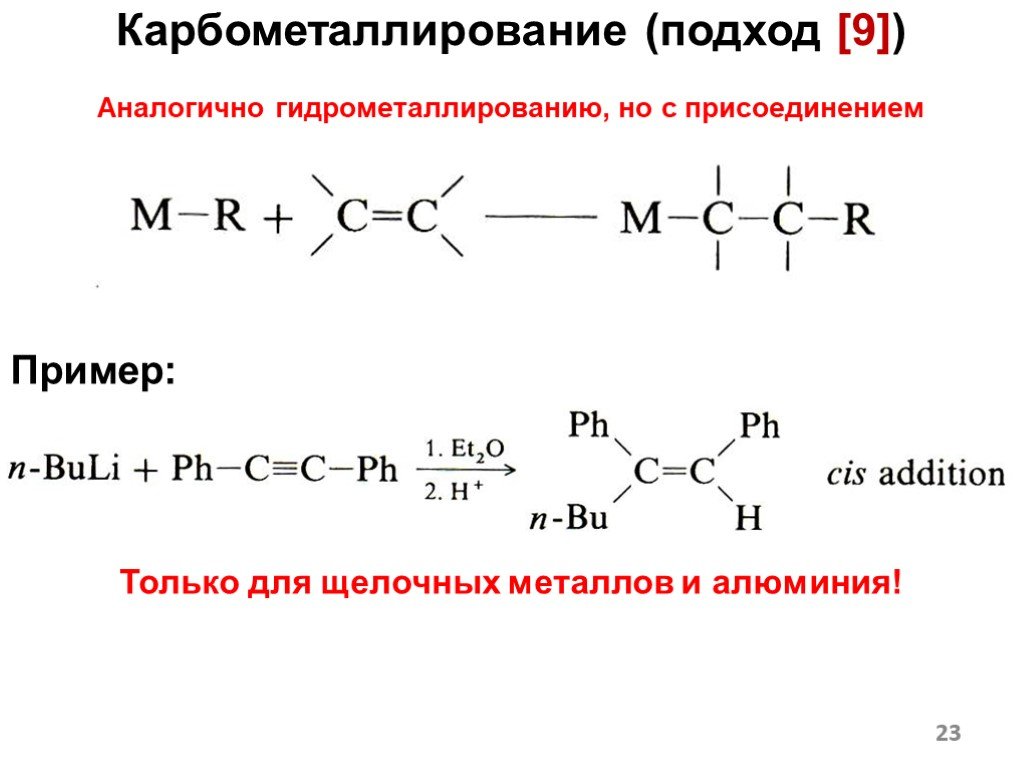
![Карбометаллирование (подход [9]) Аналогично гидрометаллированию, но с присоединением углеводородного радикала. Пример: Только для щелочных металлов и алюминия! Карбометаллирование (подход [9]) Аналогично гидрометаллированию, но с присоединением углеводородного радикала. Пример: Только для щелочных металлов и алюминия!](https://prezentacii.org/upload/cloud/18/12/108405/images/thumbs/screen23.jpg)
![Внедрение карбенов (подход [10]). Примеры: Обычно карбены внедряются по связи M–H и M–X, внедрение по связи M–C не происходит! Внедрение карбенов (подход [10]). Примеры: Обычно карбены внедряются по связи M–H и M–X, внедрение по связи M–C не происходит!](https://prezentacii.org/upload/cloud/18/12/108405/images/thumbs/screen24.jpg)
![Декарбоксилирование (подход [11]). Важно!!! Радикалы R должны быть сильноакцепторными: C6F5, CF3, CCl3, и т.п. Металлоорганические гидриды могут быть получены разложением соответствующих формиатов: Декарбоксилирование (подход [11]). Важно!!! Радикалы R должны быть сильноакцепторными: C6F5, CF3, CCl3, и т.п. Металлоорганические гидриды могут быть получены разложением соответствующих формиатов:](https://prezentacii.org/upload/cloud/18/12/108405/images/thumbs/screen25.jpg)
![Арилирование через соли диазония (подход [12]). Применение метода очень ограничены. Особое значение имеет, пожалуй, только для мышьякорганики. Арилирование через соли диазония (подход [12]). Применение метода очень ограничены. Особое значение имеет, пожалуй, только для мышьякорганики.](https://prezentacii.org/upload/cloud/18/12/108405/images/thumbs/screen26.jpg)






























