Презентация "Валентные состояния атома углерода" по химии – проект, доклад
Презентацию на тему "Валентные состояния атома углерода" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 14 слайд(ов).
Слайды презентации
Список похожих презентаций
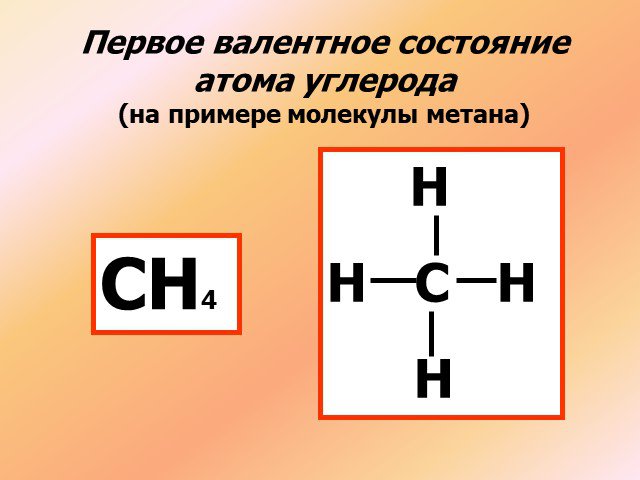
Строение атома углерода
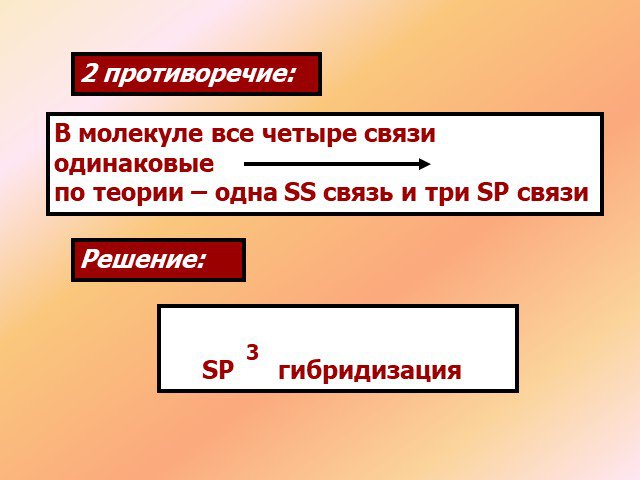
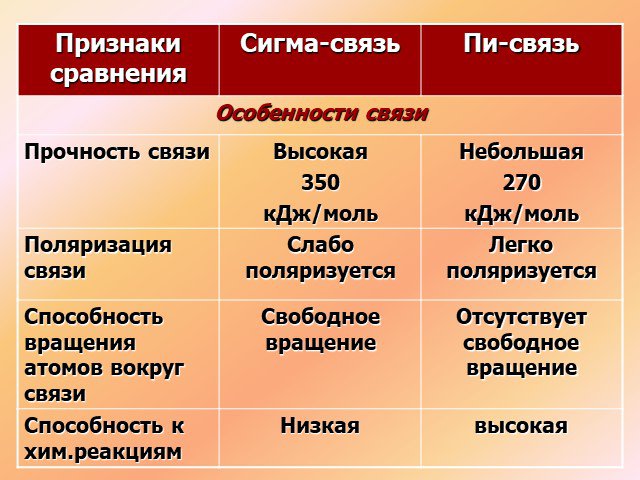
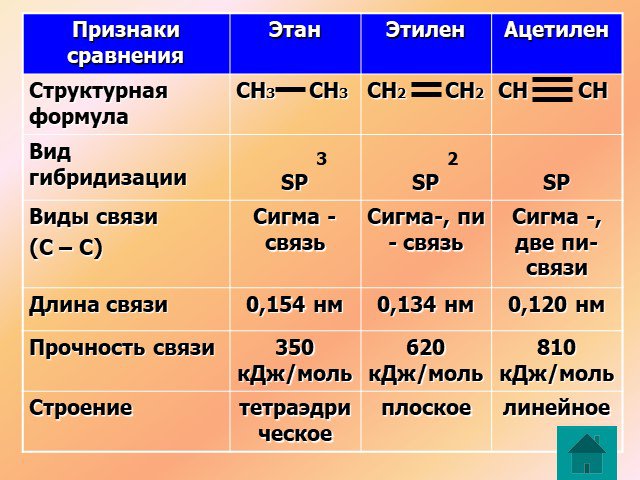
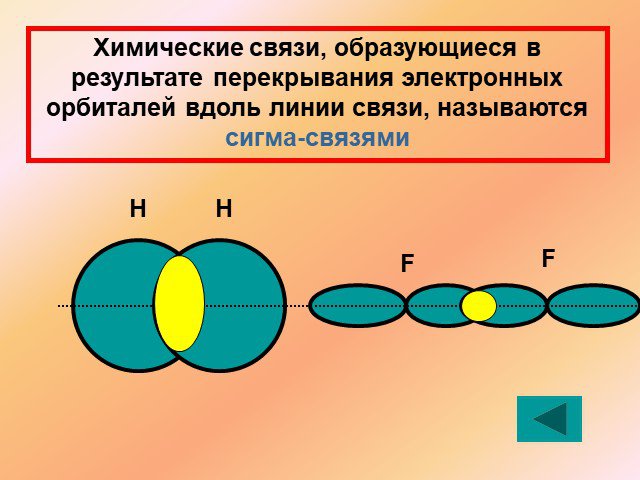
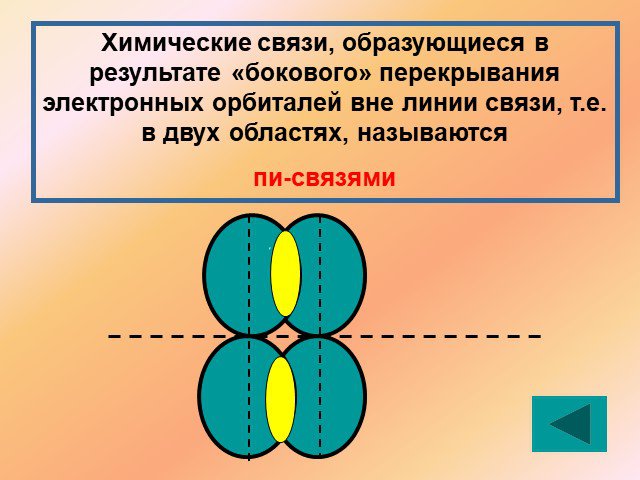
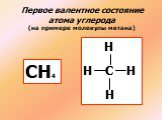
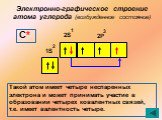
↓ ↓↑. Валентность углерода IV. Валентность углерода II. Строение атома углерода. 6 С 2е4е 1S2 2S2 2P2 6 С 2е4е 1S2 2S1 2P3. Гибридизация. Гибридизация ...Подгруппа углерода
Цель урока:. Выяснить насколько усвоен материал по теме, дополнить знания учащихся об оксидах углерода и кремния и других соединениях. Совершенствовать ...Подгруппа углерода
Загадка: Из меня состоит все живое: Я – графит, антрацит и алмаз, Я на улице, в школе и в поле, Я в деревьях и в каждом из вас. Работа с учебником ...Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома
ДЕВИЗ УРОКА:. Чтобы стать настоящим химиком, надо знать, уметь, думать!". ЭПИГРАФ УРОКА:. «… Другого ничего в природе нет, Ни здесь, ни там, в космических ...Фуллерены – молекулярная форма углерода
Виды молекул фуллеренов: чётное число атомов углерода в молекуле С60, С70, С72, С74, С76, С108, С960 и т.д. Поверхность «мяча» образована пяти- и ...Структура ячейки на примере атома железа
Периоды Группы 1 3 4 5 6 7 I II III IV V VII VIII VI малые большие А Б. Условная граница от бора до астата. Бор Кремний Мышьяк Теллур Астат Металлы ...Кислородные соединения углерода
Без углерода не существует ни одного растения или животного... Кристаллическая решетка графита (плоскостная). Кристаллическая решетка алмаза (тетраэдрическая). ...Строение атома и атомного ядра
1896 г. Анри Беккерель (франц.) открыл явление радиоактивности. Радиоактивность – способность атомов к самопроизвольному излучению. 1899 г. Эрнест ...Законы газового состояния вещества
Ваша цель: 1.Познакомиться с молярным объемом газов; 2. Изучить основные законы химии: закон Авогадро, закон Гей – Люссака; 3. Научится решать типовые ...Изменения в составе ядра атома
Что означают записи:. 3CO2, 2K, O2, 3O2, 4H2O, 5H2SO4, O3. Разделите указанные вещества вещества на 2 группы. Запишите с помощью химических формул. ...Гибридизация атомов углерода
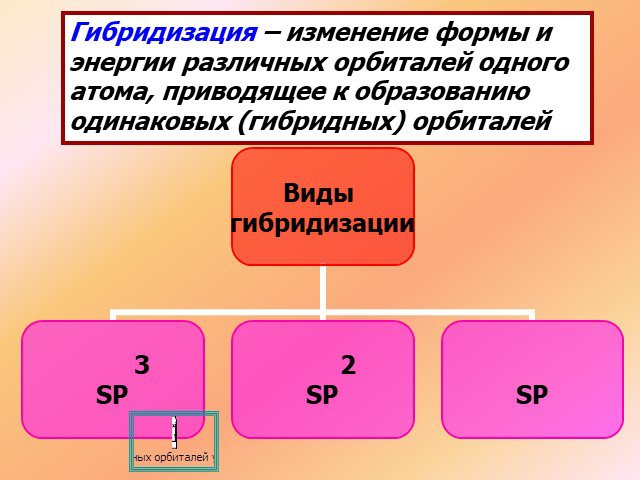
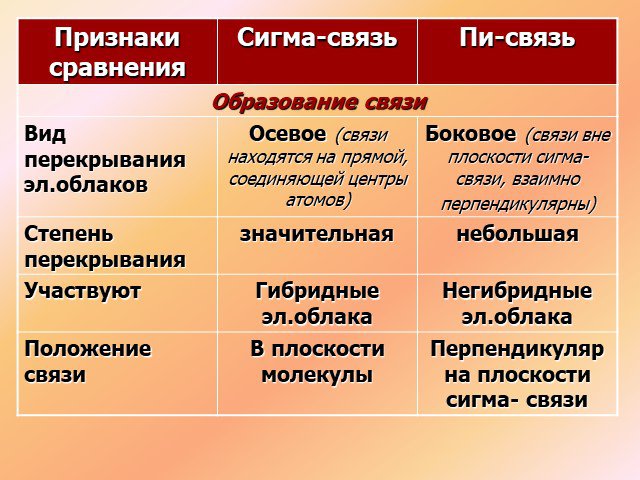
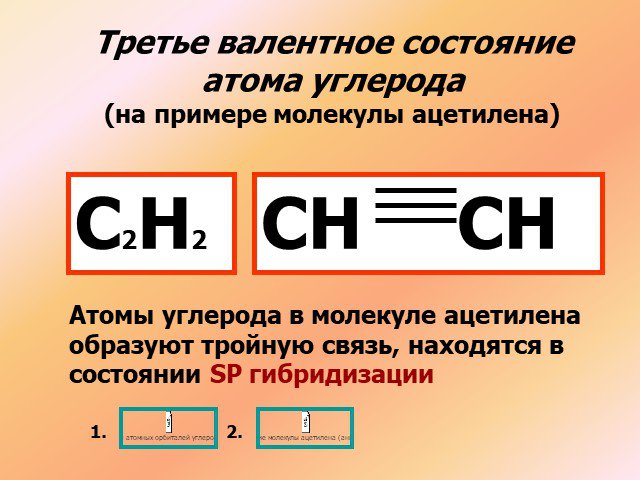
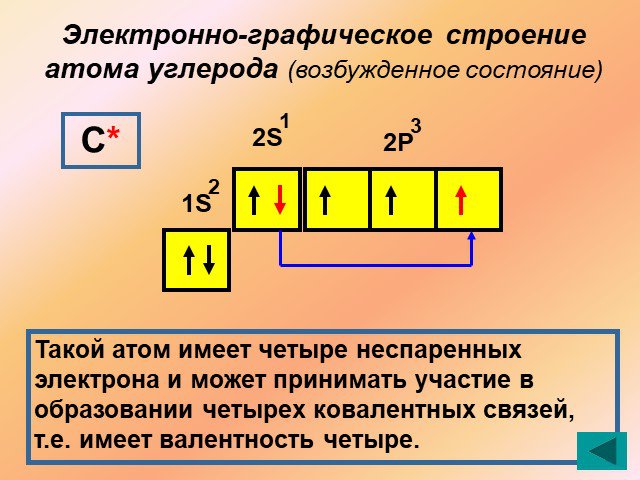
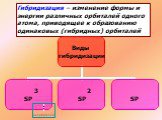
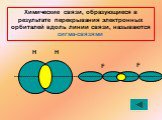
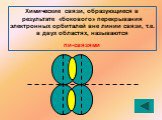
1s sp3 – ГИБРИДИЗАЦИЯ. Электронная структура атома углерода. С – 1s22s22p2 С* – 1s22s12p3. Процессы выравнивания орбиталей по форме и энергии называют. ...Будова атома
Дмитро Іванович Менделєєв. Пригадайте: Яку дату вважають “Днем народження” періодичного закону? Що було взято вченим за основу при створенні періодичного ...Аллотропные видоизменения углерода Многоликий углерод
Основной вопрос: Каким образом разное бывает единым? Вопрос учебной темы: Каковы особенности строения углерода? Почему углерод многолик? Учебные предметы: ...Строение атома
Планетарная модель атома. электрон +. Общий заряд атома равен 0. - 3. Сравнение размеров ядра и электрона. Распределение электронов по электронным ...Кислородные соединения углерода
Угарный газ (СО)содержится в выхлопных газах автомобилей. Воздух, окутывающий Землю, содержит около 3 млрд. т. СО2. План изучения веществ. Состав ...Строение атома
Маленькая точка, сделанная карандашом, состоит из огромного количества атомов, большего, чем количество жителей на Земле ! Демокрит. В основе философии ...Кислородные соединения углерода
Взаимопроверка. Отметка: 10 правильных ответов – «5» 8-9 правильных ответов – «4» 5-7 правильных ответов – «3» Менее 5 – «2». Урок химии в 9 классе ...Строение атома и периодическая система
Какие открытия сделали ученые? 1. И.В. Деберейнер 2. А. Шанкуртуа 3. Л. Мейер 4. Д. Ньюлендс 5. М. Складовская - Кюри 6. А. Беккерель 7. Э. Резерфорд ...Круговорот углерода
КРУГОВОРОТ УГЛЕРОДА. Зависит как от биохимических, так и от физических процессов. АТМОСФЕРНЫЙ УГЛЕКИСЛЫЙ ГАЗ. Наиболее доступный источник углерода, ...Строение атома, химическая связь
Цель урока:. Обобщить и систематизировать знания по теме «Строения атома, химическая связь». Задание № 1 Определите химический элемент по распределению ...Конспекты
Строение атома
Контрольная работа по теме «Строение атома». Часть А. 1. Определите химический элемент по составу его атома - 18 p. +. , 20 n. 0. , 18 e. -. :. ...Путешествие в мир атома
Конспект урока химии в 8 классе. Учитель Сергеева Галина Борисовна. Тема урока « Путешествие в мир атома». Цель: изучение основных сведений о ...Состав и строение атома
Тема: Состав и строение атома. Образовательная. : сформировать представления о строении атома; дать понятие протон, электрон, нейтрон. Развивающая. ...Азот. Строение атома и молекулы, свойства простого вещества
Тема урока. «. Азот. Строение атома и молекулы, свойства простого вещества. » 9-й класс. . Цель урока:. . . изучение строения атома и молекулы ...Превращения углерода в природе
МУНИЦИПАЛЬНОЕ АВТОНОМНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №5 ИМЕНИ Ю.А.ГАГАРИНА г. ТАМБОВА. Интегрированное ...Строение атома
Тема урока: “Строение атома”. Тип урока:. урок ознакомления с новым материалом. . . Цель:. дать понятие о составе атома и составе атомного ядра; ...Углерод, аллотропия углерода. Химический свойства и применение углерода
Конспект урока по теме:. «Углерод, аллотропия углерода, физические и химический свойства. . . Применение углерода.». Выполнила:. Учитель ...Основные сведения о строении атома
Унковская Светлана Андреевна. МБОУ СОШ №18 г.Ставрополь. учитель химии. Тема урока: «Основные сведения о строении атома». Цель урока. ...Основные сведения о строении атома
Урок по химии 8 класс. «Основные сведения о строении атома». Запольская Елена Николаевна учитель химии и биологии. . МБОУ «СОШ№3 г.Мамадыш». ...Оксиды углерода
Цель. : сформировать знания об оксиде углерода (II) и оксиде углерода (IV). Задачи:. На основе электронного строения атома углерода определить ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Пивкина Лариса Анатольевна
Содержит:14 слайд(ов)
Поделись с друзьями:
Скачать презентацию