Презентация "Законы газового состояния вещества" по химии – проект, доклад
Презентацию на тему "Законы газового состояния вещества" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 36 слайд(ов).
Слайды презентации
Список похожих презентаций
Агрегатные состояния вещества
План урока. Определение целей урока Выполнение лабораторного исследования Определение основных следствий эксперимента Решение качественных задач Решение ...Агрегатные состояния вещества
1. Учение об агрегатных состояниях 1.3. Жидкое состояние вещества. 1.3.1. Основные понятия Жидкое агрегатное состояние является промежуточным между ...Сложные вещества
Классы неорганических соединений. Оксиды. Оксиды металлов CuO – оксид меди Fe2O3 – оксид железа Na2O – оксид натрия. Оксиды неметаллов SO3 - оксид ...Простые вещества металлы
медь. серебро. ртуть. Металлы, простые вещества, обладающие в обычных условиях, характерными физическими и химическими свойствами. 1. Характерные ...Простые вещества
Вопрос №1. Число твердых при обычных условиях неметаллов среди перечисленных веществ: Ne, S, Cl2, O2, I2, H2 равно: 1) 2 2) 3 3) 4 4) 6. Вопрос №2. ...Предмет органической химии. Органические вещества
Что изучает органическая химия? Какие вещества относят к органическим? Приведите примеры. Какую роль играют органические вещества в современной жизни? ...«Химические вещества в повседневной жизни человека»
Цель урока. Обобщить знания о химических веществах, применяемых в повседневной жизни человека; Акцентировать внимание на экологических проблемах чистой ...Чистые вещества и смеси
В природе практически нет чистых веществ. Чистая вода кипит при температуре 1000C и температуру замерзает при 00C. Морская вода замерзает при более ...Химическая организация клетки. Неорганические вещества
Вещества клетки Неорганические Органические Вода Минеральные соли белки жиры углеводы. Элементы клетки микроэлементы биоэлементы макроэлементы H, ...Агрегатное состояние вещества
Твердое тело. Состояние, характеризующееся способностью сохранять объём и форму. Атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния ...Агрегатное состояние вещества
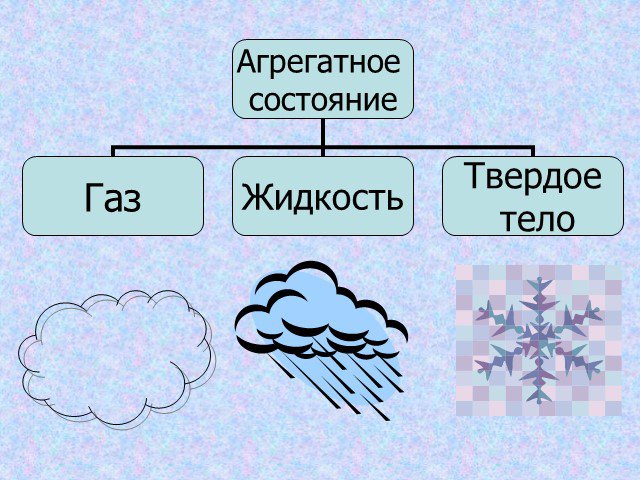
Существуют 3 основных агрегатных состояния вещества. Газообразное Твердое Жидкое. Чем же различаются данные вещества. Агрегатное состояние. Различия. ...Агрегатное состояние вещества
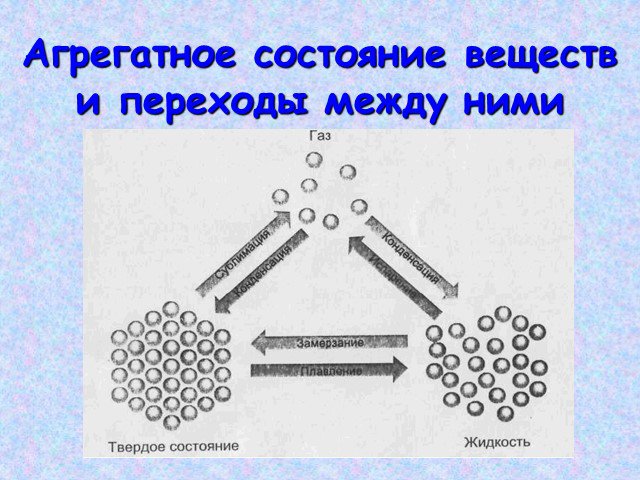
Общие понятия. Агрегатное состояние вещества- состояние вещества, характеризующееся определенными качественными свойствами. Строение твердых тел. ...Агрегатное состояние вещества
Три состояния вещества. Газ Жидкость Твердое тело. Твердое. Жидкое. Газообразное состояние. Процессы с поглощением и выделением тепла. Плавление Парообразование ...Строение вещества
Вещество – то, из чего состоит физическое тело. Состояние вещества. Твердое Жидкое Газообразное. Твердое Жидкое Газообразное Стекло Железо Соль. Твердое ...Валентные состояния атома углерода
Первое валентное состояние атома углерода (на примере молекулы метана). СН4 Н Н С Н Н. Два «противоречия» в строении метана:. Валентность углерода ...Твердые вещества
1)познакомить учащихся с понятием аморфные вещества и кристаллические решетки; 2)дать понятие о типах кристаллических решеток 3)рассмотреть свойства ...Вычисления массовой доли растворенного вещества
. Задачи ЕГЭ.1. Массовая доля серной кислоты в растворе, полученном при смешивании 120г 20 %-го и 40г 50 %-го растворов кислоты, равна ……...% (Запишите ...
Химические вещества и опасные объекты
Элементы содержания. Промышленные аварии с выбросом опасных химических веществ. Химически опасные объекты производства. Требования к уровню подготовки ...Газообразное состояние вещества
Цели урока:. Рассмотреть особенности газообразных веществ. Выделить важнейшие природные смеси газов. Обозначить основные экологические проблемы атмосферы. ...Чистые вещества и смеси
ВОПРОСЫ:. Какие соединения называют оксидами? Какие соединения называют кислотами? Какие соединения называют основаниями? Какие соединения называют ...Конспекты
Решение расчетных задач на вывод химической формулы органического вещества
Муниципальное бюджетное общеобразовательное учреждение. «Средняя общеобразовательная школа №55» г. Брянска. Урок по теме:. «Решение ...Химическая организация клетки. Неорганические вещества
Тема: «Химическая организация клетки. Неорганические вещества». Цели урока:. Образовательные. : сформировать знания о роли химических элементов, ...Растворы. Вычисление массовой доли растворённого вещества в растворе
Муниципальное бюджетное общеобразовательное учреждение. . «Средняя общеобразовательная школа №1». Технологическая карта урока по теме. ...Решение задач на определение молекулярной формулы вещества
Муниципальное бюджетное общеобразовательное учреждение. «Средняя общеобразовательная школа №17» г. Брянска. Урок на тему: «Решение задач ...Чистые вещества и смеси. Способы разделения смесей
Урок химии в 8 классе. Тема: Чистые вещества и смеси. . Способы разделения смесей. Урок разработан на основе программы курса для 8 класса общеобразовательных ...Алюминий. Строение атома, физические и химические свойства простого вещества
ПЛАН-КОНСПЕКТ УРОКА. Тема: Алюминий. Строение атома, физические и химические свойства простого вещества. . . ФИО (полностью). . Иванова ...Металлы – простые вещества с использованием ИКТ на уроке
Конспект урока химии (по программе О.С. Габриеляна) в 8 классе на тему «Металлы – простые вещества с использованием ИКТ на уроке». Автор: Карачева ...Чистые вещества и смеси
8 класс. Тема урока:. Чистые вещества и смеси. Цели урока:. дать понятие о чистом веществе и смеси веществ; раскрыть значение смесей в природе ...Количество вещества
. МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ. . ШКОЛА №13. . Конспект урока. по химии в 8классе. ...Металлы – простые вещества
Урок химии в 8 классе по теме. «Металлы – простые вещества». Задачи:. . Образовательные:. Сформировать у учащихся знания о том, что металлам ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Ивкина Н.А.
Содержит:36 слайд(ов)
Поделись с друзьями:
Скачать презентацию