Конспект урока «Состав и строение атома» по химии
Тема: Состав и строение атома.
Образовательная: сформировать представления о строении атома; дать понятие протон, электрон, нейтрон.
Развивающая: характеризовать элементарные частицы (протон, электрон, нейтрон); определять элементарные частицы атома; развивать стремление самостоятельно добывать знания.
Воспитательная: воспитывать стремление к самообразованию и самосовершенствованию, прививать умение сотрудничества и объективного оценивания своей работы и работы других учащихся.
Этапы урока
I Организация начала урока
Цель: Настроить учащихся на урок. Здравствуйте ребята, садитесь. Надеюсь на сотрудничество и плодотворную работу на сегодняшнем уроке химии.
II Актуализация опорных знаний
Цель: Активизировать деятельность учащихся на выявление опорных знаний (существование химического элемента в трех формах: свободные атомы, простые вещества и сложные вещества; уметь определять порядковый номер химического элемента и его относительную атомную массу при помощи «Периодической системы химических элементов Д.И.Менделеева»).
Ребята! Вы можете дать определения следующим понятиям?
-
Химия (это наука о веществах, свойствах и их превращениях)
-
Физическое тело (это все то, что нас окружает)
-
Вещество (это то, из чего состоит физическое тело)
-
Из чего состоит большая часть веществ? (из молекул)
-
А чем образованы молекулы? (атомами)
-
А что входит в состав атома?
Вот чтобы ответить на этот вопрос нам и поможет тема сегодняшнего урока.
И так тема: «Состав и строение атома»
Зная состав и строение атомов химических элементов, мы можем определить свойства веществ, а следовательно, их применение.
Медь – металла, проводит электрический ток – электропровода.
Алюминий – металл, легкий, самолетостроение.
Алмаз - образован атомами углерода, самый твердый, стеклорезы, сверла.
Графит – образован атомами углерода, мягкий , самый тугоплавкий твердые смазки, стержни карандашей.
Сегодня мы познакомимся со строением атома, с его элементарными частицами (протон, электрон, нейтрон), научимся определять элементарные частицы атома.
Для работы нам потребуется лист с наглядным материалом, он называется также как и тема нашего урока и рабочий лист учащегося, не забудь те его подписать.
Ребята! Вспомните, пожалуйста, в каких формах существует химический элемент?
-
Свободные атомы
-
Простое вещество
-
Сложное вещество
Что показывает относительная атомная масса? (Во сколько раз масса данного химического элемента больше 1/12 массы атома углерода)
1 этап
Для тог, чтобы понять, как вы умеете использовать эти знания, я вам предлагаю выполнить задание № 1 на листе с наглядными материалами.
Даны следующие химические элементы:
P (фосфор), O2 (кислород), K2O (оксид калия), K (калий), N2 (азот), NaCl (хлорид натрия), S (сера).
Задание.
-
Определите форму химического элемента.
-
Определите порядковый номер химических элементов, которые находятся в форме свободных атомов.
-
Определите относительную атомную массу химических элементов, которые находятся в форме свободных атомов.
Обменялись друг с другом листами, проверили, а затем сверили с правильным ответом на доске.
III Изучение нового материала
Цель: сформировать представления о строении атома; дать понятие протон, электрон, нейтрон.
Понятие атом возникло еще в античном мире для обозначения частиц вещества. В переводе с греческого «атом» означает «неделимый». Но благодаря научным открытиям: физика Стони, Джозефа Томсона, Жана Перрена, Анри Беккереля и Эрнеста Резерфорда доказано, что атом сложная частица.
2 этап
Задание № 1
Рассмотрите планетарную модель строения атома:
1. Допишите предложения.
2. Ответьте на вопрос: Почему модель атома называется планетарной?
В центре атома находится положительно заряженное ………….., которое состоит из элементарных частиц …………………… и ………………………..
Заряд ядра равен числу ………………..в нем.
Вокруг ядра с большой скоростью движутся отрицательно заряженные …………….. по …………………………………………………….
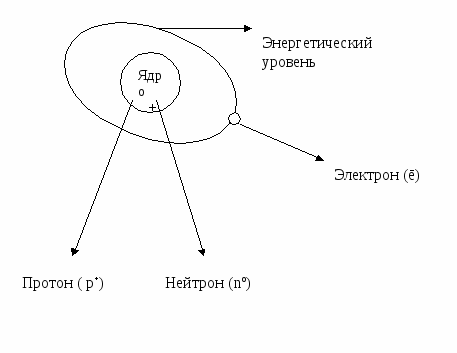
Модель атома называется планетарной, потому что………………………………...
……………………………………………………………………………………………………
Задание № 2.
Прочитайте и заполните таблицу. Характеристика элементарных частиц
-
Протоны р+ - это положительная элементарная частица с массой, равной единице и зарядом +1. Число протонов определяется по порядковому номеру (Z) элемента. р+ = Z .Пример: р+ (Р) = 15, т.к. порядковый номер фосфора 15.
-
Нейтроны nо – это элементарные частицы с массой, равной единице, незаряженные. Число нейтронов определяется вычитанием протонов из относительной атомной массы. nо = Ar– р+. Пример: nо (К) =39 – 19=20, где 39 –это атомная масса калия, а 19 – это его порядковый номер.
-
Электроны - это отрицательные элементарные частицы, с ничтожно малой массой 1/1837 и зарядом -1. Число электронов определяется по порядковому номеру (Z) элемента. ē = Z. Пример: ē (О) = 8, т.к. порядковый номер кислорода 8.
Массовое число А = р+ + nо
Атом – электронейтрален, т.к. число р+ = числу ē.
| Масса | Заряд | Определяется | |
| | | | |
| | | | |
| | | | |
Беседа по вопросам учителя для установления уровня осмысления учащимися новых понятий, проверка понимания учащимися сущности новых понятий.
Пример определения: р+(Р) = 15, ē (Р) = 15, nо (Р) =31 – 15=16, А (Р) =15+16= 31, Z = 15
IV Контроль
Цель: установить уровень осмысления содержания новых понятий, применять новые понятия
Задание № 3
Выполните задание, используя периодическую систему химических элементов Д.И.Менделеева
| Знаки химических элементов | |||||
| Na | P | Al | F | Ca | |
| Порядковый номер в таблице Д.И.Менделеева | | | | | |
| Число протонов р+ | | | | | |
| Число электронов ē | | | | | |
| Число нейтронов nо | | | | | |
| Массовое число А | | | | | |
| Заряд ядра атома, Z | | | | | |
VII этап закрепления новых знаний
Задание № 4
Соотнесите и соедините:
Термины Описание:
Протон Заряд равен -1
Электрон Заряд равен +1
Нейтрон Сумма р+ и nо
Массовое число Электронейтральная частица
Заряд ядра Масса 1/1837
Масса 1
Равен числу р+
Мне важно как понять, как вы освоили состав и строение атома.
Сейчас по многим предметам сдают ЕЭГ, по этому мы проведем итоговый контроль в виде теста.
VIII этап итоговый контроль
Цель: умение определять элементарные частицы атома, характеризовать элементарные частицы
5. Тест
1. В состав ядра входят элементарные частицы:
А) электроны и протоны
Б) протоны, нейтроны и электроны
В) протоны и нейтроны
Г) протоны
2. Число электронов в атоме натрия равно:
А) 23 Б) 12 В) 11 Г) 34
3. Число нейтронов а атоме 39К равно:
А) 39 Б) 58 В) 26 Г) 20
4. У какого элемента содержится 14 электронов:
А) бор Б) кремний В) фтор Г) азот
5. О какой частице идет речь: определяется по порядковому номеру, имеет заряд -1 и массу 1/1837
А) протон
Б) нейтрон
В) электрон
В) ядро
IX Организация домашнего задания
Стандарт § 6, стр. 24 упр.3
Стандарт + хорошо упр. 4
Стандарт + отлично сообщение о научных открытиях (Джозефа Томсона, Жана Перрена, Анри Беккереля и Эрнеста Резерфорда)
Наглядный материал у каждого на парте
Тема: Состав и строение атома
Цель: 1. Изучить состав атома (протон, электрон, нейтрон).
2. Научиться определять протоны, электроны, нейтроны.
3. Характеризовать протоны, нейтроны, электроны.
2 этап
Задание № 1
Рассмотрите планетарную модель строения атома:
1. Допишите предложения.
2. Ответьте на вопрос: Почему модель атома называется планетарной?
В центре атома находится положительно заряженное ………….., которое состоит из элементарных частиц …………………… и ………………………..
Заряд ядра равен числу ………………..в нем.
Вокруг ядра с большой скоростью движутся отрицательно заряженные …………….. по …………………………………………………….
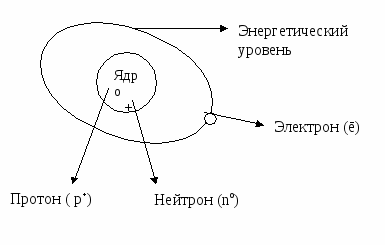
Модель атома называется планетарной, потому что…………………………… ……..
……………………………………………………………………………………………..
Задание № 2.
Заполните таблицу «Характеристика элементарных частиц»
-
Протоны р+ - это положительная элементарная частица с массой, равной единице и зарядом +1. Число протонов определяется по порядковому номеру (Z) элемента. р+ = Z .Пример: р+ (Р) = 15, т.к. порядковый номер фосфора 15.
-
Нейтроны nо – это элементарные частицы с массой, равной единице, незаряженные. Число нейтронов определяется вычитанием протонов из относительной атомной массы. nо = Ar– р+. Пример: nо (К) =39 – 19=20, где 39 –это атомная масса калия, а 19 – это его порядковый номер.
-
Электроны - это отрицательные элементарные частицы, с ничтожно малой массой 1/1837 и зарядом -1. Число электронов определяется по порядковому номеру (Z) элемента. ē = Z. Пример: ē (О) = 8, т.к. порядковый номер кислорода 8.
Массовое число А = р+ + nо
Атом – электронейтрален, т.к. число р+ = числу ē.
Задание № 3
Соотнесите и соедините:
Термины Описание:
Протон Заряд равен -1
Электрон Заряд равен +1
Нейтрон Сумма р+ и nо
Массовое число Электронейтральная частица
Заряд ядра Масса 1/1837
Масса 1
Равен числу р+
Рабочий лист учащегося ……………………………………………………………….
1 этап
Даны следующие химические элементы:
P (фосфор) ………………………………………………………….
O2 (кислород) ……………………………………………………….
K2O (оксид калия) …………………………………………………..
K (калий) ………………………………………………………….. ..
N2 (азот) ……………………………………………………………. .
NaCl (хлорид натрия) ……………………………………………….
S (сера) ………………………………………………………………..
Задание.
-
Определите форму химического элемента.
-
Определите порядковый номер химических элементов, которые находятся в форме свободных атомов.
-
Определите относительную атомную массу химических элементов, которые находятся в форме свободных атомов.
2 этап
Задание № 2.
Заполните таблицу: характеристика элементарных частиц
| Масса | Заряд | Определяется | |
| | | | |
| | | | |
| | | | |
Задание № 3
Выполните задание, используя периодическую систему химических элементов Д.И.Менделеева
| Знаки химических элементов | |||||
| Na | P | Al | F | Ca | |
| Порядковый номер в таблице Д.И.Менделеева | | | | | |
| Число протонов р+ | | | | | |
| Число электронов ē | | | | | |
| Число нейтронов nо | | | | | |
| Массовое число А | | | | | |
| Заряд ядра атома, Z | | | | | |
5. Тест
1. В состав ядра входят элементарные частицы:
А) электроны и протоны
Б) протоны, нейтроны и электроны
В) протоны и нейтроны
Г) протоны
2. Число электронов в атоме натрия равно:
А) 23 Б) 12 В) 11 Г) 34
3. Число нейтронов а атоме 39К равно:
А) 39 Б) 58 В) 26 Г) 20
4. У какого элемента содержится 14 электронов:
А) бор Б) кремний В) фтор Г) азот
5. О какой частице идет речь: определяется по порядковому номеру, имеет заряд -1 и массу 1/1837
А) протон
Б) нейтрон
В) электрон
В) ядро
Протон
Электрон
Нейтрон
Массовое число
Заряд ядра
Заряд равен -1
Заряд равен +1
Сумма р+ и nо
Электронейтральная частица
Масса 1/1837
Масса равна 1
Равен числу р+
nо
р+
ē
Z
А
Здесь представлен конспект к уроку на тему «Состав и строение атома», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

