Конспект урока «Строение атома» по химии
Тема урока: “Строение атома”
Тип урока: урок ознакомления с новым материалом.
Цель: дать понятие о составе атома и составе атомного ядра; раскрыть взаимосвязь понятий: протон, нейтрон, массовое число, электрон.
Задачи:
-
Обучающие: формирование целостности представления об атоме.
-
Развивающие: способствовать развитию знаний об атоме, пробудить у учащихся интерес к изучению предпосылок открытия конкретных явлений; продолжить развитие мышления, умение анализировать, сравнивать, делать логические выводы.
-
Воспитательные: развитие навыков коллективной работы; развитие навыков культуры общения, толерантного отношения друг к другу; умение излагать свою точку зрения и отстаивать свою правоту.
Планируемые результаты обучения:
-
Новые знания: понятия – ядро, протон, нейтрон, электрон.
-
Обобщение представлений об атоме.
-
Умение определять количество р+ , no, е– .
-
Развитие навыков: работы с инструментами, самостоятельное принятие решений, коммуникативные умения и навыки, умение самостоятельной мыслительной деятельности.
-
Развитие навыка самоконтроля.
-
Воспитание толерантности.
-
Расширение кругозора.
Ход урока
Здравствуйте, ребята!
Сегодня мы начинаем изучать новую тему “Атомы химических элементов”. На изучение этой темы отводится 7 часов. Сегодня мы познакомимся со строением атома, а на следующих уроках вы будете знакомиться со строением электронных орбиталей, ионами, видами химической связи. Напишите 2 тематических учета знаний и 1 контрольную работу.
А сейчас мы отправимся в дальнейшее путешествие по удивительной стране “Химия”. План нашего урока перед вами. Пожалуйста, с ним познакомьтесь. Обратите внимание, у нас с вами с/р, где вы покажите на сколько хорошо усвоили материал. Посмотрите на меня внимательно. Главное, что вы должны запомнить на сегодняшнем уроке: как устроен атом, состав атомного ядра. Научиться определять заряд ядра, количество протонов, нейтронов, электронов.
Откройте тетради, запишите число, тему урока: “Строение атома”. И так, мы начинаем.
ВИДЕО
(После просмотра) Давайте хором назовем химические элементы.
СЛАЙД № 1
Вы знаете, что вещества состоят из молекул, а молекулы из атомов. Ребята, атом тоже имеет сложное строение. Об этом говорят многочисленные опыты, с которыми вы будете знакомиться на уроках физики и при дальнейшем изучении химии. Атом имеет ядро и электроны, которые движутся вокруг ядра. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро – футбольному мячу, положенному в центр поля. Атом любого химического элемента – как бы крохотная Солнечная система. Поэтому такую модель атома, предложенную Резерфордом, назвали планетарной. Но оказывается, что крохотное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов – протонов и нейтронов.
СХЕМА № 1 Возьми на своих столах схему № 1.
Рассмотрите ее внимательно: атом состоит из ядра и электронной оболочки, которая состоит из электронов. В центре атома находится ядро. Ядро состоит из протонов и нейтронов, которые называются нуклонами.
СЛАЙД № 2 Задание – заполнить пропуски в тексте, используя данные слова.
“В центре атома находится ядро, которое состоит из протонов и нейтронов. Вокруг ядра с большой скоростью движутся электроны”.
Повернитесь друг к другу в полоборота, сядьте ровно. Сейчас вы работаете в парах и друг другу проговорите еще раз шепотом строение атома, используя данную схему(рис.1).
Познакомимся с основными характеристиками элементарных частиц. Заполним вместе таблицу.
| Масса | Заряд | |
| Протон р+ | 1 | +1 |
| Нейтрон n0 | 1 | 0 |
| Электрон е– | 0 | -1 |
СЛАЙД № 3
-
Посмотрим в схему 1. Какие частицы находятся в ядре?
-
Какие из них имеют заряд?
-
А ядро будет иметь заряд?
-
За счет каких частиц?
-
Атом имеет массу?
-
За счет каких частиц?
-
Электроны вносят вклад в массу атома?
-
Значит в какой части атома сосредоточена его масса?
Мы знакомы с ПСХЭ. Сегодня мы научимся характеризовать элемент с т.з. строения атома.
СЛАЙД № 4 Химический элемент представляет собой совокупность атомов, имеющих одинаковый атомный номер.
Запишем в тетрадь: Число протонов в ядре атома соответствует его атомному номеру и обозначается символом Z.
Работа по закреплению у ПСХЭ.
Гимнастика для глаз
Познакомимся с атомным номером. Возьмите в руки ПСХЭ Д.И.Менделеева. Вам необходимо определить атомный номер элемента и число протонов для следующих элементов: Al S // Переверните ПС на 180о O H
Мы узнали, что число протонов определяется по порядковому номеру элемента.
СЛАЙД № 5 Сейчас наша задача научиться определять число нейтронов. Т.к. вся масса атома сосредоточена в ядре, то число нейтронов можно определить по следующей формуле:
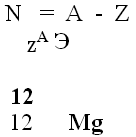
Запишите в тетрадь атомный номер и массовое число следующих элементов:
Фосфора и кислорода.
Обратная сторона доски: Проверьте.
СЛАЙД № 6 Кол-во нейтронов вычисляется по формуле: N=A-Z.
Например: ядро атома магния содержит 12 нейтронов. 24 – 12 = 12.
Гимнастика для глаз: Возьмите в руки ПСХЭ Д.И.Менделеева на расстоянии вытянутой руки. Молча определите кол-во протонов и нейтронов для атомов: С, Si.
Обратная сторона доски: Проверьте. Правильно? Запишите это в тетрадь.
Учимся определять число электронов. Число электронов определяется по порядковому номеру. Допишите в тетради число электронов у С и Si.
Ребята, кто был из вас внимателен в начале урока? Скажите мне, с какими новыми понятиями вы сегодня познакомились? ………….
У нас с вами творческая работа. Работать вы будете в группах по 4 человека. Вам предстоит создать модель атома гелия. Посмотрите внимательно, как может выглядеть атом. Для работы используйте наборы, которые лежат на столах. На выполнение работы вам дается 4 минуты. И так, время пошло. Кто первый завершит конструирование своей модели атома гелия, тот вывешивает свою работу на доску.
Давайте посмотрим ваши работы. Выбрать правильную. Расскажите как вы выполняли. Молодцы.
Сейчас посмотрите в свои тетрадочки с самого начала урока. Вспомните то, что мы сегодня записали. Подошло время Испытать себя. Записали в тетрадях “Самостоятельная работа”. (Инструкция)
СЛАЙД № 7 Время на выполнение работы – 3 минуты. Самопроверка по образцу.
Встаньте те, кто не допустил ни одной ошибки. Продолжайте стоять. Встаньте те, кто допустил 1 ошибку. Похлопаем. Молодцы. Садитесь.
Самой распространенной ошибкой в этой работе было нахождение числа нейтронов. Еще раз, скажите мне, как мы находим кол-во нейтронов?
Домашнее задание.
Ребята, что же мы с вами узнали на сегодняшнем уроке?
-
…..
-
…..
Чему научились? Обратитесь к схеме 1 (строение атома). Сделать вывод.
Оценка работы учащихся на уроке.
Здесь представлен конспект к уроку на тему «Строение атома», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

