Презентация "Соединения серы" по химии – проект, доклад
Презентацию на тему "Соединения серы" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 25 слайд(ов).
Слайды презентации
Список похожих презентаций
Соединения серы
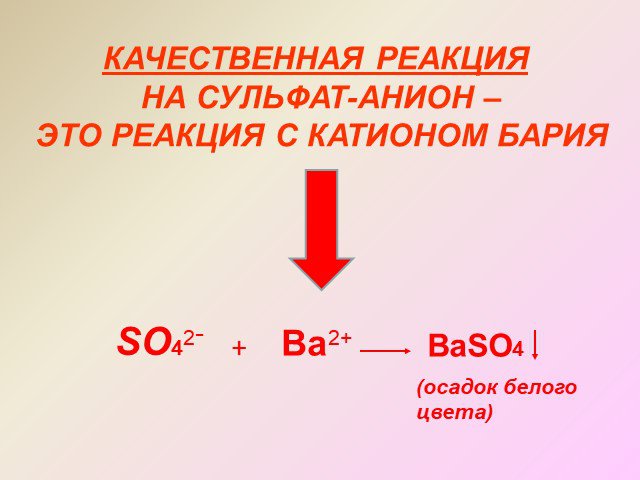
Сероводоро́д, сернистый водород Н2S. Общие Систематическое наименование сероводород / hydrogen sulphide Химическая формула H2S Отн. молек. Масса 34.082 ...Соединения серы
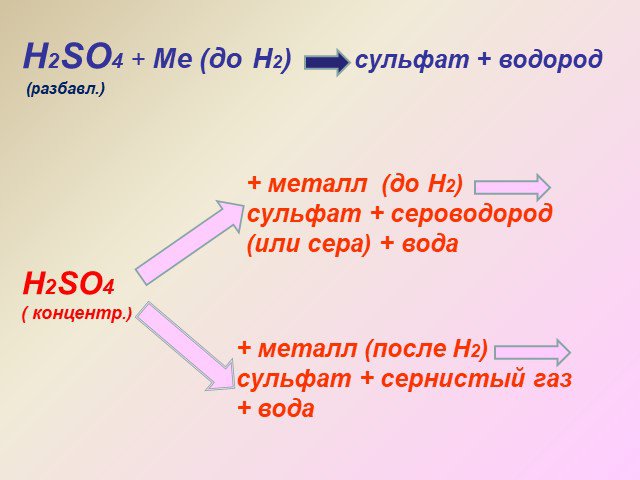
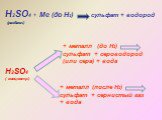
Оксид серы (VI). Физические свойства серной кислоты. Безводная серная кислота - это бесцветная маслянистая жидкость без запаха, смешивается с водой ...Основные соединения серы
Почему геохимик А.Е.Ферсман назвал серу «двигателем химической промышленности»? Цели урока:. Рассмотреть свойства важнейших соединений серы – сероводорода ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Соединения железа
Железо расположено в 4 периоде, в побочной подгруппе VIII группы Периодической системы химических элементов Д.И.Менделеева. Относительная атомная ...Аллотропия. Аллотропные формы серы
Аллотро́пия (от др.-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же химического элемента в виде двух и более ...Фосфор. Соединения фосфора
5. Причина свечения белого фосфора…. а)изменение агрегатного состояния вещества б) химическое явление в) физическое явление б) химическое явление ...Токсикологическая характеристика оксидов серы
Физические свойства. SO2 (серистый ангидрид; сернистый газ). SO3 (серный ангидрид). Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) ...Соединения щелочноземельных металлов
Соединения щелочноземельных металлов. Тип и класс веществ. Физические свойства. Химические свойства. Оксиды щелочноземельных металлов. . 15.03.2019. ...Соединения химических элементов
1 Станция «Теоретическая». Из предложенного списка веществ выписать отдельно: оксиды, кислоты, соли, основания: Н2SО4, Аl (NО3)3, МgСl2, Са(ОН)2, ...Соединения
Повсюду, куда бы мы ни обратили свой взор, нас окружают предметы и изделия, изготовленные из веществ и материалов, которые получены на химических ...Свойства серы
Сера известна человечеству с древних времен, т. к. она в природе встречается в самородном виде. Считалось, что голубое пламя и запах, распространяемый ...Оксид серы (IV). Сернистая кислота
Цель урока:. Повторить и закрепить знания учащихся о свойствах кислотных оксидов и кислот. Рассмотреть свойства соединения серы – сернистого газа ...Круговорот серы и фосфора
Круговорот серы в природе. Сера играет важную роль в круговороте веществ в биосфере. Соединения серы участвуют в формировании химического состава ...Соединения кальция.
Оксид кальция. Гидроксид кальция. Гидроксид кальция – известковая вода, известковое молоко. Гипс. Мел. . Известняк. Одесские катакомбы. Здания из ...Соединения Ca и Mg, представителей элементов II группы главной подгруппы
План урока. Проверка домашнего задания. 2. Знакомство с соединениями металлов главной подгруппы второй группы. 3. Л/р «Изучение коллекции соединений ...Соединения азота
Азот образует с водородом несколько прочных соединений, из которых важнейшим является аммиак. Электронная формула молекулы аммиака такова:. Получение ...Соединения химических элементов
Конфуций сказал:. «Учиться, а время от времени повторять изученное, разве неприятно?». Задание 1.Выписать оксиды и распределить их в два столбика: ...Соединения алюминия
обобщить знания об алюминии и его соединениях, опытным путем изучить амфотерность оксида и гидроксида алюминия, уметь составлять уравнения реакций ...Конспекты
Кислородные соединения серы
Тема урока: Кислородные соединения серы. Цель урока. : 1. Контроль и оценка усвоения учащимися изученного материала. 2. Способствовать развитию ...Сера и ее соединения. Аллотропия серы. Сероводород. Оксиды серы
Тема: Сера и ее соединения. Аллотропия серы. Сероводород. Оксиды серы (. IV, VI. ). . Цели урока:. рассмотреть вещество «сера», аллотропию серы, ...Соединения железа
. . Тема: «Соединения железа». Урок-исследование. Цель:. изучить состав , получение и свойства гидроксидов железа, научиться распознавать ...Соединения железа
Конспект урока по химии для 9 класса на тему: «Соединения железа». Урок строится на элементах личностно ориентированного обучения и проводится по ...Железо. Соединения железа
Урок химии в 9 классе. Учебник: Г.Е.Рудзитис, Ф.Г.Фельдман, М., Просвещение, 2012 г. Разработка учителя химии МБОУ СОШ №41 г.Шахты И.А.Калашниковой. ...Соединения щелочноземельных металлов
Урок. Соединения щелочноземельных металлов. . Урок на основе технологии критического мышления. Цель:. Рассмотреть важнейшие соединения элементов ...Соединения химических элементов
Предмет: Химия. Класс: 8. Учитель: Григорьева Ольга Анатольевна учитель первой категории. Урок № 13 в разделе « Соединения химических элементов». ...Соединения химических элементов
Автор: Деревенчук Лариса Викторовна. 8 класс. Тема урока: Соединения химических элементов. Тип урока:. урок обобщения и систематизации знаний. ...Соединения железа
МКОУ Богучарская общеобразовательная школа № 2. Учитель химии Хаустова Ольга Анатольевна. . Класс:. 9. Тема урока:. . Соединения железа. Тип ...Положение кислорода и серы в периодической системе химических элементов, строение их атомов. Озон-аллотропная модификация кислорода
Технологическая карта урока. . . Учитель Дьячук Е.Ю. учитель химии МБОУ СОШ №1 г.Оха Сахалинская область. Предмет. химия. . Класс. . ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Учитель химии, Гершановская Евгения Владимировна
Содержит:25 слайд(ов)
Поделись с друзьями:
Скачать презентацию