Презентация "Фосфор. Соединения фосфора" по химии – проект, доклад
Презентацию на тему "Фосфор. Соединения фосфора" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 19 слайд(ов).
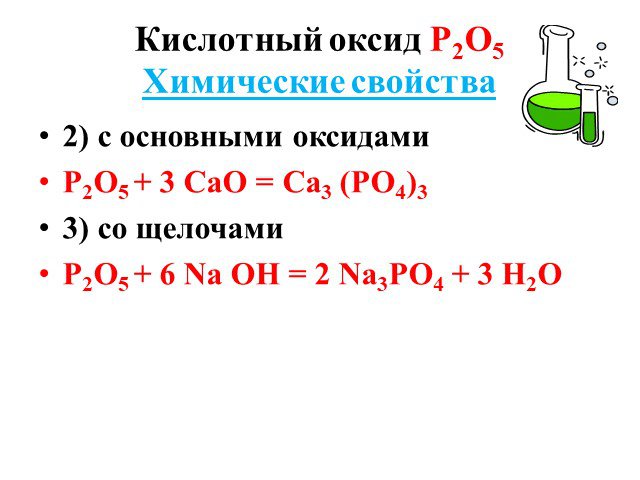
Слайды презентации
Список похожих презентаций
Урок Соединения фосфора
Изучение темы рассчитано на 2 урока:. Фосфор и его соединения. Кислородные соединения фосфора. Цели:. Сформировать знания о фосфоре как о химическом ...Получение фосфора (Р)
Фосфор (Р). Фосфор-это химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической ...Круговорот серы и фосфора
Круговорот серы в природе. Сера играет важную роль в круговороте веществ в биосфере. Соединения серы участвуют в формировании химического состава ...Значение фосфора
Фосфор – относительно редкий элемент. По данным академика А.Е.Ферсмана, его процентное содержание элемента в земле равен всего 0,12%. В таблице распространенности ...Фосфор и его соединения
«Чудовище лежало перед нами… Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза обведены огненными кругами. Я ...Фосфор и его соединения
Строение атома. Символ элемента: P. Атомный номер: 15. Положение в таблице: 3-й период, группа - VA (2) Относительная атомная масса: 30.973761 Степени ...Фосфор и его соединения и их свойства
Аллотропные модификации фосфора. Чёрный фосфор Красный фосфор Белый фосфор. Химические свойства фосфора. Горение фосфора. Оксиды фосфора. Взаимодействие ...Биологическая роль фосфора
Апатит (содержит фосфат кальция). Производственное объединение «Фосфор» г.Чимкент. Биологическая роль фосфора. 1.построение скелета Ca3(PO4)2 2.входит ...Физические свойства фосфора
Аллотропические модификации фосфора. выделяют четыре аллотропических модификации простого вещества — белую, красную, черную и металлический фосфор. ...Фосфор и его соединения
Цель: исследовать влияние фосфора на рост и развитие растений. Задачи исследования: 1. Изучить влияние фосфора на рост и развитие растений; 2. Рассмотреть ...Соединения азота
Азот образует с водородом несколько прочных соединений, из которых важнейшим является аммиак. Электронная формула молекулы аммиака такова:. Получение ...Соединения галогенов
Экспресс опрос класса:. 1. Какие элементы называются галогенами? 2. Охарактеризуйте положение галогенов в Периодической системе Д.И.Менделеева. 3. ...Фосфор
содержание. Введение……………………………………………………………………………. История развития фосфора………………………………………………………... Природные соединения и получение фосфора…………………………………... ...Фосфор
Цели урока:. обеспечить усвоение учащимися знаний о фосфоре как о химическом элементе и простом веществе; аллотропных видоизменениях фосфора; повторить ...Фосфор
План урока. 1)СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА АТОМОВ ФОСФОРА И АЗОТА; 2)ФОСФОР, КАК ПРОСТОЕ ВЕЩЕСТВО ;АЛЛОТРОПНЫЕ МОДИФИКАЦИИ ФОСФОРА; 3)ИСТОРИЯ ОТКРЫТИЯ ...Фосфор
Положение в ПСХЭ. Строение атома Р +15 ) ) ) 2 8 5 Возможные степени окисления: -3,0,+3,+5 Р0 +3ē → Р-3 – окислитель, восс-тся Р0 - 5ē → Р+5 - восс-ль, ...Соединения серы
Сероводоро́д, сернистый водород Н2S. Общие Систематическое наименование сероводород / hydrogen sulphide Химическая формула H2S Отн. молек. Масса 34.082 ...Соединения серы
С О Е Д И Н Е Н И Я С Е Р Ы. степень окисления серы -2. Сероводород - Н2S. Сульфиды неметаллов – CS2, P2S3. Сульфиды металлов – Al2S3, K2S. Н2S СЕРОВОДОРОД. ...Соединения серы
Оксид серы (VI). Физические свойства серной кислоты. Безводная серная кислота - это бесцветная маслянистая жидкость без запаха, смешивается с водой ...Соединения кальция.
Оксид кальция. Гидроксид кальция. Гидроксид кальция – известковая вода, известковое молоко. Гипс. Мел. . Известняк. Одесские катакомбы. Здания из ...Конспекты
Важнейшие соединения азота и фосфора, специфические свойства
Тема:. Важнейшие соединения азота и фосфора, специфические свойства. Цель:. Проследить связь важнейших соединений азота, роль аммиака, азотной ...Фосфор и его соединения
Тема урока: «Фосфор и его соединения». . Цель урока:. . • продолжить формирование понятий «элемент» и «вещество», а также показать многообразие ...Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, физические и химические свойства, получение и применение
Дата_____________ Класс_______________. Тема:. . Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, ...Оксид фосфора (V). Фосфорная кислота и ее соли
Плесовских Ольга Анатольевна. учитель химии. МОУ «Средняя общеобразовательная школа №2 г. Надыма». Конспект урока. Тема: Оксид фосфора ...Фосфор и его соединения
ТЕМА. . УРОКА:. «Фосфор и его соединения» (9 класс). . Цель. : выяснение общей характеристики фосфора на основании. положения в периодической ...Фосфор и его соединения
Предлагаю разработку урока с использованием проектной деятельности. Тема урока «Фосфор и его соединения». Цель урока:. на основе базовых знаний ...Фосфор и его соединения
Урок по химии в 9 классе на тему: «Фосфор и его соединения». Цель урока:. Познакомить учащихся с историей открытия фосфора, его аллотропными ...Общая характеристика неметаллов. Элементы V А группы. Важнейщие соединения азота. Фосфор и его соединения
План учебного занятия № 14. Дата Предмет. химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . І. Тема занятия:. Общая характеристика неметаллов. ...Фосфор и его соединения
Тема:. . Фосфор и его соединения. . Класс. : 9. Цель:. . Знать характеристику фосфора как химического элемента и как простого вещества, знать ...Фосфор
Тема: «Фосфор». Цель. : Создать условия для формирования знаний о фосфоре. Задачи:. Образовательные: сформировать знания о простом веществе ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Калитина Тамара Михайловна, учитель химии, биологии, экологии
Содержит:19 слайд(ов)
Поделись с друзьями:
Скачать презентацию