Презентация "Соединения галогенов" по химии – проект, доклад
Презентацию на тему "Соединения галогенов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 14 слайд(ов).
Слайды презентации
Список похожих презентаций
Соединения галогенов
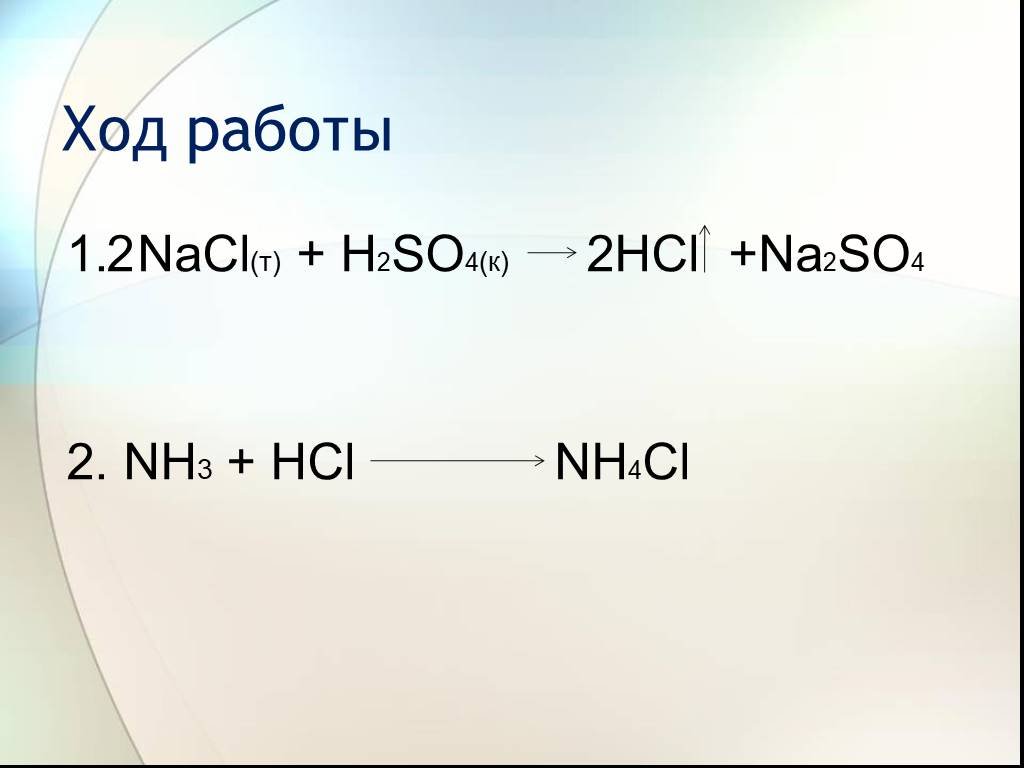
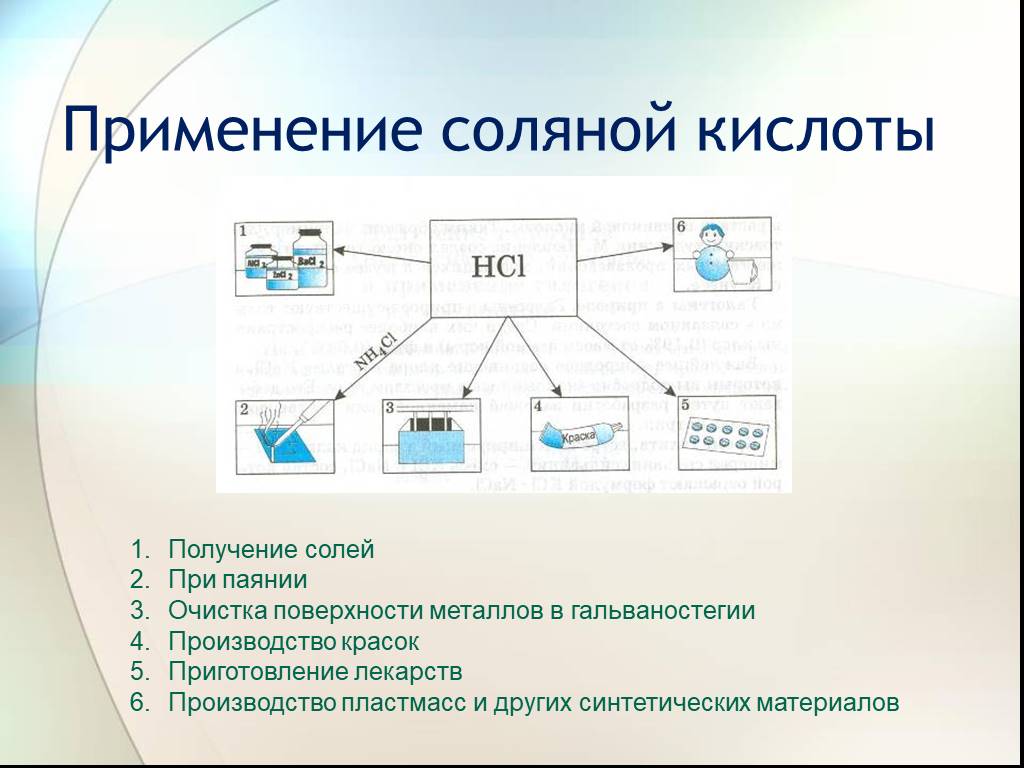
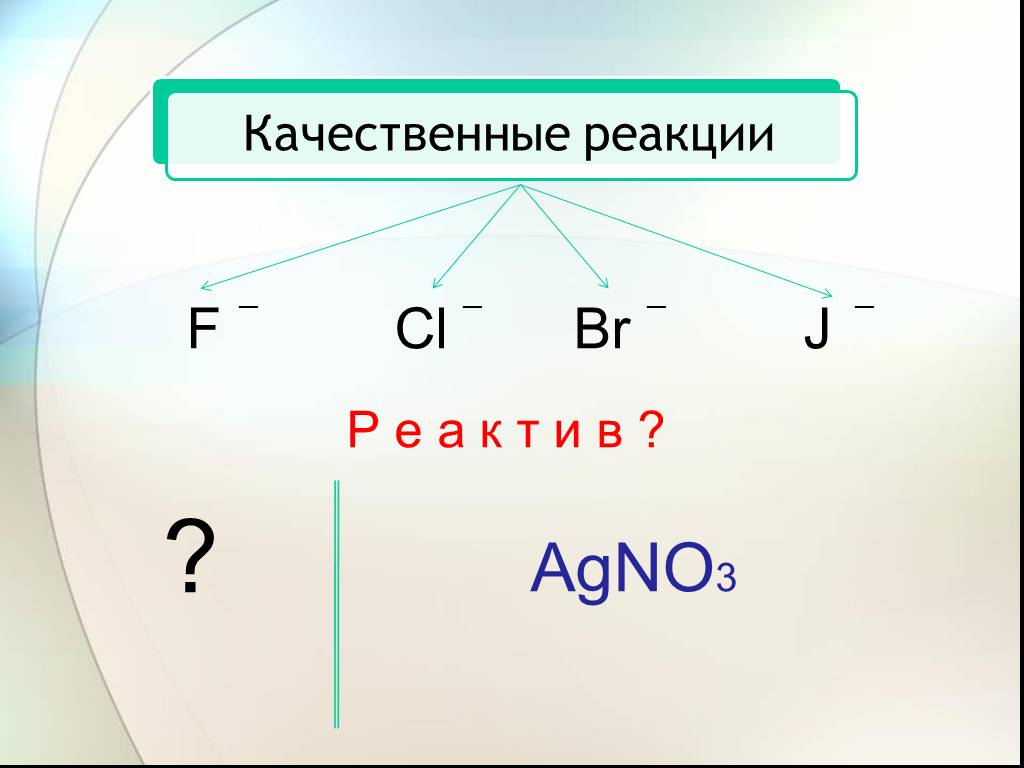
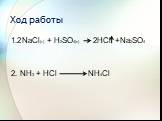
План урока. 1. Галогеноводородные кислоты. 2. Соляная кислота и её свойства. 3. Соли галогеноводородных кислот. Галогениды. Качественные реакции на ...Соединения галогенов.
Подготовка к тестированию. Перечислите особенности строения элементов неметаллов. 2.Укажите период, в котором больше всего элементов неметаллов? 3. ...Соединения химических элементов
1 Станция «Теоретическая». Из предложенного списка веществ выписать отдельно: оксиды, кислоты, соли, основания: Н2SО4, Аl (NО3)3, МgСl2, Са(ОН)2, ...Соединения серы
Сероводоро́д, сернистый водород Н2S. Общие Систематическое наименование сероводород / hydrogen sulphide Химическая формула H2S Отн. молек. Масса 34.082 ...Соединения химических элементов
Конфуций сказал:. «Учиться, а время от времени повторять изученное, разве неприятно?». Задание 1.Выписать оксиды и распределить их в два столбика: ...Соединения серы
Оксид серы (VI). Физические свойства серной кислоты. Безводная серная кислота - это бесцветная маслянистая жидкость без запаха, смешивается с водой ...Соединения серы
С О Е Д И Н Е Н И Я С Е Р Ы. степень окисления серы -2. Сероводород - Н2S. Сульфиды неметаллов – CS2, P2S3. Сульфиды металлов – Al2S3, K2S. Н2S СЕРОВОДОРОД. ...Фосфор. Соединения фосфора
5. Причина свечения белого фосфора…. а)изменение агрегатного состояния вещества б) химическое явление в) физическое явление б) химическое явление ...Биологическое значение и применение галогенов
Получение галогенов. В промышленности фтор и хлор электролизом расплавов и растворов. 2NaCl расплав →2Na +Cl2↑ 2 NaCl + 2H2O → H2 + Cl2 +2NaOH В лаборатории: ...Соединения химических элементов. Степень окисления
Бинарные соединения – сложные вещества, состоящие из двух химических элементов. NaCl Хлорид натрия Na0+Cl0=Na+Cl‾ Связь ионная +11Na )2)8)1 Атом натрия ...Соединения щелочноземельных металлов
Цели:. Обобщить и систематизировать знания о щелочноземельных металлах Уметь характеризовать элементы по положению в периодической таблице Знать физические ...Соединения азота
Азот образует с водородом несколько прочных соединений, из которых важнейшим является аммиак. Электронная формула молекулы аммиака такова:. Получение ...Соединения алюминия
обобщить знания об алюминии и его соединениях, опытным путем изучить амфотерность оксида и гидроксида алюминия, уметь составлять уравнения реакций ...Соединения Ca и Mg, представителей элементов II группы главной подгруппы
План урока. Проверка домашнего задания. 2. Знакомство с соединениями металлов главной подгруппы второй группы. 3. Л/р «Изучение коллекции соединений ...Соединения
Повсюду, куда бы мы ни обратили свой взор, нас окружают предметы и изделия, изготовленные из веществ и материалов, которые получены на химических ...Получение галогенов. Биологическое значение и применение галогенов
Давайте вспомним . . . Положение галогенов в таблице Менделеева Что вы можете сказать о физических свойствах галогенов А) Агрегатное состояние Б) ...Общая характеристика галогенов
Цели урока:. 1.Систематизировать знания учащихся о галогенах. 2.Ознакомить учащихся с окислительными свойствами галогенов. 3.Повторить, обобщить и ...Общая характеристика галогенов
Цель урока:. Повторить свойства металлов и неметаллов Изучить строениеатомов, свойства галогенов на основании их сравнительной характеристики. Ответы ...Соединения щелочноземельных металлов
Соединения щелочноземельных металлов. Тип и класс веществ. Физические свойства. Химические свойства. Оксиды щелочноземельных металлов. . 15.03.2019. ...Соединения железа
Железо расположено в 4 периоде, в побочной подгруппе VIII группы Периодической системы химических элементов Д.И.Менделеева. Относительная атомная ...Конспекты
Галогены. Соединения галогенов
Конспект урока. Аттестуемый педагог Краснова Оксана Владимировна. Предмет Химия. Класс 9. . Тема урока. «Галогены. Соединения галогенов ». ...Соединения химических элементов
Урок повторения и обобщения материала в 8 классе по теме. «Соединения химических элементов». Цель:. продолжить формирование умений решать расчетные ...Соединения химических элементов
Автор: Деревенчук Лариса Викторовна. 8 класс. Тема урока: Соединения химических элементов. Тип урока:. урок обобщения и систематизации знаний. ...Соединения химических элементов
Обобщающий урок по теме. :. « Соединения химических элементов». Цель урока:. . . Обобщить и систематизировать знания учащихся о классификации ...Соединения железа
МКОУ Богучарская общеобразовательная школа № 2. Учитель химии Хаустова Ольга Анатольевна. . Класс:. 9. Тема урока:. . Соединения железа. Тип ...Соединения железа
Класс:. 9. Тема урока:. «. Соединения железа». Цель урока:. организовать деятельность учащихся по усвоению и первичному закреплению знаний ...Железо. Соединения железа
Урок химии в 9 классе. Учебник: Г.Е.Рудзитис, Ф.Г.Фельдман, М., Просвещение, 2012 г. Разработка учителя химии МБОУ СОШ №41 г.Шахты И.А.Калашниковой. ...Соединения щелочноземельных металлов
Урок. Соединения щелочноземельных металлов. . Урок на основе технологии критического мышления. Цель:. Рассмотреть важнейшие соединения элементов ...Соединения железа
Конспект урока по химии для 9 класса на тему: «Соединения железа». Урок строится на элементах личностно ориентированного обучения и проводится по ...Соединения алюминия
Куликова Юлия Валерьевна. учитель химии и биологии. НОУ «Школа-интернат № 29 ОАО «РЖД» г. Уссурийск. Урок на тему: «Соединения алюминия». ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:11 января 2019
Категория:Химия
Содержит:14 слайд(ов)
Поделись с друзьями:
Скачать презентацию