Конспект урока «Соединения железа» по химии для 9 класса
Класс: 9
Тема урока: «Соединения железа»
Цель урока: организовать деятельность учащихся по усвоению и первичному закреплению знаний о получении и свойствах соединений железа на примере гидроксидов и солей, научиться распознавать ионы железа с зарядом 3+; определить содержание железа в некоторых продуктах питания.
Задачи урока:
Образовательные: продолжить формирование понятия амфотерности на примере гидроксида железа(III), научить определять с помощью качественных реакций вещества, содержащие железо +3. Совершенствовать навыки работы с реактивами при выполнении опытов, соблюдать правила по ТБ. Раскрыть значение железа и его соединений в природе и жизни человека.
Развивающие: продолжить развитие мыслительных способностей: умения пользоваться опорными знаниями, умения сравнивать, обобщать, делать выводы, объяснять ход эксперимента; навыков самостоятельности при работе с учебником, инструктивной картой и реактивами; исследовательских навыков при исследовании свойств соединений железа(II) и железа (III) и проведении качественных реакций;
Воспитательные: продолжить формирование навыка самоконтроля. взаимопомощи, умения рационально организовать свой труд, стимулировать развитие познавательного интереса к предмету.
Тип урока: урок изучения и первичного закрепления новых знаний и способов деятельности.
Форма урока: урок-исследование.
Форма организации учебной деятельности: работа в группах, в парах, индивидуальная работа.
Методы: проблемный, исследовательский, частично-поисковый.
Оборудование: мультимедийный проектор, интерактивная доска, ПК, раздаточный материал
Реактивы: растворы сульфата железа (II) (FeSO4), хлорида железа(III) (FeCl3), гидроксида натрия (NaOH), соляной кислоты (HCl), роданида аммония (NH4CNS), красная кровяная соль K3[Fe(CN)6], желтая кровяная соль K4[Fe(CN)6], пробирки.
Ход урока
В начале урока класс делится на группы по интересам
-
Организационный момент (1 мин)
Взаимное приветствие учащихся, учителей, гостей.
УЧИТЕЛЬ: Здравствуйте дорогие ребята! Сегодня урок необычен присутствием моих коллег. Во всем остальном это обычный рабочий урок с деловой обстановкой.
Древняя мудрость гласит: дорогу осилит идущий. Отправляясь в путь познания, посмотрите друг на друга, улыбнитесь. Пусть хорошее настроение будет сегодня нашим спутником. Надеюсь, что вместе мы сможем сегодня решить трудные и интересные задачи. Ощутим вкус творчества: будем размышлять, исследовать, учиться формулировать свою точку зрения и аргументировано ее доказывать. В добрый путь, друзья!
-
Постановка проблемы исследования (3 мин)
Вот уже почти полтора года вы изучаете химию. А что изучает химия? – Вещества.
А как вы думаете вещество достойно того, чтобы ему был воздвигнут памятник? А много ли памятников воздвиг человек во славу того или иного вещества? Как выясняется не очень. Представляю небольшую экскурсию. Итак,
-
Сахар-рафинад в форме кубиков был изобретен в 1843 году в Чехии. Изобретатель -швейцарец Яков Кристоф Рад был управляющим сахарного завода в Дачице. На месте, где находился сахарный завод, сейчас также установлен памятник -куб, символизирующий сахар-рафинад
-
В городе Соликамске (Пермский край) открыт памятник соли. Старинный город на реке Каме - без малого шесть веков центр промышленного российского солеварения. Бронзовое изваяние воплощает символ русского гостеприимства: каравай хлеба на рушнике и с солонкой сверху.
-
"Капля нефти".г. Когалым
-
В 1749 г. на этом месте сибирский казак - кузнец Медведев нашёл и вывез из тайги загадочный камень - глыбу весом 42 пуда. А академик П. С. Паллас в 1775 г. передал находку в кунсткамеру. В августе 1981 г. группа учёных Москвы, Новосибирска и других городов участвовала в открытии памятника этой находке.
-
А как вы думаете памятник какому веществу перед вами?
Один из символов Брюсселя - атомиум. Спроектировал его архитектор Ватеркеин. Металлическая конструкция представляет собой молекулу железа, увеличенную в 165 миллионов раз. Весит «молекула» 2400 тонн! Внутри девяти шаров, диаметр каждого из которых 18 м, посетители могут осмотреть экспозицию выставки. Атомиум был спроектирован к началу всемирной выставки 1958 года. А что символизирует этот памятник? Атомиум символ величия железа- металла – труженика, главного металла промышленности.
Без железа не может обойтись даже приключенческая литература.
Герою знаменитого романа Даниеля Дефо Робинзону повезло в жизни трижды. Первый раз – когда он спасся после кораблекрушения. Второй раз – когда он благополучно добрался до острова. Но, ему повезло еще раз. После долгих поисков он нашел ящик, за который, по его словам, не отдал бы и целый корабль с золотом.
Что было в этом ящике?
Обыкновенные железные инструменты: топор, пила, молоток, гвозди.
Через два столетия на другой необитаемый остров попадают герои другого известного романа – пятеро американцев. Они сумели не только выжить, но и создать более или менее нормальные условия жизни, благодаря тому, что на этом острове была найдена железная руда, из которой были сделаны железные инструменты. Иначе героям Жюля Верна пришлось бы нелегко.
Как мы видим, чрезвычайно важное место этот металл и его соединения занимает в жизни человека. И наш сегодняшний урок будет посвящен соединениям, которые образует элемент «железо».
Тема урока: «Соединения железа».
Запись темы и постановка цели урока
Наши задачи
-
Познакомиться с соединениями железа и качественными реакциями на ионы железа Fе2+ и Fе3+
-
Освоить навык определения ионов железа Fе2+ и Fе3+
-
Развить способность эффективно использовать знаковые системы, наблюдения, сравнения, делать выводы
-
Актуализация ЗУН (5 мин)
Для того, чтобы успешно достичь цели урока, нам необходимо повторить те сведения о железе, которые вы приобрели на прошлом уроке
Проходит в игровой соревновательной форме
Блиц-опрос. Учащимся задаются следующие вопросы (беседа фронтальная):
-
Знак, которым обозначается железо?
-
Его относительная атомная масса?
-
Каково местоположение его в системе элементов?
-
В каком виде находится железо в природе?
-
Назовите соединение, образующееся при горении железа и при реакции его с парами воды?
-
Какую кислоту можно хранить в железной таре?
«Химический лабиринт»
.
-
Формирование новых понятий и способов действий (этап исследования) – 15 мин
- Какие соединения образует железо?
Ответы учащихся: Оксиды, основания, соли.
- А какие степени окисления проявляет железо?
Ответы учащихся: +2; +3.
Соответственно железо с разными значениями степени окисления будет образовывать оксиды, основания и соли с разными формулами.
На интерактивную доску выводится таблица «Соединения железа» (без формул), в которую трое учащихся записывают формулы соединений железа +2 и +3.
| Соединения железа | |||
| оксид | основание | Соль (хлорид) | |
| Fe2+ | FeO | Fe(OH)2 | FeCl2 |
| Fe3+ | Fe2O3 | Fe(OH)3 | FeCl3 |
Как мы видим соединений железа много, и на сегодняшнем уроке мы поговорим об основаниях и некоторых солях железа и изучим их свойства.
Сегодня вы побываете в роли исследователей. Задача, стоящая перед вами: получить гидроксиды железа, исследовать их свойства, провести качественные реакции на ионы Fe3+.
Объект исследования (на экране): гидроксид железа (II) (Fe(OH)2), гидроксид железа (III) (Fe(OH)3), хлорид железа (III) (FeCl3)
Цель исследования (на экране): изучение способов получения гидроксидов железа, их химических свойств, проведение качественных реакций на ионы железа Fe3+
Исследование мы будем проводить с помощью химического эксперимента. Для этого в ы были разделены на группы по интересам. Для работы вам предлагается инструкция, которая поможет в исследовании.
Первая группа получает и исследует свойства гидроксида железа (II), вторая – гидроксида железа (III), третья – проводит качественную реакцию на ионы железа Fe2+ и Fe3+, четвертая определяет содержание железа в продуктах питания. На столах лотки с необходимыми реактивами и оборудованием. Результаты всех экспериментов мы записываете в таблицу
(Учащиеся: выписывают на лист А2 и афишируют на доске результат исследования о свойствах гидроксидов железа (информация от группы оформляется на листе А2 с помощью маркера и прикрепляется к доске с помощью магнитов).
Но прежде чем приступить к выполнению эксперимента, вспомним правила техники безопасности при работе с химическими реактивами и лабораторным оборудованием.
Инструкция по проведению исследования
«Получение и свойства гидроксида железа (II)» 1 группа
Цель. Получить гидроксид железа (II) и изучить его свойства.
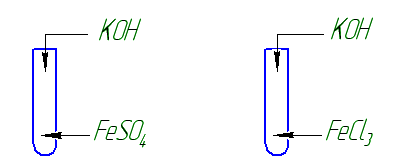
Реактивы: сульфат железа (ІІ) FeSO4, NaOH, HCl.
Опыт 1. В пробирку с раствором сульфата железа (ІІ) FeSO4 прилейте раствор гидроксида натрия NaOH. Заполните таблицу: отметьте окраску полученного вещества, напишите уравнение реакции
Опыт 2. Содержимое пробирки от 1-го опыта разлейте на 2 пробирки. В одну прилейте раствор соляной кислоты HCl, в другую раствор гидроксида натрия NaOH. Заполните таблицу: отметьте наблюдения, запишите уравнение реакции гидроксида железа (II) с соляной кислотой
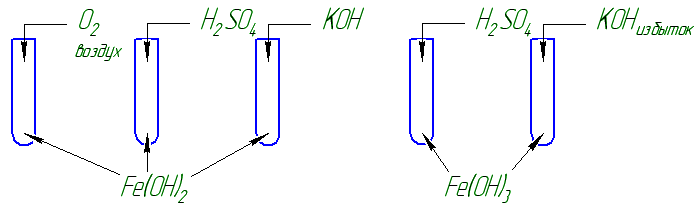
Сделайте вывод о характере свойств гидроксида железа (II): основный, амфотерный, кислотный? Результаты опытов оформите в виде таблицы (на ватмане):
Инструкция по проведению исследования
«Получение и свойства гидроксида железа (III)» 2 группа
Цель. Получить гидроксид железа (III) и изучить его свойства.
Реактивы: хлорид железа (ІIІ) FeСl3, NaOH, HCl.
Опыт 1. В пробирку с раствором хлорида железа (ІIІ) FeСl3 прилейте раствор гидроксида натрия NaOH. Заполните таблицу: отметьте окраску полученного вещества, напишите уравнение реакции
Опыт 2. Содержимое пробирки от 1-го опыта разлейте на 2 пробирки. В одну прилейте раствор соляной кислоты HCl, в другую раствор гидроксида натрия NaOH (до исчезновения осадка). Заполните таблицу: отметьте наблюдения, запишите уравнение реакции гидроксида железа (III) с соляной кислотой и гидроксидом натрия
Сделайте вывод о характере свойств гидроксида железа (III): основный, амфотерный, кислотный? Результаты опытов оформите в виде таблицы (на ватмане):
. 
Свойства гидроксида железа (II) и гидроксида железа (III)
| Гидроксида железа (II) | Гидроксид железа (III) | |
| 1. Получение | FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4 | FeCl3 + 3NaOH = Fe(OH)3 +3NaCl |
| 2. Цвет | Белый | Бурый |
| -Взаимодействие с кислотами | Fe(OH)2 + 2HCl = FeCl2 + 2H2O | Fe(OH)3 + 3HCl = FeCl3 + 3H2O |
| - взаимодействие с концентрированными растворами щелочей | Не взаимодействует | Fe(OH)3 + 3NaOH = Na3Fe(OH)6 |
| Вывод: Кислотно-основный характер гидроксидов: | Основные свойства | Амфотерные свойства |
| 4. Устойчивость на воздухе | Окисляется (не устойчив) 4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 | Не окисляется (устойчив) |
Инструкция по проведению лабораторной работы
«Качественные реакции на ионы Fe3+» 3 группа
Цель. Научиться проводить качественные реакции на ионы Fe3+.
Реактивы: хлорид железа (ІІI) FeCl3, красная кровяная соль K3[Fe(CN)6], желтая кровяная соль K4[Fe(CN)6], роданид калия KCNS.
1) В пробирку с раствором хлорида железа (ІІI) FeCl3 прилейте раствор красной кровяной соли K3[Fe(CN)6]. Отметьте окраску полученного вещества.
2) В пробирку с раствором хлорида железа (ІІI) FeCl3прилейте раствор желтой кровяной соли K4[Fe(CN)6]. Отметьте окраску полученного вещества.
3) В пробирку с раствором хлорида железа (ІІI) FeCl3 прилейте раствор роданида калия KCNS. Отметьте цвет полученного раствора.
4) Результаты опытов оформите в виде таблицы (на ватмане):
| Цвет содержимого пробирки до реакции | Цвет содержимого пробирки после реакции |
||
| FeCl3 |
| +красная кровяная соль | |
| FeCl3 | +желтая кровяная соль | | |
| FeCl3 | +роданид калия | |
Инструкция по проведению лабораторной работы
«Определение ионов железа в продуктах питания» 4 группа
Цель: определить содержание железа в некоторых продуктах питания.
Материал: яблоко, говядине, курага, зеленый лук,
Оборудование и реактивы: ступка с пестиком, мерная пробирка, пипетка; перекись водорода, р-р азотной кислоты, раствор роданида калия KСSN, азотная кислота
Предварительная подготовка: в ступке измельчить образцы анализируемых продуктов одинаковой массы, добавить 10 мл азотной кислоты, 1–2 мл пероксида водорода. Полученную смесь перетереть и перенести в стакан.
Отобрать по 2 мл экстракта добавить 1 каплю 20%–ного раствор роданида калия KSCN.
Сравнить окраску полученных растворов с колориметрической шкалой. Сделать вывод об относительном содержании железа в исследуемых продуктах питания.
Таб. № 3 Колориметрическая шкала
-
Концентрация Fe3+, мг/л
Окраска раствора
100
Буро-красная
10
Темно-красная
1
Розовая
0,5
Светло-красная
0,1
Отсутствует
-
Этап обмена информацией между группами
УЧИТЕЛЬ: Давайте подведем итог исследования и сделаем выводы.
На данном этапе группы выступают с результатами проделанной работы. На основании полученных результатов делают вывод об основных или амфотерных свойствах соответствующих соединений железа, о способах идентификации соединений железа.
-
Как и все нерастворимые основания гидроксид железа (II) и гидроксид железа (III) получают в лаборатории взаимодействием раствора соответствующей соли железа с раствором щелочи.
-
Гидроксид железа (II) неустойчив на воздухе, легко окисляется, гидроксид железа (III) устойчив.
-
Гидроксид железа (II) проявляет основные свойства, гидроксид железа (III) – слабо выраженные амфотерные свойства.
УЧИТЕЛЬ: Вы уже знаете, что в химии многие вещества, т. е. ионы, которые их образуют,
можно легко распознать, обнаружить с помощью специфических реакций – качественных. Также и ионы Fe3+ можно обнаружить с помощью некоторых качественных реакций. Именно это нам и расскажут ребята.
4 группа с помощью этой реакция исследовали наличие ионов железа +3 в различных продуктах питания. Выслушаем их ответ.
УЧИТЕЛЬ: Казалось бы, как далеки наши сегодняшние исследования от жизни. Но соединения железа как никакие другие важны для жизнедеятельности живого организма.
Сообщение учащегося «Биологическая роль соединений железа» (3 мин)
6. Контроль знаний. Тест. (Приложение 1)
7. Подведение итогов
Наш урок подходит к концу.
-
Что нового вы узнали на уроке?
-
Какие уже имеющиеся у тебя знания понадобились на уроке?
-
Какие способы и приемы работы ты использовал на уроке (составлял таблицу, рисовал схему, составлял тезисы и т.д.)?
-
Какие знания, полученные на уроке, понадобятся тебе в будущем? Где ты применишь полученные знания?
-
Что тебе понравилось на уроке больше всего?
8. Рефлексивно-оценочный этап
Далее работа в группах осуществляется в подведении итогов работы группы. Выставление оценок за работу (каждая оценка обсуждается в группе и аргументируется руководителем группы). Руководитель группы сдает учителю оценочные листы. Учитель подводит итог урока в целом.
Прием рефлексии «Термометр». Учащимся предлагается нарисовать на полях шкалу от –12 до +12 и отметить свое эмоциональное состояние в начале и конце урока. Общее эмоциональное состояние можно узнать, попросив поднять руки тех учащихся у кого ниже 0, выше 0, равна –12, +12 или 0.
Я благодарю вас за прекрасное общение, вы очень работоспособны. Я желаю вам успехов в изучении химии!
Приложение 1
Тестовые задания
1) Основания 2) Кислоты 3) Соли 4) Оксиды
2. Какие степени окисления проявляет железо:
1) +1 2) +2 3) +2, +3 4) +4
3. Какие свойства проявляет гидроксид железа (II):
1) Кислотные 2) Основные 3) Амфотерные
4. Какой цвет имеет осадок гидроксид железа (III)
1) Белый 2) Зеленый 3) Бурый 4) Синий
5. Какое соединение железа легко окисляется на воздухе, изменяя цвет:
1) Гидроксид железа (II) 2) Гидроксид железа (III) 3) Оксид железа 4) Соли железа
Здесь представлен конспект к уроку на тему «Соединения железа», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

