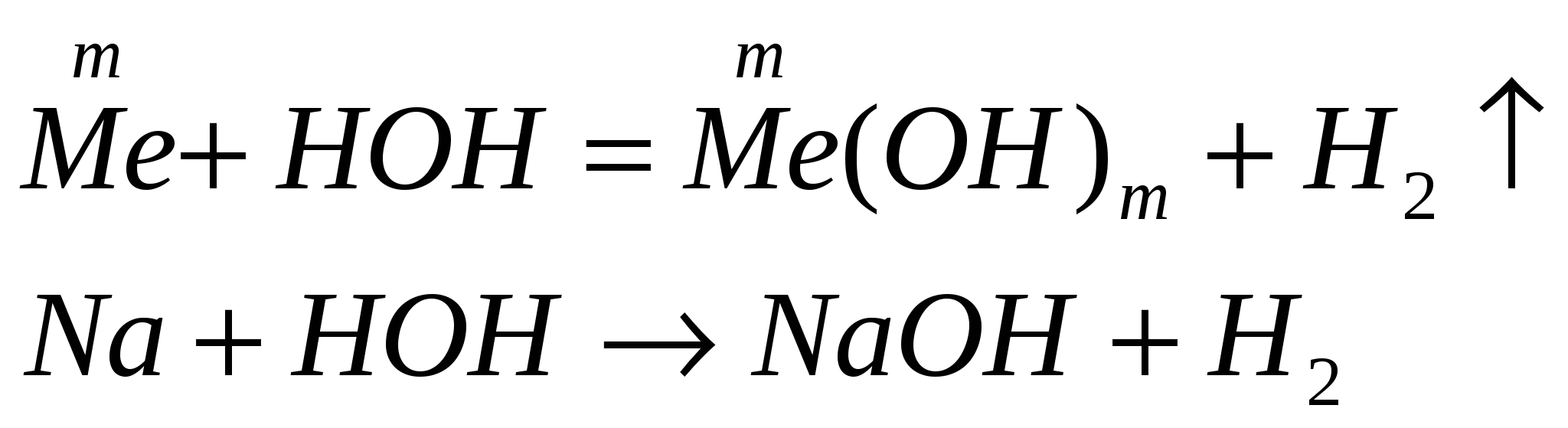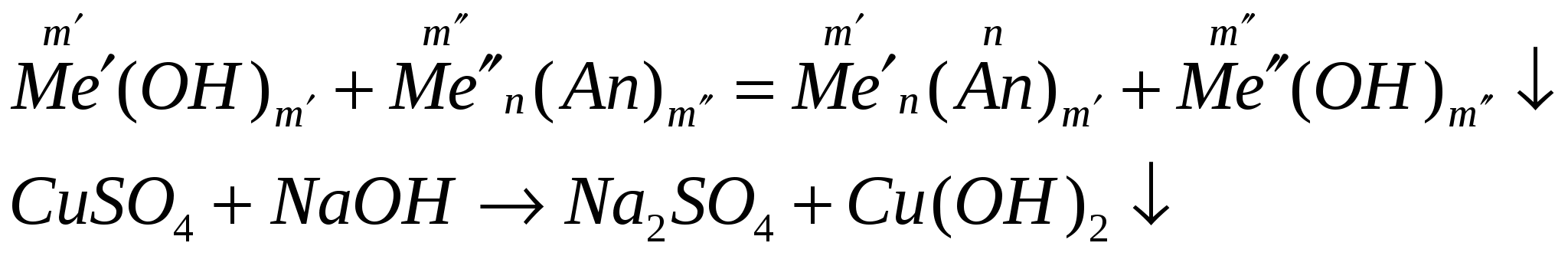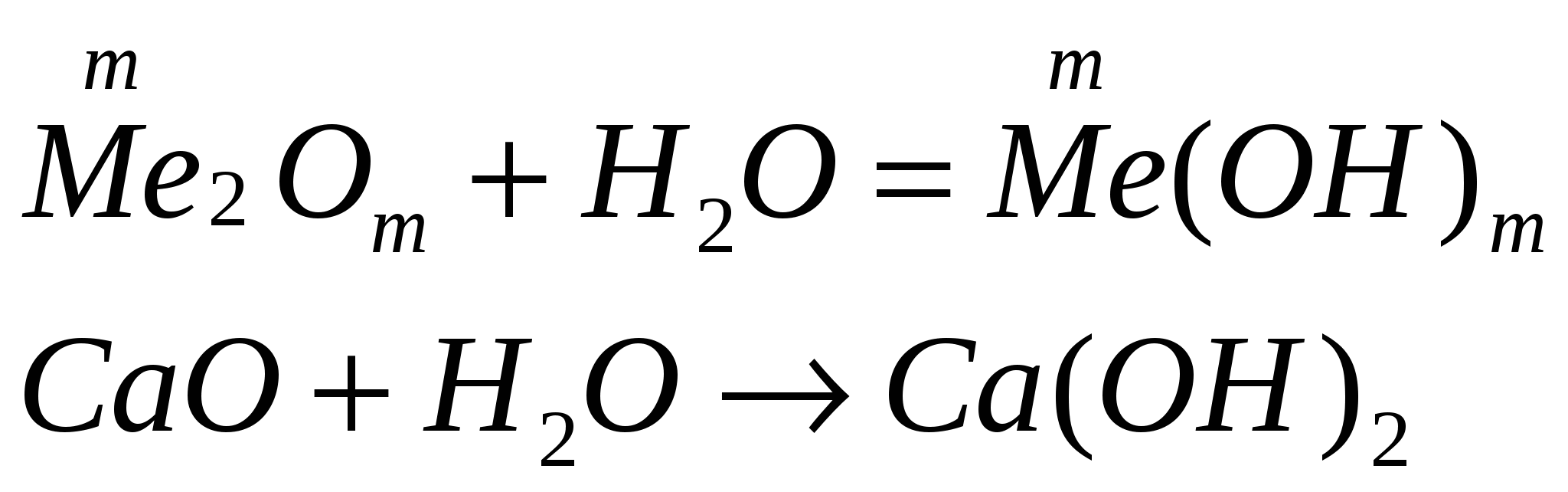Конспект урока «Гидроксиды металлов» по химии
Гидроксиды металлов

| | АМФОТЕРНЫЕ | | КИСЛОТЫ |
-
РАСТВОРИМЫЕ ИЛИ ЩЕЛОЧИ
НЕРАСТВОРИМЫЕ
Классификация оснований
-
по кислотности – однокислотные (содержат одну гидроксильную группу), многокислотные (содержат несколько гидроксильных групп)
-
по растворимости в воде – растворимые или щелочи и нерастворимые.
Номенклатура оснований и амфотерных гидроксидов: гидроксид + русское название металла + (валентность металла)
Физические свойства:
-
все неорганические основания – твердые вещества,
-
большинство оснований белого цвета, однако, есть окрашенные, например Cu(OH)2 – голубого, CuOH – желтого, Fe(OH)3 – красно-бурого цвета.
-
По отношению к воде растворимые и нерастворимые (выпишите растворимые и нерастворимые основания по таблице).
Химические свойства
Химические свойства щелочей.
-
растворяются в воде
-
действуют на индикаторы
-
взаимодействуют с кислотными оксидами:
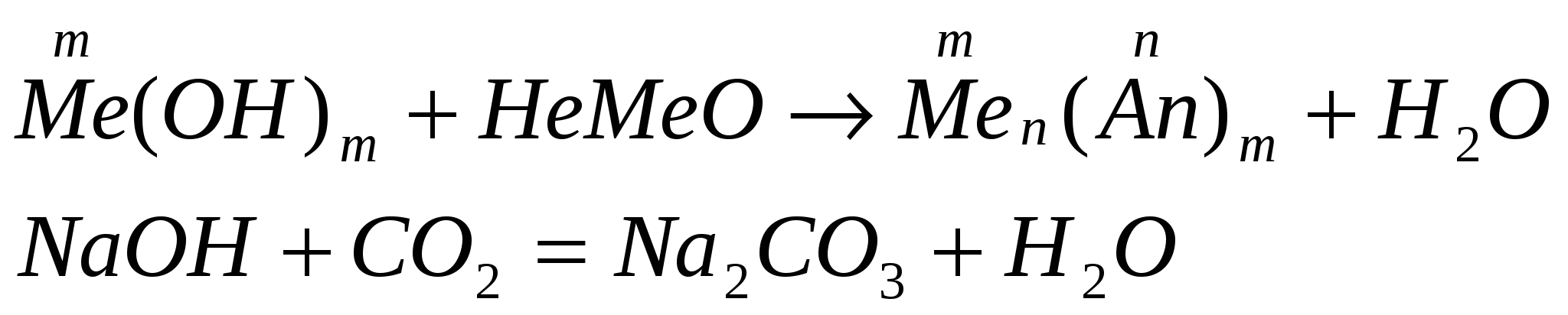
-
взаимодействуют с кислотами (реакция нейтрализации)
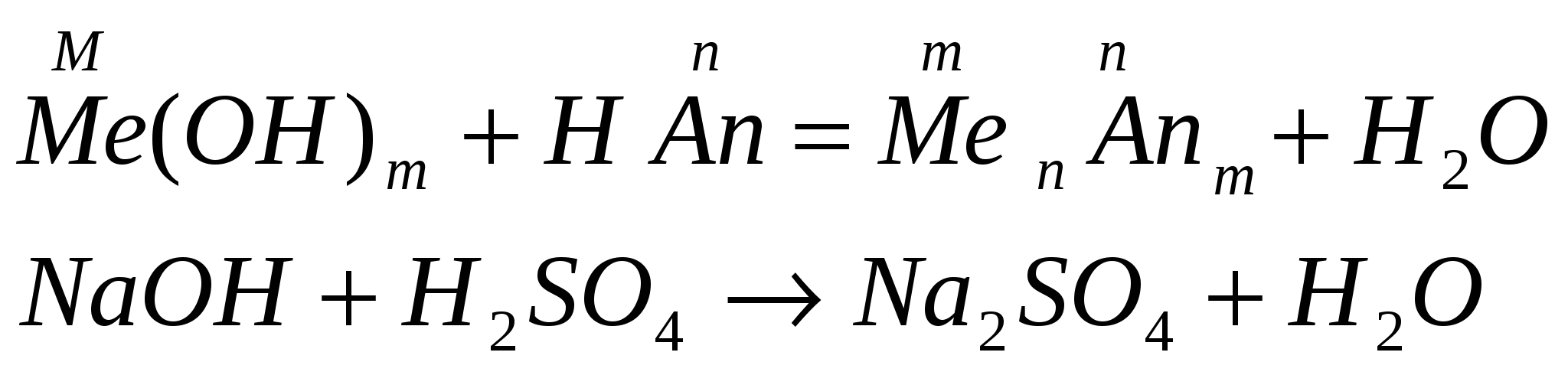
-
взаимодействуют с солями, если выпадает осадок
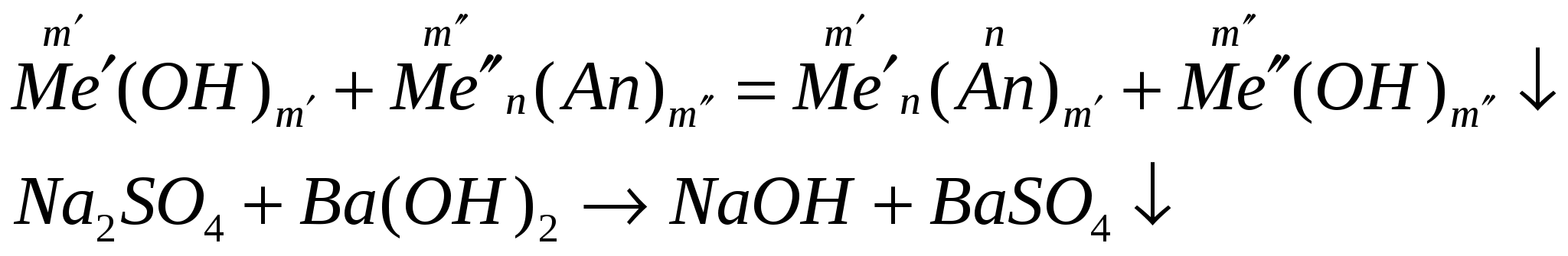
-
взаимодействуют с амфотерными оксидами
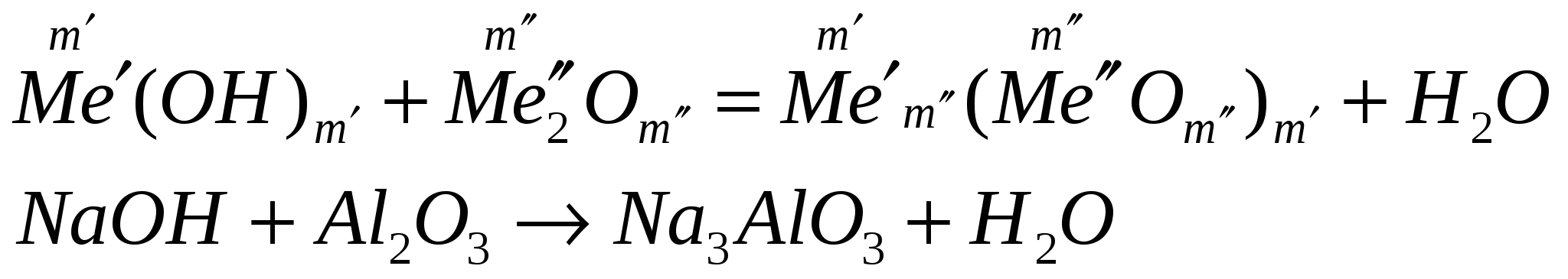
-
взаимодействуют с амфотерными гидроксидами.

Химические свойства нерастворимых оснований
-
взаимодействуют с кислотами
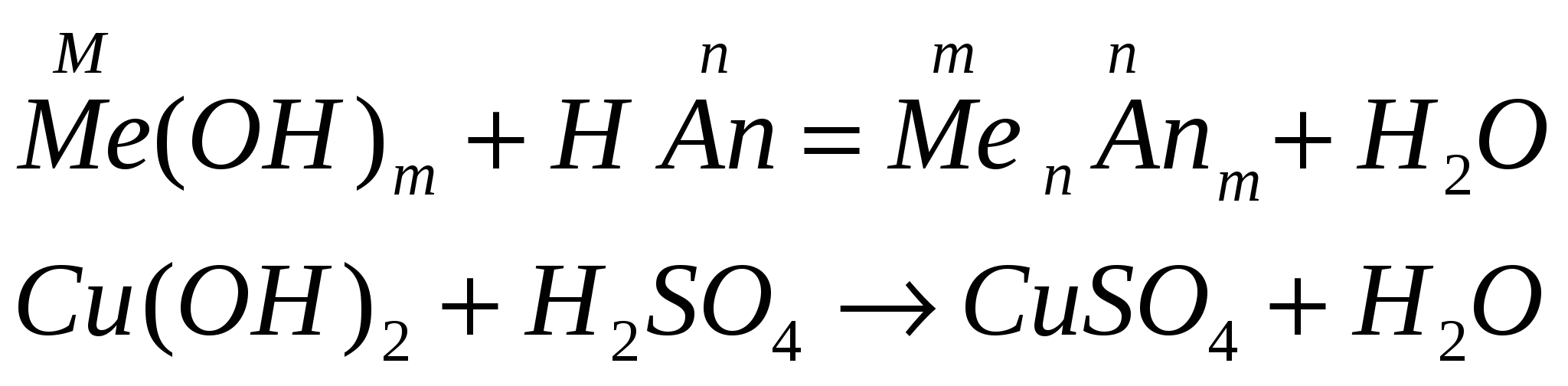
-
разлагаются при нагревании
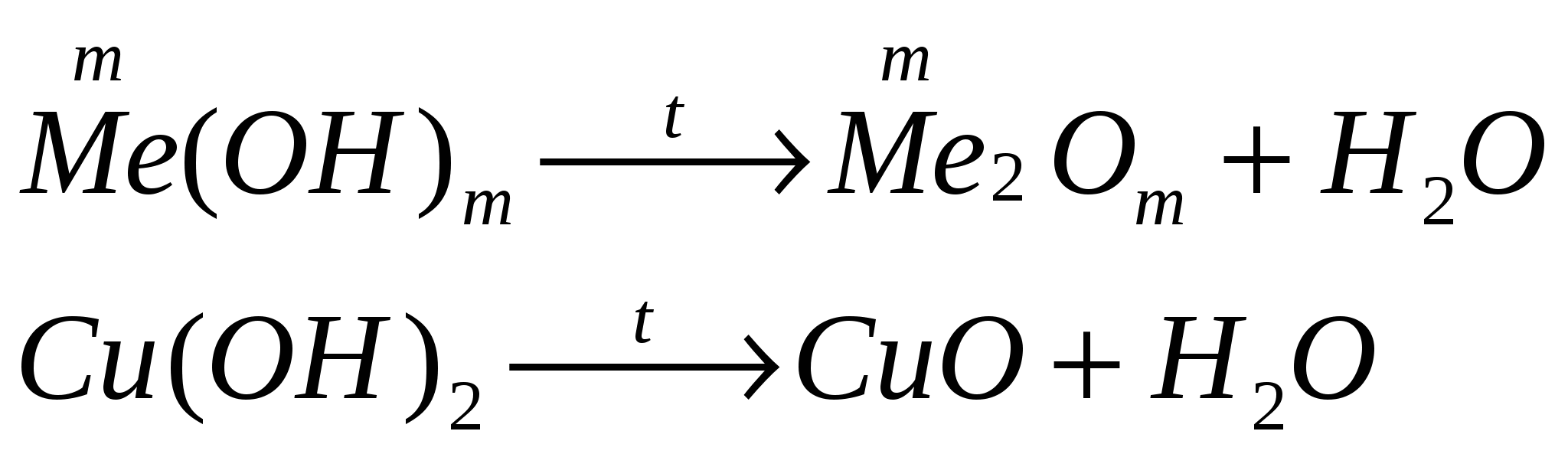
Химические свойства амфотерных гидроксидов.
-
взаимодействуют с кислотами
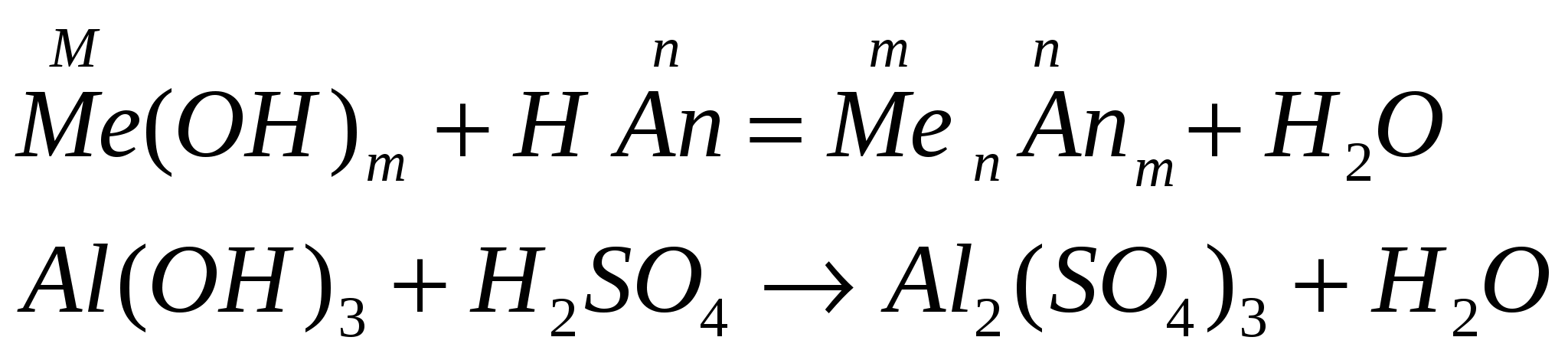
-
разлагаются при нагревании
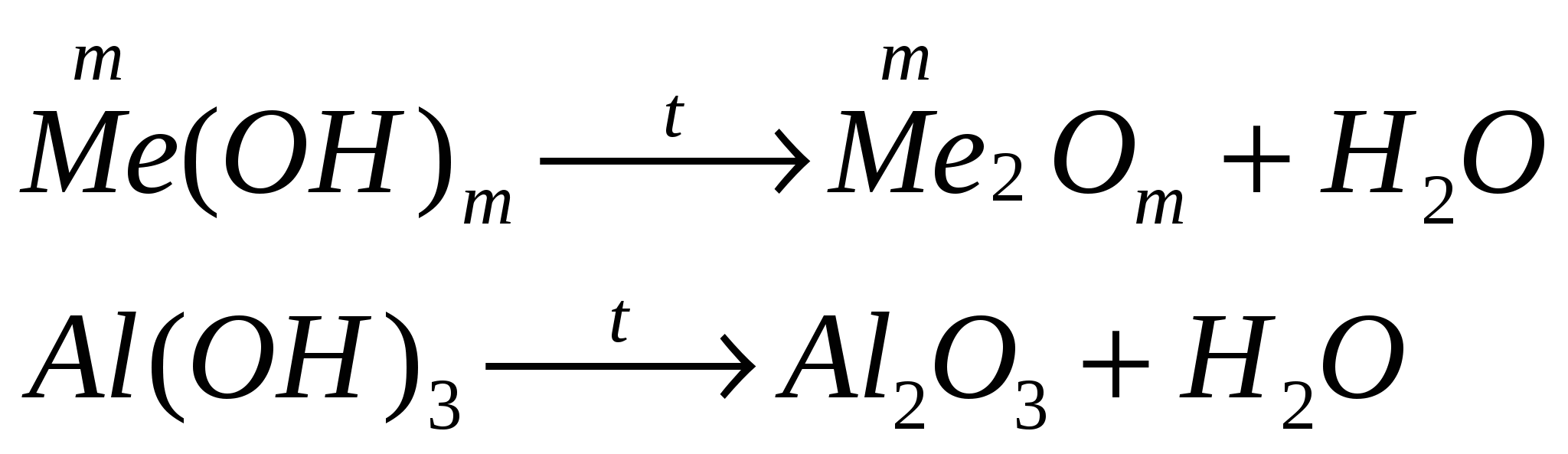
-
взаимодействуют с основаниями
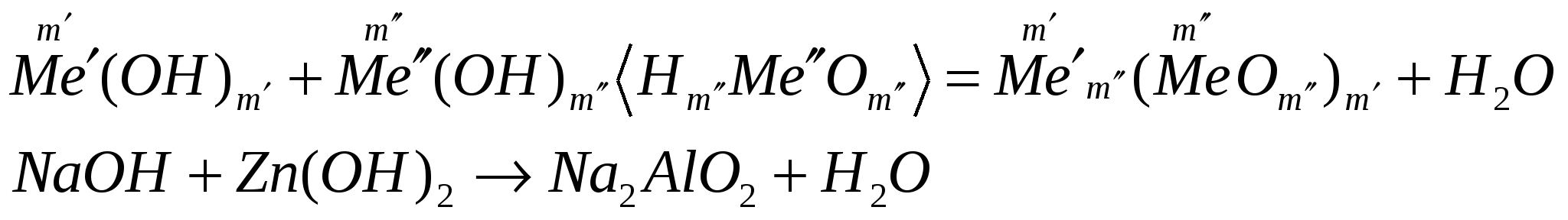
ПОЛУЧЕНИЕ ОСНОВАНИЙ
| Нерастворимые и амфотерные основания | |
| Действием щелочей с водными растворами солей:
|
| 2. Взаимодействие оксида металла с водой
| |
| 3. Электролиз растворов солей:
|
Здесь представлен конспект к уроку на тему «Гидроксиды металлов», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.


 ИДРОКСИДЫ Ме
ИДРОКСИДЫ Ме
 СНОВАНИЯ
СНОВАНИЯ