Презентация "Соединения азота" по химии – проект, доклад
Презентацию на тему "Соединения азота" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 24 слайд(ов).
Слайды презентации
Список похожих презентаций
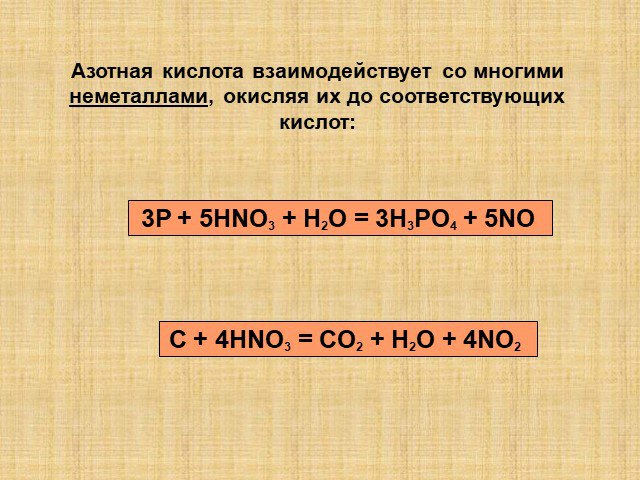
Кислородные соединения азота и их свойства
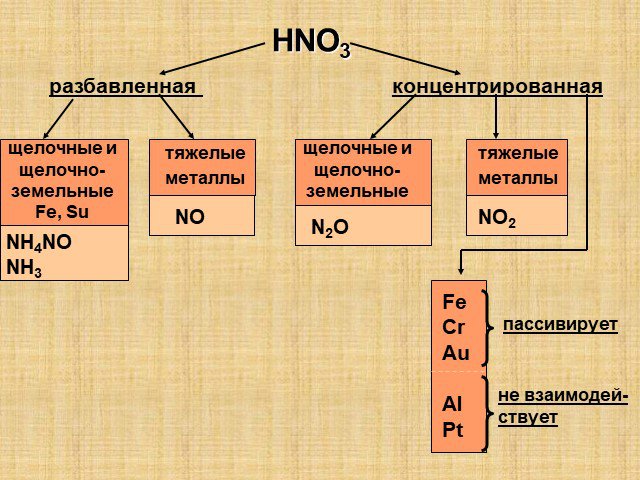
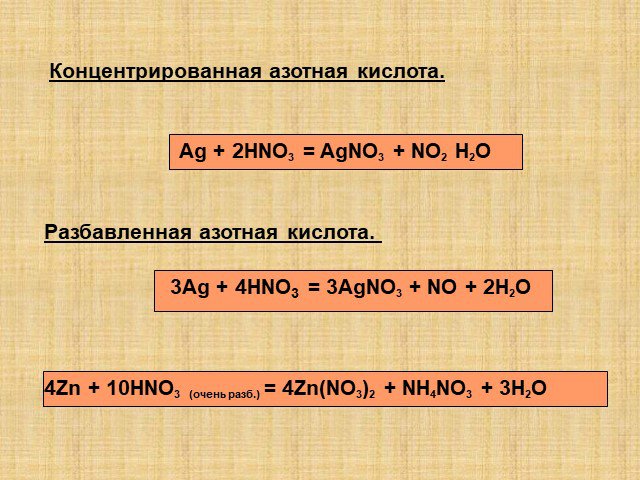
Цель урока:. Расширить, обобщить, закрепить, оценить знания по теме: «Кислородные соединения азота» Повторить свойства азотной кислоты Закрепить особенности ...Кислородные соединения азота
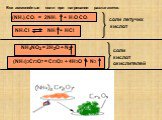
Оксиды азота:. . Вещества, образующиеся из оксидов азота:. N2O NO - несолеобразующие N2 N2+3O3-2 HNO2 Соли нитриты NO2 + H2O = HNO3+ HNO2 N2+5O5-2 ...Фосфор. Соединения фосфора
5. Причина свечения белого фосфора…. а)изменение агрегатного состояния вещества б) химическое явление в) физическое явление б) химическое явление ...Урок Соединения фосфора
Изучение темы рассчитано на 2 урока:. Фосфор и его соединения. Кислородные соединения фосфора. Цели:. Сформировать знания о фосфоре как о химическом ...Соединения щелочноземельных металлов
Соединения щелочноземельных металлов. Тип и класс веществ. Физические свойства. Химические свойства. Оксиды щелочноземельных металлов. . 15.03.2019. ...Соединения химических элементов
1 Станция «Теоретическая». Из предложенного списка веществ выписать отдельно: оксиды, кислоты, соли, основания: Н2SО4, Аl (NО3)3, МgСl2, Са(ОН)2, ...Соединения серы
Сероводоро́д, сернистый водород Н2S. Общие Систематическое наименование сероводород / hydrogen sulphide Химическая формула H2S Отн. молек. Масса 34.082 ...Соединения серы
Оксид серы (VI). Физические свойства серной кислоты. Безводная серная кислота - это бесцветная маслянистая жидкость без запаха, смешивается с водой ...Соединения железа
Железо расположено в 4 периоде, в побочной подгруппе VIII группы Периодической системы химических элементов Д.И.Менделеева. Относительная атомная ...Подгруппа азота
1.С ростом порядкового номера элемента кислотные свойства оксидов в ряду…. N2O - P2O3 - As2O3 - Sb2O3 -Bi2O3. а) усиливаются б) ослабевают в) остаются ...Оксиды азота
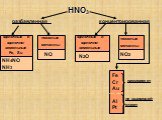
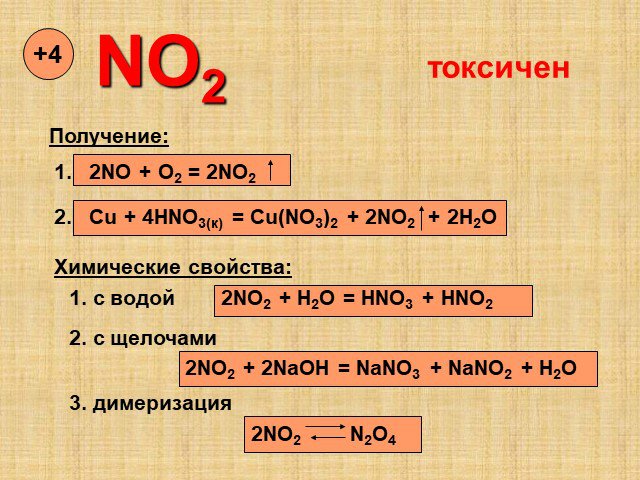
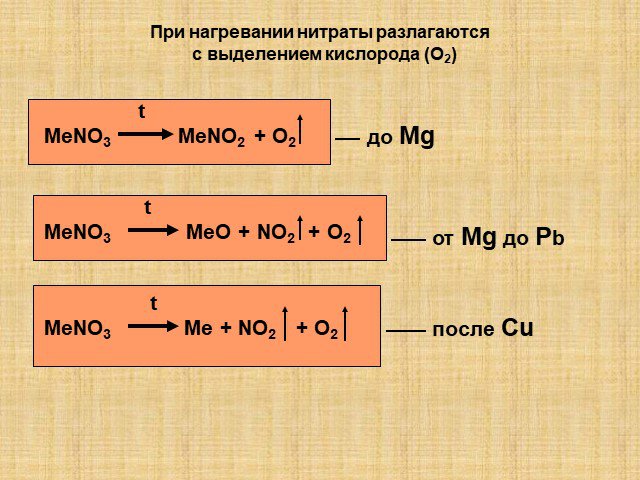
Оксиды азота. Физические свойства, токсичность, методы получения. ФИЗИЧЕСКИЕ СВОЙСТВ ОКСИДОВ АЗОТА. Оксид азота (I), закись азота, «веселящий газ». ...Оксиды азота
Содержание. Виды оксидов азота. Оксид азота(I). Оксид азота(II). Оксид азота(III). Оксид азота(IV). Азотный ангидрид. Виды оксидов азота. N2O NO N2O3 ...Круговорот азота в природе
Круговорот азота представляет собой ряд замкнутых взаимосвязанных путей, по которым азот циркулирует в земной биосфере. Различные микроорганизмы извлекают ...Круговорот азота
Цель: Изучить биохимические процессы круговорота азота в природе; Узнать, что такое круговорот азота; Задачи: Что такое азот? Что такое Круговорот ...Генеалогическое древо азота
Строение атома азота. Азот – „безжизненный, апатичный, инертный” 1S22S22P3 Высшая валентность IV Высшая степень окисления +5 Степени окисления азота ...Подгруппа азота
Выбери игру.Управление презентацией. 1. Главный слайд - № 2 (по гиперссылке необходимо перейти на любую из игр).
На главный слайд (№ 2).
Завершить ...
Соединения галогенов.
Подготовка к тестированию. Перечислите особенности строения элементов неметаллов. 2.Укажите период, в котором больше всего элементов неметаллов? 3. ...Подгруппа азота (V - А группа)
N P As Sb Bi - азот - фосфор. - мышьяк ( арсеникум). - сурьма (стибиум) - висмут. Чем похожи и чем различаются элементы главной подгруппы V группы? ...Соединения кальция.
Оксид кальция. Гидроксид кальция. Гидроксид кальция – известковая вода, известковое молоко. Гипс. Мел. . Известняк. Одесские катакомбы. Здания из ...Подгруппа углерода и азота
Цель урока:. Закрепить и обобщить знания об основных физических и химических свойствах углерода, азота и их соединений. Продолжить формировать умение ...Конспекты
Соединения азота
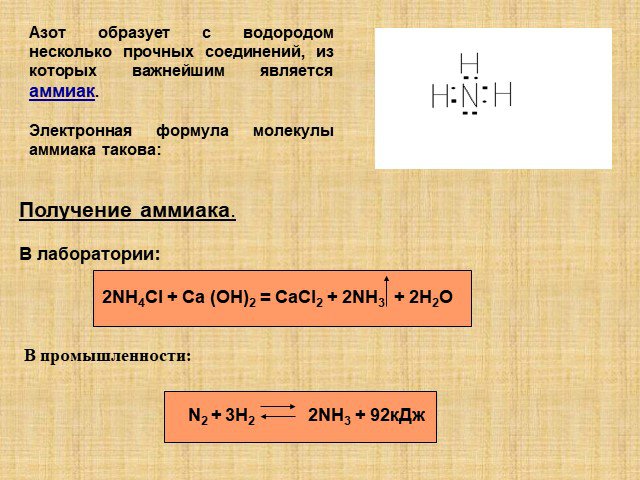
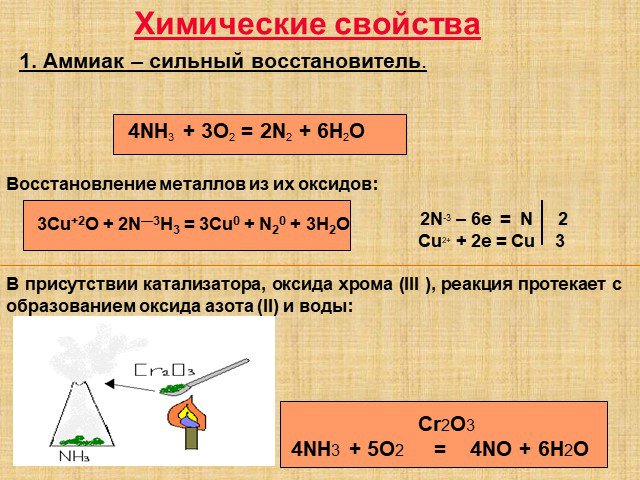
Урок химии в 9 классе по теме: «Соединения азота». Составитель урока. : учитель химии МОУ СОШ № 2 Нытвенского района Пермского края Ощепкова Ирина ...Важнейшие соединения азота и фосфора, специфические свойства
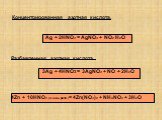
Тема:. Важнейшие соединения азота и фосфора, специфические свойства. Цель:. Проследить связь важнейших соединений азота, роль аммиака, азотной ...Кислородные соединения азота
Технологическая карта урока. Данные об учителе:. Ткачук Татьяна Макаровна , учитель химии МБОУ «Михайловская СОШ, высшая категория. Предмет:. ...Соединения химических элементов
Автор: Деревенчук Лариса Викторовна. 8 класс. Тема урока: Соединения химических элементов. Тип урока:. урок обобщения и систематизации знаний. ...Соединения химических элементов
Обобщающий урок по теме. :. « Соединения химических элементов». Цель урока:. . . Обобщить и систематизировать знания учащихся о классификации ...Соединения железа
МКОУ Богучарская общеобразовательная школа № 2. Учитель химии Хаустова Ольга Анатольевна. . Класс:. 9. Тема урока:. . Соединения железа. Тип ...Соединения железа
Класс:. 9. Тема урока:. «. Соединения железа». Цель урока:. организовать деятельность учащихся по усвоению и первичному закреплению знаний ...Соединения железа
Конспект урока в 9 классе на тему «Соединения железа». Цель урока: изучить свойства соединений железа (II. ) и (III. ), понять, какое практическое ...Галогены. Соединения галогенов
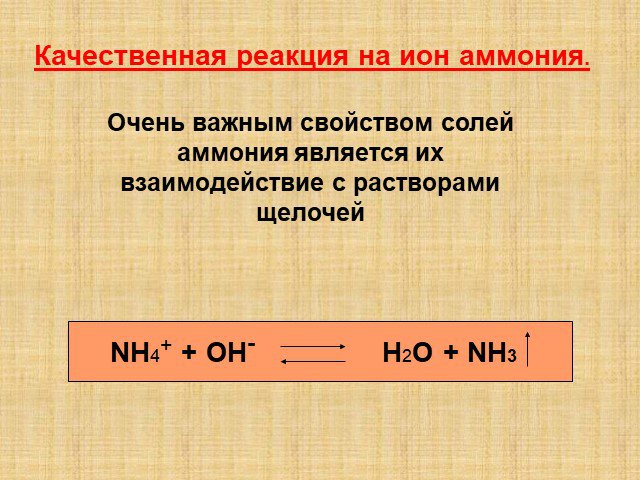
Конспект урока. Аттестуемый педагог Краснова Оксана Владимировна. Предмет Химия. Класс 9. . Тема урока. «Галогены. Соединения галогенов ». ...Соли аммония. Оксиды азота (II) и (IV)
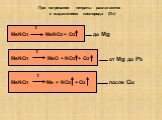
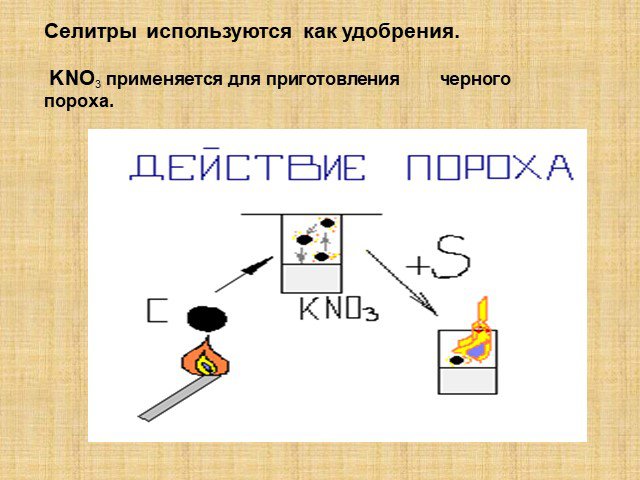
Урок 20. Соли аммония. Оксиды азота (II) и (IV). Цели урока:. 1. Охарактеризовать соли аммония и оксиды азота (II) и (IV) по следующей схеме: ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:учитель химии Шишкина И.Ю.
Содержит:24 слайд(ов)
Поделись с друзьями:
Скачать презентацию















![2. образование солей аммония. Реакции с образованием донорно – акцепторной связи. NH3 + H2O NH3 . H2O NH4+ + OH- NH4OH NH4+ + OH— Н NH3 + H+Cl- [ H N H ]+ Cl- H 2. образование солей аммония. Реакции с образованием донорно – акцепторной связи. NH3 + H2O NH3 . H2O NH4+ + OH- NH4OH NH4+ + OH— Н NH3 + H+Cl- [ H N H ]+ Cl- H](https://prezentacii.org/upload/cloud/14/09/4741/images/thumbs/screen5.jpg)