Презентация "d-Элементы I Б группы." по химии – проект, доклад
Презентацию на тему "d-Элементы I Б группы." можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 41 слайд(ов).
Слайды презентации
Список похожих презентаций
Щелочные металлы - элементы I группы главной подгруппы
Li Na K Rb Cs Fr. Физические свойства щелочных металлов:. Серебристого цвета Мягкие, легко режутся ножом Твердость от Li → Na → K → Rb → Cs → Fr уменьшается: ...Элементы главной подгруппы V группы
Фосфор и здоровье человека. Содержание фосфора в организме человека (масса тела 70 кг) составляет 780 г. Суточная доза для взрослых 1 г. Бирюза(минерал ...Характеристика элементов VII группы главной подгруппы. Хлор
. . . . Нахождение в природе.В земной коре хлор - самый распространённый галоген. Поскольку хлор очень активен, в природе он встречается только ...
Соединения Ca и Mg, представителей элементов II группы главной подгруппы
План урока. Проверка домашнего задания. 2. Знакомство с соединениями металлов главной подгруппы второй группы. 3. Л/р «Изучение коллекции соединений ...Общая характеристика элементов главной подгруппы VI группы (подгруппы кислорода)
Строение атома. КИСЛОРОД. Кислород O2 (К.В. Шееле 1772 г., Дж. Пристли 1774 г.) Самый распространенный элемент на Земле; в воздухе - 21% по объему; ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Органическая химия
история развития органической химии предмет органической химии особенности органических веществ Бутлеров теория строения органических соединений Бутлерова ...Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Углеводы химия
Содержание. Классификация углеводов Моносахариды Нахождение в природе Изомерия Получение Физические свойства Химические свойства Источники информации. ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...Сложные эфиры химия
Цели урока:. 1.Изучить строение сложных эфиров. 2.Познакомиться с механизмом реакции этерификации. Номенклатура. Названия сложных эфиров происходит ...Аналитическая химия
Определение. Аналити́ческая хи́мия — раздел химии, изучающий химический состав и структуру веществ; имеет целью определение элементов или групп элементов, ...Аналитическая химия
План доклада. Аналитическая химия (определение) Гармонизация терминологии по аналитической химии Роль терминологии Источники терминологии Цели и задачи ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...алюминий химия
получение алюминия. Применение алюминия. ...«Электролитическая диссоциация» химия
Электролитическая диссоциация. H2O. Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электролитической диссоциацией. ...«Окислительно-восстановительные реакции» химия
СОДЕРЖАНИЕ:. 1. Какие реакции называются окислительно-восстановительными? 2. Что называют окислителем, восстановителем? 3. Окислительно-восстановительный ...«Нуклеиновые кислоты» химия
Цель урока: сформировать у студентов понимание взаимосвязанности и взаимозависимости веществ в клетке. Задачи урока: повторить строение и основные ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Конспекты
Характеристика металлов II группы главной подгруппы
Тема урока:. . Характеристика металлов. II. группы главной подгруппы. Цель урока: дать характеристику металлов II. группы главной подгруппы. ...Элементы IA-IIIA группы ПСХЭ
Дата_____________ Класс_______________. Тема: Общение знаний по теме. «Элементы. IA. -. IIIA. группы ПСХЭ». . Цели урока:. повторить, углубить ...Общая характеристика элементов 1 группы, главной подгруппы
№. п/п. . Структурные элементы. . . . . Дата. . . 08.10.2014г. . . . Класс. . 9. . . . . Тема урока. . ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 декабря 2018
Категория:Химия
Содержит:41 слайд(ов)
Поделись с друзьями:
Скачать презентацию



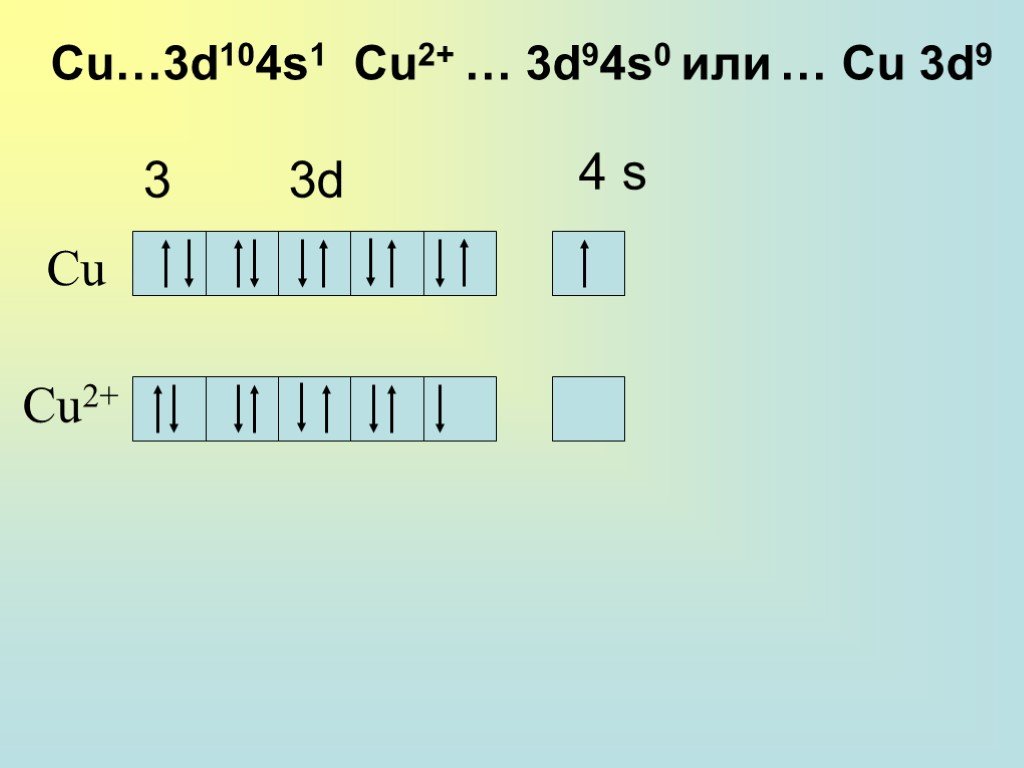









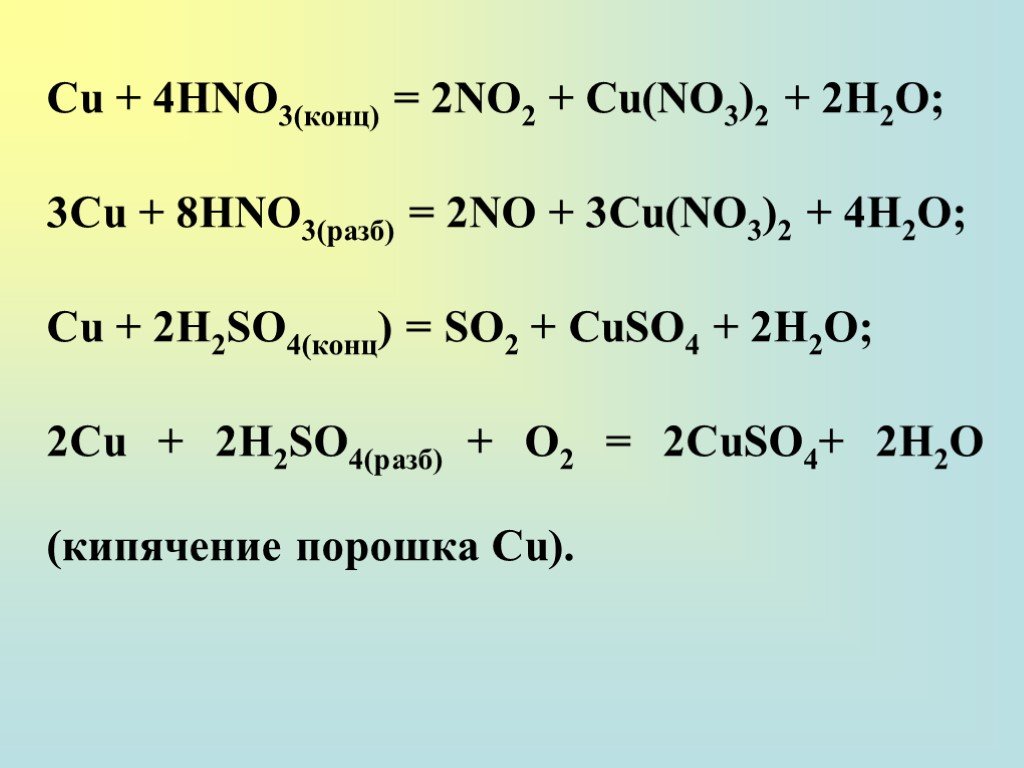



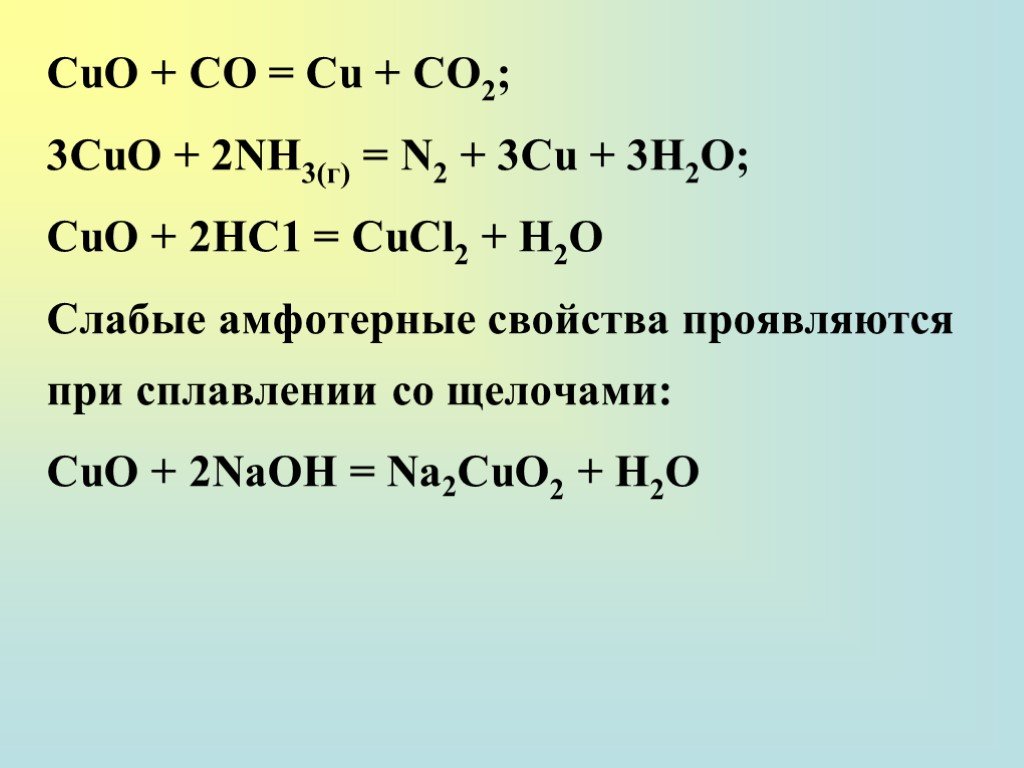








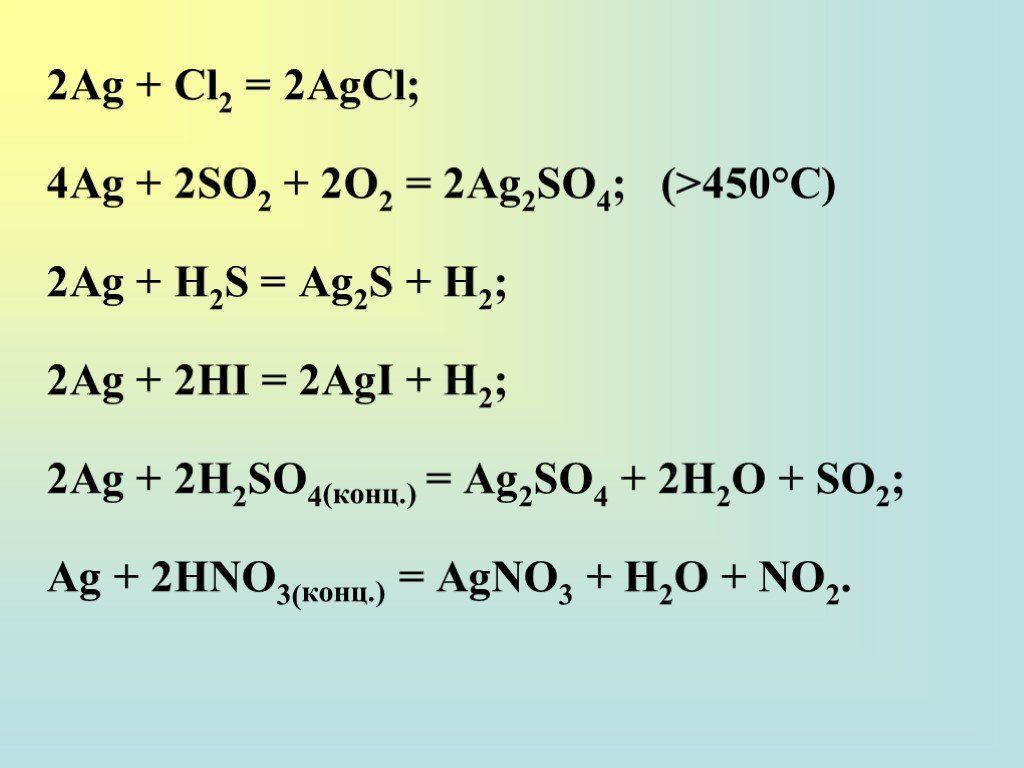

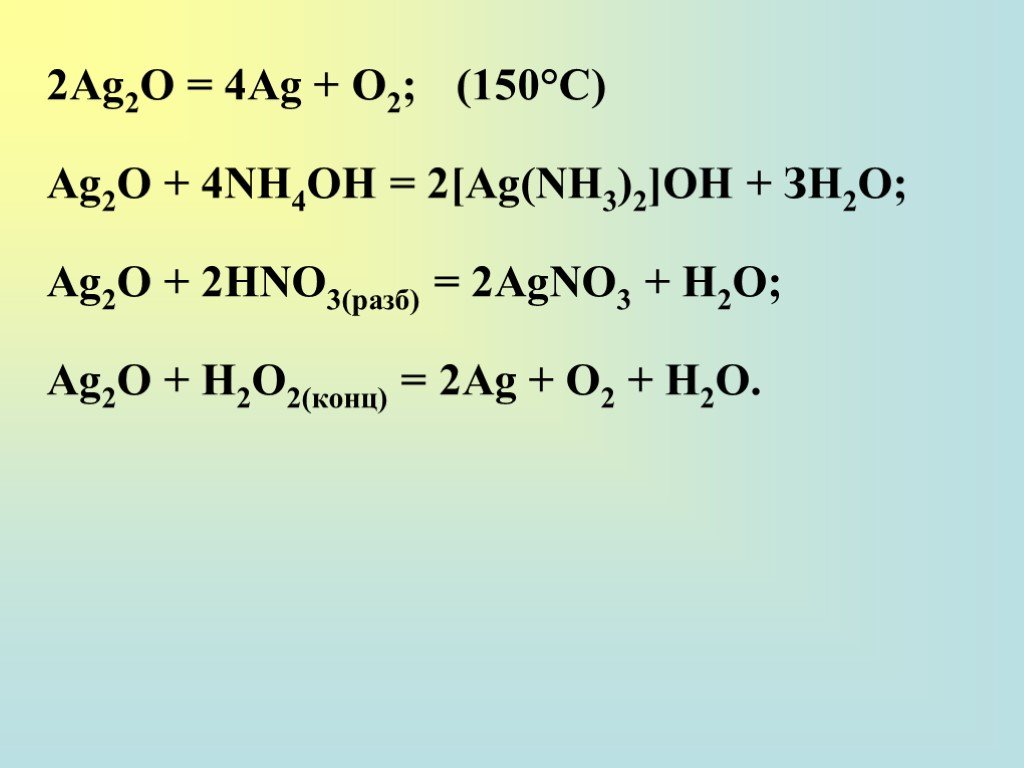









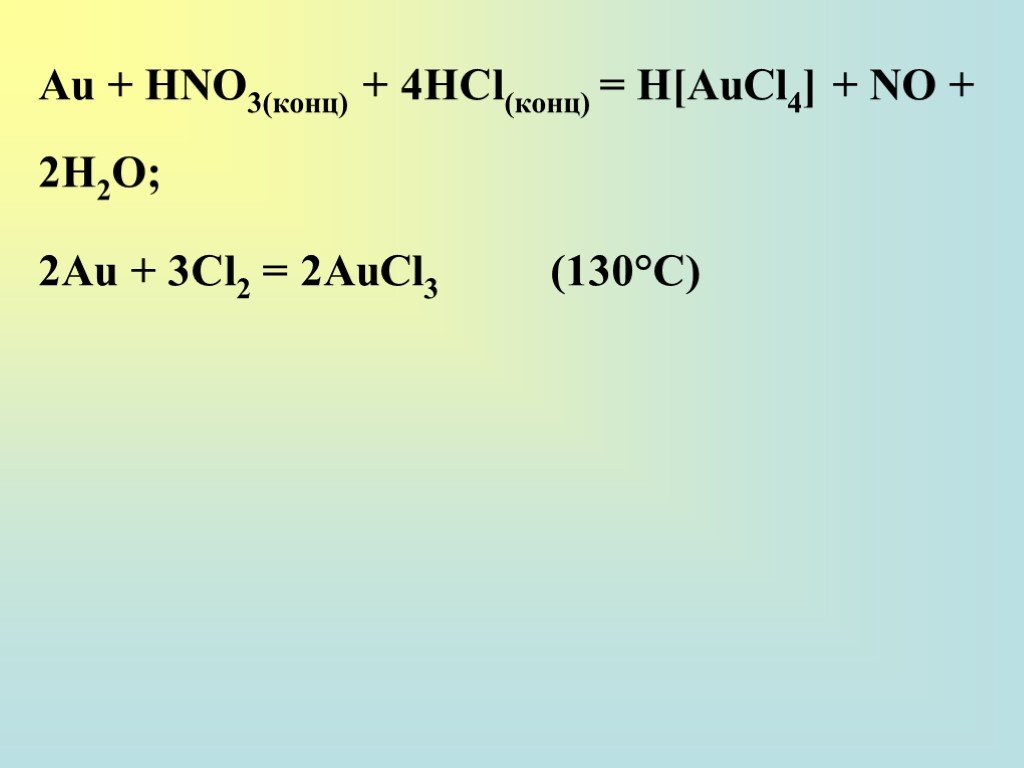



![Общая характеристика группы. 28Cu 1s22s22p63s23p63d104s1; [Ar] 3d104s1 47Ag 1s22s22p63s23p63d104s24p64d105s1; [Kr] 4d105s1 79Au 1s22s22p63s23p63d104s24p64d104f145s25p65d106s1; [Xe] 4f145d106s2 Общая характеристика группы. 28Cu 1s22s22p63s23p63d104s1; [Ar] 3d104s1 47Ag 1s22s22p63s23p63d104s24p64d105s1; [Kr] 4d105s1 79Au 1s22s22p63s23p63d104s24p64d104f145s25p65d106s1; [Xe] 4f145d106s2](https://prezentacii.org/upload/cloud/18/12/111038/images/thumbs/screen2.jpg)









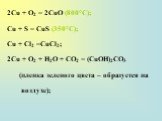
![Оксид меди (I) Сu2О - твердое вещество темно-красного цвета, обладает основными свойствами. Часть солей меди (I) растворима в воде, но легко окисляется кислородом воздуха, устойчивы комплексные соединения меди (I) [Cu(NH3)2]+: Оксид меди (I) Сu2О - твердое вещество темно-красного цвета, обладает основными свойствами. Часть солей меди (I) растворима в воде, но легко окисляется кислородом воздуха, устойчивы комплексные соединения меди (I) [Cu(NH3)2]+:](https://prezentacii.org/upload/cloud/18/12/111038/images/thumbs/screen14.jpg)
![Сu2О + 2НСl(разб) = 2CuCl + H2O; Сu2О + 4НСl(изб.) = 2H[CuCl2] + H2O; 2Сu2О + 8НСl(разб) + О2 = 4CuCl2 + 4Н2О; 2Сu2О + 4Н2О + О2 = 4Сu(ОН)2; Сu2О + СО = 2Сu + СО2. Гидроксид Cu(OH) не стоек и быстро окисляется. Сu2О + 2НСl(разб) = 2CuCl + H2O; Сu2О + 4НСl(изб.) = 2H[CuCl2] + H2O; 2Сu2О + 8НСl(разб) + О2 = 4CuCl2 + 4Н2О; 2Сu2О + 4Н2О + О2 = 4Сu(ОН)2; Сu2О + СО = 2Сu + СО2. Гидроксид Cu(OH) не стоек и быстро окисляется.](https://prezentacii.org/upload/cloud/18/12/111038/images/thumbs/screen15.jpg)


![Гидроксид меди (II) Сu(ОН)2 - соединение голубого цвета, не растворим в воде, термически неустойчив, преобладают основные свойства, слабый окислитель: CuSO4 + 2NaOH(разб.) = Cu(OH)2↓ + Na2SO4; Cu(OH)2 + 2HCl = CuCl2 + 2H2O; Cu(OH)2 + 2NaOH(конц.) = Na2[Cu(OH)4]; Купраты щелочных металлов имеют синюю Гидроксид меди (II) Сu(ОН)2 - соединение голубого цвета, не растворим в воде, термически неустойчив, преобладают основные свойства, слабый окислитель: CuSO4 + 2NaOH(разб.) = Cu(OH)2↓ + Na2SO4; Cu(OH)2 + 2HCl = CuCl2 + 2H2O; Cu(OH)2 + 2NaOH(конц.) = Na2[Cu(OH)4]; Купраты щелочных металлов имеют синюю](https://prezentacii.org/upload/cloud/18/12/111038/images/thumbs/screen18.jpg)
2 + 4H2O; качественная реакция на альдегиды: 2Cu(OH)2 + СН3СНО = Cu2O + СН3СООН + 2H2O 2Cu(OH)2 + CO2 = Cu2 ( ОН)2 СО3- + H2O; Cu(OH)2 = CuO + 2H2O; Cu(OH)2 + 4NH4OH = [Cu(NH3)4](OH)2 + 4H2O; качественная реакция на альдегиды: 2Cu(OH)2 + СН3СНО = Cu2O + СН3СООН + 2H2O](https://prezentacii.org/upload/cloud/18/12/111038/images/thumbs/screen19.jpg)

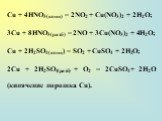
![Соли меди (II) сильных кислот подвергаются в водных растворах значительному гидролизу. Катион находится в гидратированном состоянии: Cu2+ + Н2О CuOH + + Н+; Сu2++ 4Н2О [Cu(H2O)4]3+ [Cu(H2O)4]2+ + Н2О [Cu(OH)(H2O)3]+ + Н3О+ гидролиз в протолитической форме Соли меди (II) сильных кислот подвергаются в водных растворах значительному гидролизу. Катион находится в гидратированном состоянии: Cu2+ + Н2О CuOH + + Н+; Сu2++ 4Н2О [Cu(H2O)4]3+ [Cu(H2O)4]2+ + Н2О [Cu(OH)(H2O)3]+ + Н3О+ гидролиз в протолитической форме](https://prezentacii.org/upload/cloud/18/12/111038/images/thumbs/screen21.jpg)
2 Свойство Сu (ΙΙ) реагировать с белками и пептидами, а также с биуретом (NH2 –CO–NH–CO–NH2) в щелочной среде с образованием окрашенных в сине-фиолетовый цвет комплексных соединений, используют для док Комплексные соединения меди (II) с аммиаком, аминокислотами, многоатомными спиртами. [Cu(NH3)4](OH)2 Свойство Сu (ΙΙ) реагировать с белками и пептидами, а также с биуретом (NH2 –CO–NH–CO–NH2) в щелочной среде с образованием окрашенных в сине-фиолетовый цвет комплексных соединений, используют для док](https://prezentacii.org/upload/cloud/18/12/111038/images/thumbs/screen22.jpg)





![2Ag2O = 4Ag + О2; (150°С) Ag2O + 4NH4OH = 2[Ag(NH3)2]OH + ЗН2О; Ag2O + 2НNО3(разб) = 2AgNO3 + Н2О; Ag2O + H2О2(конц) = 2Ag + О2 + Н2О. 2Ag2O = 4Ag + О2; (150°С) Ag2O + 4NH4OH = 2[Ag(NH3)2]OH + ЗН2О; Ag2O + 2НNО3(разб) = 2AgNO3 + Н2О; Ag2O + H2О2(конц) = 2Ag + О2 + Н2О.](https://prezentacii.org/upload/cloud/18/12/111038/images/thumbs/screen28.jpg)

![качественная реакция на хлорид-ион: HCl + AgNO3 → AgCl↓ + HNO3 NaCl + AgNO3 → AgCl↓ + NaNO3 AgCl + 2NH3 • H2O → [Ag(NH3)2]Cl + 2H2O AgCl + (NH4)2СO3 → [Ag(NH3)2]Cl + СO2↑ + H2O AgCl + 2Na2S2O3 → Na3[Ag(S2O3)2] + NaCl качественная реакция на хлорид-ион: HCl + AgNO3 → AgCl↓ + HNO3 NaCl + AgNO3 → AgCl↓ + NaNO3 AgCl + 2NH3 • H2O → [Ag(NH3)2]Cl + 2H2O AgCl + (NH4)2СO3 → [Ag(NH3)2]Cl + СO2↑ + H2O AgCl + 2Na2S2O3 → Na3[Ag(S2O3)2] + NaCl](https://prezentacii.org/upload/cloud/18/12/111038/images/thumbs/screen30.jpg)
![качественная реакция на бромид-ион: NaBr + AgNO3 → AgBr↓ + NaNO3 AgBr + 2NH3 • H2O → [Ag(NH3)2]Br + 2H2O AgBr + (NH4)2СO3 ≠ AgBr + 2Na2S2O3 → Na3[Ag(S2O3)2] + NaBr качественная реакция на бромид-ион: NaBr + AgNO3 → AgBr↓ + NaNO3 AgBr + 2NH3 • H2O → [Ag(NH3)2]Br + 2H2O AgBr + (NH4)2СO3 ≠ AgBr + 2Na2S2O3 → Na3[Ag(S2O3)2] + NaBr](https://prezentacii.org/upload/cloud/18/12/111038/images/thumbs/screen31.jpg)
![качественная реакция на иодид-ион: NaI + AgNO3 → AgI↓ + NaNO3 AgI + 2NH3 • H2O ≠ AgI + (NH4)2СO3 ≠ AgI + 2Na2S2O3 → Na3[Ag(S2O3)2] + NaI качественная реакция на иодид-ион: NaI + AgNO3 → AgI↓ + NaNO3 AgI + 2NH3 • H2O ≠ AgI + (NH4)2СO3 ≠ AgI + 2Na2S2O3 → Na3[Ag(S2O3)2] + NaI](https://prezentacii.org/upload/cloud/18/12/111038/images/thumbs/screen32.jpg)





![Au + НNО3(конц) + 4НСl(конц) = H[AuCl4] + NO + 2H2О; 2Au + 3Сl2 = 2AuCl3 (130°С) Au + НNО3(конц) + 4НСl(конц) = H[AuCl4] + NO + 2H2О; 2Au + 3Сl2 = 2AuCl3 (130°С)](https://prezentacii.org/upload/cloud/18/12/111038/images/thumbs/screen38.jpg)
![Оксид и гидроксид золота (III) нерастворимы в воде, проявляют амфотерные свойства: Au(OH)3 + 3HCl = AuCl3 + 3H2O Au(OH)3 + 4HNO3 = H[Au(NO3)4] + 3H2O Au(OH)3 + NaOH = Na[Au(OH)4] - гидроксоаурат (III) Оксид и гидроксид золота (III) нерастворимы в воде, проявляют амфотерные свойства: Au(OH)3 + 3HCl = AuCl3 + 3H2O Au(OH)3 + 4HNO3 = H[Au(NO3)4] + 3H2O Au(OH)3 + NaOH = Na[Au(OH)4] - гидроксоаурат (III)](https://prezentacii.org/upload/cloud/18/12/111038/images/thumbs/screen39.jpg)
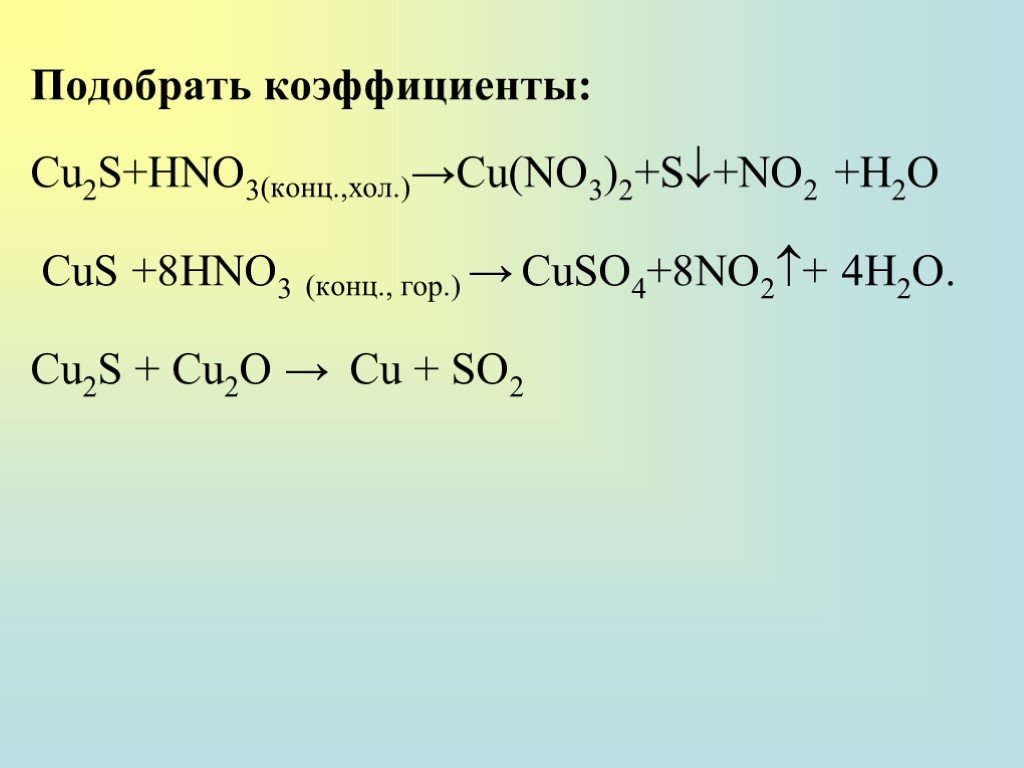
![Соединения Au (III) проявляют окислительные свойства: Подобрать коэффициенты: AuCl3 + H2O2 (конц.) → Au (коллоид) +O2 + HCl H[AuCl4] +SO2+H2O →H[AuCl2]+H2SO4 + HCl Соединения Au (III) проявляют окислительные свойства: Подобрать коэффициенты: AuCl3 + H2O2 (конц.) → Au (коллоид) +O2 + HCl H[AuCl4] +SO2+H2O →H[AuCl2]+H2SO4 + HCl](https://prezentacii.org/upload/cloud/18/12/111038/images/thumbs/screen40.jpg)