Презентация "Алкины" по химии – проект, доклад
Презентацию на тему "Алкины" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 19 слайд(ов).
Слайды презентации
Список похожих презентаций
Класс Алкины
Содержание. Ацетиленовые углеводороды Номенклатура Изомерия Физические свойства Получение Строение ацетилена Химические свойства (гидрирование, галогенирование, ...Алкины
Алкины. Алкины — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна тройная связь. СnН2n-2. Строение ...Алкины и их свойства
Непредельные углеводороды с тройной связью С=С в молекулах. Простейший представитель ряда – ацетилен С2Н2, общая формула СnH2n-2 (n>2). Атомы углерода ...Алкины
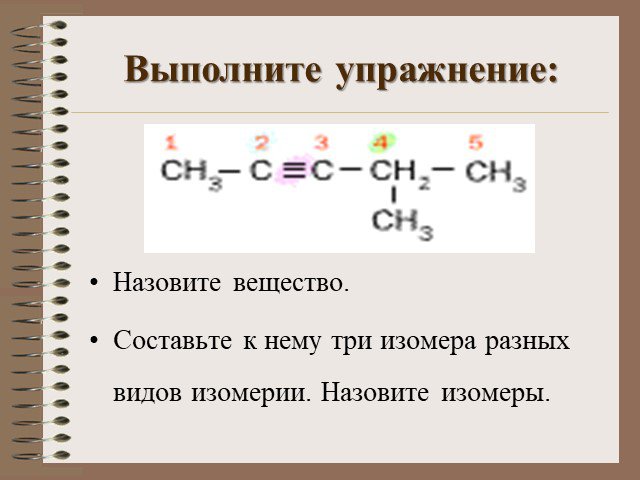
алкин НС СН Н3С С СН. Общая формула алкинов. CnH2n-2. Номенклатура алкинов. Дайте названия углеводородам:. Н3С С С СН3 Этин Бутин - 2 Пропин. Строение ...Алкины
План 1.Повторение пройденного: а)Рассказ о строении и свойствах алкенов по плану упр.2. б)Решение задачи: Рассчитать объем этилена, полученный дегидрированием ...Алкины
АЛКИНЫ. Студент должен: знать стоение, номенклатуру, свойства, способы получения и применения алкинов умень составлять названия и химические уравнения ...Алкины
Ацетиленовые углеводороды. Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну ...Алканы, Алкены, Алкины
АЛКАНЫ. Получение, нахождение в природе и применение алканов. ВПЕРЕД НАЗАД. Газообразные алканы получают из природного и попутного нефтяных газов; ...Конспекты
Алкины
Муниципальное бюджетное общеобразовательное учреждение. Средняя общеобразовательная школа №6. Тема:. «Алкины». 10 класс. Ханты-Мансийский ...Непредельные углеводороды. Алкины
"Непредельные углеводороды. Алкины". (урок химии в 10 классе, учитель химии Артамонова О.А. МБОУ СОШ №12 г.Камышин, Волгоградской обл.). Цель ...Алкины
Открытый урок в 10 классе по теме «Алкины». Составил учитель химии 1 квалификационной категории Шуклина Оксана Валерьевна, МБОУ СОШ № 4, г. Можги ...Алкины
5. . . Разработка открытого урока. . по химии в 11 классе МОУ СОШ № 65. Красноармейского района Волгограда. Учитель: Недожогина Е.С. ...Алкины
5. . . Разработка открытого урока. . по химии в 10 классе. . Тема урока: «Алкины». Цели: образовательные:. в сказочно – игровой форме ...Алкины
Урок:. . Тема урока: Алкины. Цели урока:. 1. Расширить знания учащихся о непредельных углеводородах-. познакомить с ацетиленом и его гомологами. ...Алканы, Алкены, Алкины
Урок химии: обобщение знаний по темам «Алканы»,. . «Алкены, «Алкины». Викторова Екатерина Петровна. ГБОУ СОШ с. Новокуровка. Учитель химии ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 января 2015
Категория:Химия
Содержит:19 слайд(ов)
Поделись с друзьями:
Скачать презентацию































![2. Гидрогалогенирование. 3. Гидрирование. 4. Гидратация. HgSO4 НCCH + H2O [HC=CH] CH3CH H OH O 2. Гидрогалогенирование. 3. Гидрирование. 4. Гидратация. HgSO4 НCCH + H2O [HC=CH] CH3CH H OH O](https://prezentacii.org/upload/cloud/15/01/12483/images/thumbs/screen14.jpg)
![Окисление. Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот: RCCR’ + 3[O] + H2O RCOOH + R’COOH Алкины обесцвечивают раствор KMnO4, что используется для их качественного определения. Окисление. Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот: RCCR’ + 3[O] + H2O RCOOH + R’COOH Алкины обесцвечивают раствор KMnO4, что используется для их качественного определения.](https://prezentacii.org/upload/cloud/15/01/12483/images/thumbs/screen15.jpg)

![Реакции замещения. При взаимодействии ацетилена (или RCCH) с аммиачными растворами оксида серебра выпадают осадки нерастворимых ацетиленидов: HCCH + 2[Ag(NH3)2]OH AgCCAg + 4NH3 + 2H2O. Качественная реакция на концевую тройную связь Реакции замещения. При взаимодействии ацетилена (или RCCH) с аммиачными растворами оксида серебра выпадают осадки нерастворимых ацетиленидов: HCCH + 2[Ag(NH3)2]OH AgCCAg + 4NH3 + 2H2O. Качественная реакция на концевую тройную связь](https://prezentacii.org/upload/cloud/15/01/12483/images/thumbs/screen17.jpg)