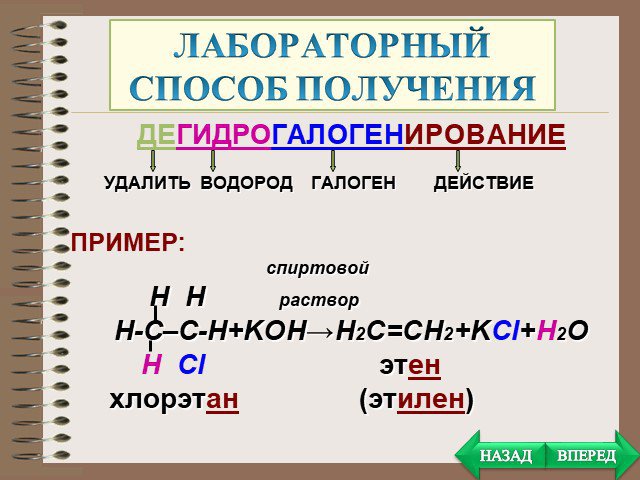
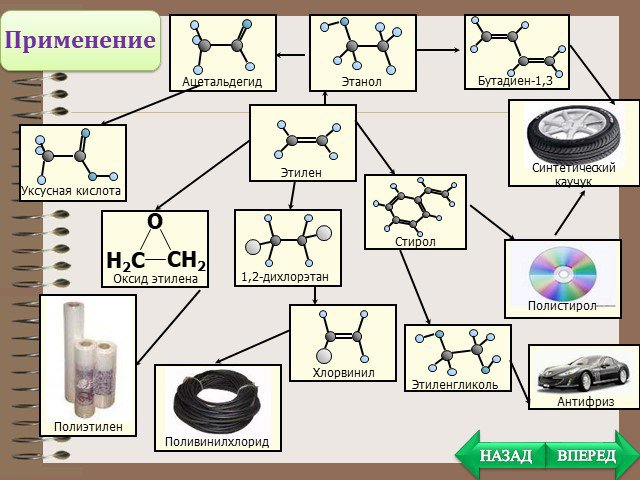
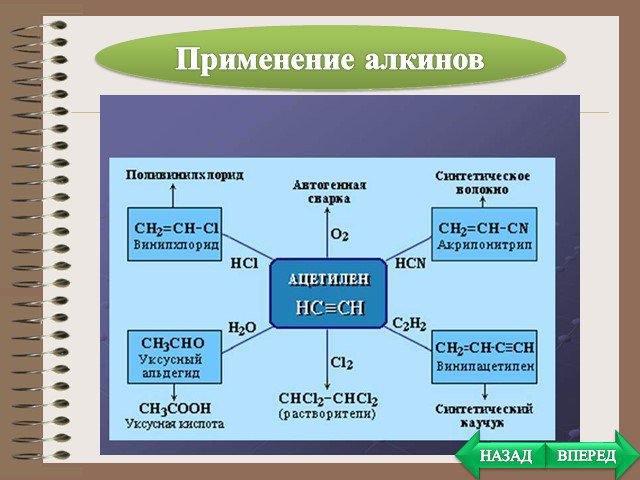
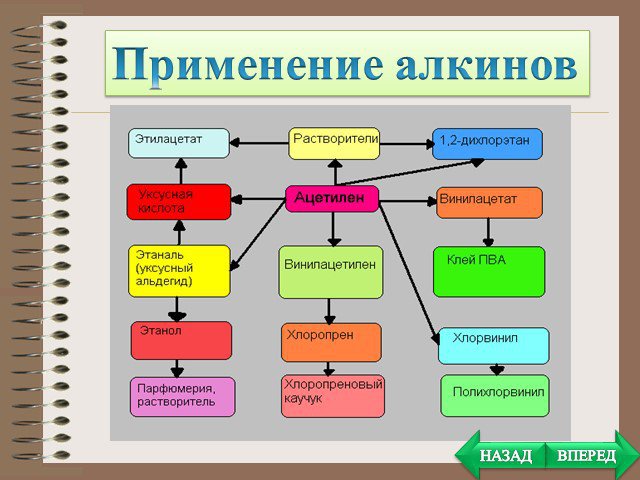
Презентация "Алканы, Алкены, Алкины" (10 класс) по химии – проект, доклад
Презентацию на тему "Алканы, Алкены, Алкины" (10 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 34 слайд(ов).
Слайды презентации
Список похожих презентаций
Алканы, алкены, алкины: строение, изомерия и номенклатура
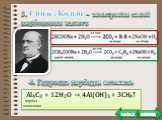
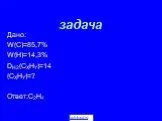
Задача. Установите формулу углеводорода с одной кратной связью, если массовая доля углерода составляет 88,24%. Относительная плотность этого вещества ...Алканы и алкены
Вопрос №1. Атомы каких химических элементов входят в состав углеводородов: 1) углерод и кислород 2) кислород и водород 3) водород и углерод 4) углерод, ...Алкины
План 1.Повторение пройденного: а)Рассказ о строении и свойствах алкенов по плану упр.2. б)Решение задачи: Рассчитать объем этилена, полученный дегидрированием ...Алкины
Сегодня на уроке вы узнаете:. Понятие о непредельных углеводородах. Характеристика тройной связи. Изомерия и номенклатура алкинов. Физические свойства. ...Алкины
АЛКИНЫ. Студент должен: знать стоение, номенклатуру, свойства, способы получения и применения алкинов умень составлять названия и химические уравнения ...Алканы
Цель: эффективно повторить и обобщить знания, устранить отставание учащихся по теме «Алканы». Задачи : Повторить теорию; Выполнить упражнения в режиме ...Непредельные углеводороды. Алкены
Непредельные – углеводороды, содержащие между атомами углерода одну или несколько π- связей. Непредельные углеводороды. Алкены С=С Алкины С≡ С Алкадиены ...Класс Алкины
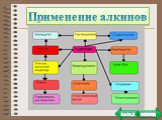
Содержание. Ацетиленовые углеводороды Номенклатура Изомерия Физические свойства Получение Строение ацетилена Химические свойства (гидрирование, галогенирование, ...Алкины и их свойства
Непредельные углеводороды с тройной связью С=С в молекулах. Простейший представитель ряда – ацетилен С2Н2, общая формула СnH2n-2 (n>2). Атомы углерода ...Алкены
Алкены. Студент должен: знать стоение, номенклатуру, свойства, способы получения и применения алкенов умень составлять названия и химические уравнения ...Алкены
Часть 1. А 1. К непредельным углеводородам относят органические соединения в которых А) одна кратная связь Б) несколько кратных связей В) тройная ...Алканы CnH2n+2
Алканы – углеводороды с общей формулой CnH2n+2 , которые не присоединяют водород и другие элементы. Все связи в молекулах алканов одинарные. Перекрывание ...Алканы
Вспомните, какие вещества мы называем углеводородами? УГЛЕВОДОРОДЫ – это органические соединения, состоящие из двух химических элементов – УГЛЕРОДА ...Алканы
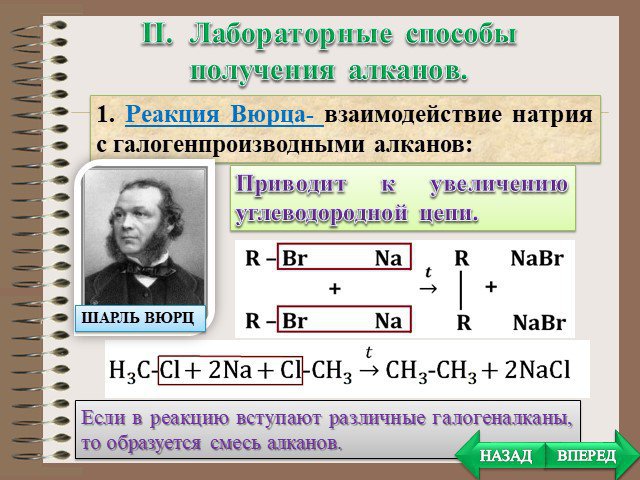
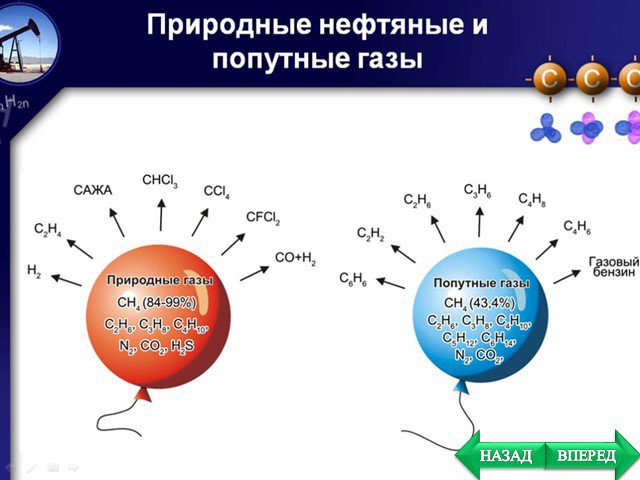
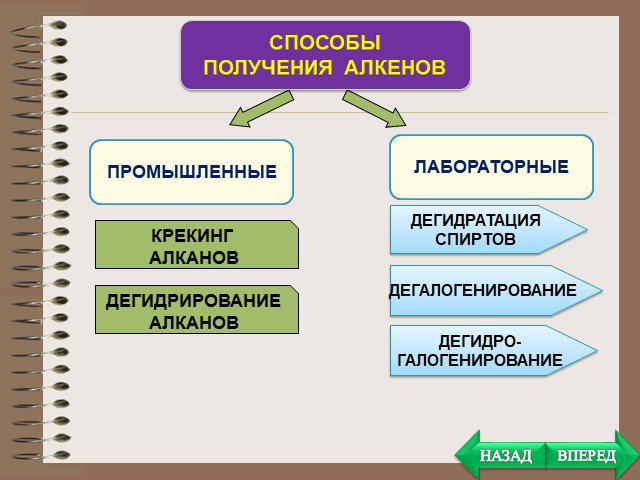
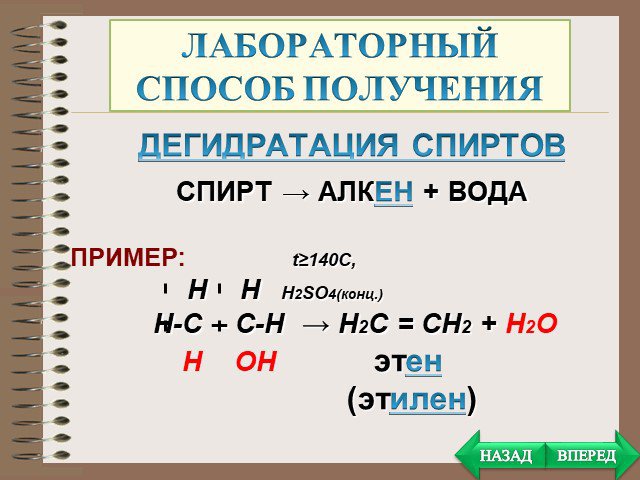
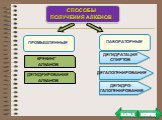
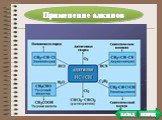
План. Химические свойства Получение Применение. Особенности химических свойств предельных углеводородов. Так как алканы - насыщеные углеводороды, ...Алкины
алкин НС СН Н3С С СН. Общая формула алкинов. CnH2n-2. Номенклатура алкинов. Дайте названия углеводородам:. Н3С С С СН3 Этин Бутин - 2 Пропин. Строение ...Алкены
Строение молекулы этилена, как одного из представителей алкенов. Изомерия и гомологический ряд алкенов. Изомерия углеродного скелета: CH2=CH-CH2-CH3 ...Алкины
Алкины. Алкины — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна тройная связь. СnН2n-2. Строение ...Алкены
Содержание. Алкены Номенклатура Изомерия Физические свойства Строение алкенов Химические свойства (реакции присоединения: галогенирование, гидрирование, ...Класс Алкены
Тема урока: Непредельные углеводороды. Этилен Строение Получение Свойства Применение. Девиз урока: Все познается в сравнении. Цели и задачи урока. ...Алкены
09.01.2018 Кузнецова О.Н. Строение молекулы. CnH2n. Химические свойства. Изомерия. Физические свойства. Проверка знаний Получение Номенклатура Применение. ...Конспекты
Алканы, Алкены, Алкины
Урок химии: обобщение знаний по темам «Алканы»,. . «Алкены, «Алкины». Викторова Екатерина Петровна. ГБОУ СОШ с. Новокуровка. Учитель химии ...Непредельные углеводороды. Алкены
Базовый лист контроля на примере темы : «Непредельные углеводороды. Алкены». На первом же уроке новой темы учитель вывешивает «Базовый лист контроля». ...Непредельные углеводороды. Алкены
Преподаватель химии. Катаркольского Сельскохозяйственного. . Колледжа Бурабайского района. Иманкулова Алмагуль Толегеновна. (1 категория, ...Алкины
Муниципальное бюджетное общеобразовательное учреждение. Средняя общеобразовательная школа №6. Тема:. «Алкины». 10 класс. Ханты-Мансийский ...Алкины
Открытый урок в 10 классе по теме «Алкины». Составил учитель химии 1 квалификационной категории Шуклина Оксана Валерьевна, МБОУ СОШ № 4, г. Можги ...Алкины
5. . . Разработка открытого урока. . по химии в 11 классе МОУ СОШ № 65. Красноармейского района Волгограда. Учитель: Недожогина Е.С. ...Алкины
5. . . Разработка открытого урока. . по химии в 10 классе. . Тема урока: «Алкины». Цели: образовательные:. в сказочно – игровой форме ...Алканы
МБОУ СОШ № 18. Конспект урока по химии. . на тему : «. Алканы. ». Составила. учитель химии. Иванинская Зоя Николаевна. ...Алкены :состав, строение ,номенклатура , изомерия ,физические свойства
Алкены :состав, строение ,номенклатура ,. изомерия ,физические свойства. Девиз: Величие человека в его способности мыслить. Цель урока :. познакомить ...Алкены
Муниципальное общеобразовательное учреждение. лицей № 9. имени заслуженного учителя школы Российской Федерации А.Н.Неверова Дзержинского района ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:19 декабря 2016
Категория:Химия
Классы:
Содержит:34 слайд(ов)
Поделись с друзьями:
Скачать презентацию