Презентация "Характеристика элементов VII группы главной подгруппы. Хлор" по химии – проект, доклад
Презентацию на тему "Характеристика элементов VII группы главной подгруппы. Хлор" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 36 слайд(ов).
Слайды презентации
Список похожих презентаций
Общая характеристика элементов главной подгруппы VI группы (подгруппы кислорода)
Строение атома. КИСЛОРОД. Кислород O2 (К.В. Шееле 1772 г., Дж. Пристли 1774 г.) Самый распространенный элемент на Земле; в воздухе - 21% по объему; ...Общая характеристика элементов подгруппы кислорода
ПАМЯТКА К ИЗУЧЕНИЮ ПОДГРУППЫ ЭЛЕМЕНТОВ. 1.Пользуясь Периодической системой, выпишите символы и названия химических элементов, относящихся к данной ...Соединения Ca и Mg, представителей элементов II группы главной подгруппы
План урока. Проверка домашнего задания. 2. Знакомство с соединениями металлов главной подгруппы второй группы. 3. Л/р «Изучение коллекции соединений ...Щелочные металлы - элементы I группы главной подгруппы
Li Na K Rb Cs Fr. Физические свойства щелочных металлов:. Серебристого цвета Мягкие, легко режутся ножом Твердость от Li → Na → K → Rb → Cs → Fr уменьшается: ...Элементы главной подгруппы V группы
Фосфор и здоровье человека. Содержание фосфора в организме человека (масса тела 70 кг) составляет 780 г. Суточная доза для взрослых 1 г. Бирюза(минерал ...Общая характеристика элементов VA-группы. Азот
Элементы VA-группы. Элементы VА-группы. Общая электронная формула: […] ns 2 (n–1)d 10np 3. Степени окисления: –III, 0, +III, +V. Валентные возможности: ...Общая характеристика подгруппы углерода
Сравнительная характеристика элементов IV группы главной подгруппы. 2s22p2 3s23p2 4s24p2 5s25p2 6s26p2 C Si Ge Sn Pb 73 119 )) ))))) ))) )))))) ))))))) ...Железо элемент побочной подгруппы
Цель:. 1. Вводная тема для формирования и развития познавательного интереса к материалу. 2. Осознания учащимися исторического значения освоения железа ...Характеристика химических элементов и их соединений на основе положения элементов в периодической системе.
Цель урока? Химический элемент. Семейство Щелочные Ме Халькогены Период Группы Изотопы Валентность Д.И.Менделеев. Горячий стул. Химический диктант ...Периодический закон. Периоды Периодическая система химических элементов Д.И. Менделеева. Группы
Периодический закон. Свойства химических элементов, а также образуемых ими простых и сложных веществ находится в периодической зависимости от относительных ...Железо – элемент побочной подгруппы
Общая характеристика железа. Нахождение в природе. Fe ХАЛЬКОПИРИТ ПИРИТ ЧЁРНЫЙ ПИРИТ ГЕМАТИТ. 1s2 2s2 2p6 3s2 3p6. Краткая электронная формула. Валентные ...Характеристика АХОВ и их поражающие факторы
Разработать классификацию АХОВ по характеру воздействия на человека. повторение. Какие вещества относятся к АХОВ? Химические вещества или соединения, ...Строение атома и периодическая система химических элементов
Е 1s 3s 4s 3p 4p 3d n = 1 n = 2 n = 3 n = 4. Энергетическая диаграмма АО для многоэлектронных атомов. Многоэлектронные атомы. 1s. Порядок заполнения ...Соединения химических элементов
Конфуций сказал:. «Учиться, а время от времени повторять изученное, разве неприятно?». Задание 1.Выписать оксиды и распределить их в два столбика: ...Путешествие по Периодической системе химических элементов
Загадки Ребусы Шарады. Он и легок и пластичен, С блеском серебристым, Но снаружи никогда не бывает чистым. Мы найдем его на кухне, И на стройке, и ...Хлор
Хлор (Cl) - элемент VII A группы. История открытия. Впервые хлор был получен в 1772 г. Шееле: 4HCl + MnO2 = Cl2 + MnCl2 + 2H2O. Однако Шееле предположил, ...Знаки химических элементов
Водород Н Гидрогениум Аш. Ртуть Hg. Гидраргерум Гидраргерум. Углерод С Карбониум Цэ. Хлор Cl Хлорум Хлор. Медь Сu Купрум Купрум. Хром Cr Хромиум Хром. ...Знаки химических элементов
Другого ничего в природе нет ни здесь, ни там, в космических глубинах: все — от песчинок малых до планет — из элементов состоит единых. Как формула, ...Массовая доля элементов в веществе
05/12/18. -Ar химических элементов. Al Ba Ca Na K Cl S F Pb Cu Hg H O C B Br Zn Ag Au N Si Fe I Проверка знаний:. 1. Что такое относительная атомная ...Ниобий и тантал. Свойства элементов и их соединений
Общая характеристика Nb и Ta. Основные физичекие характеристики элементов:. Серый металл, мягкий, пластичный (хруп- кий в присутствии ТаН), тугоплавкий, ...Конспекты
Общая характеристика элементов главной подгруппы VI группы. Кислород и сера.Важнейшие соединения: оксиды, кислоты и их соли
Класс: 10 , учитель: Султанова Е.А. СШ № 17 , г. Балхаш, химия. Тип урока:. комбинированный,. язык обучения. : русский. Оборудование:. флипчарт, ...Общая характеристика элементов 1 группы, главной подгруппы
№. п/п. . Структурные элементы. . . . . Дата. . . 08.10.2014г. . . . Класс. . 9. . . . . Тема урока. . ...Характеристика металлов II группы главной подгруппы
Тема урока:. . Характеристика металлов. II. группы главной подгруппы. Цель урока: дать характеристику металлов II. группы главной подгруппы. ...Периодический закон и периодическая система химических элементов Д.И. Менднлеева. Группы и периоды
План-конспект урока химии (8 класс) по теме: "Периодический закон и периодическая система химических элементов Д.И. Менднлеева. Группы и периоды.". ...Характеристика элемента по его положению в периодической системе химических элементов Д.И. Менделеева
1001 идея интересного занятия с детьми. . ПРИМЕНЕНИЕ ТЕХНОЛОГИЙ КРИТИЧЕСКОГО МЫШЛЕНИЯ НА УРОКАХ ХИМИИИ. Бурдакова Кристина Олеговна, МБОУ СОШ ...Галогены. Общая характристика неметаллов. Элементы VII А группы. Неорганические вещества и охрана окружающей среды
План учебного занятия № 16. Дата Предмет. химия. группа. Ф.И.О. преподавателя:. Кайырбекова И.А. . І. Тема занятия:. Галогены. Общая характристика ...Общая характеристика галогенов. Хлор
Тема:. Общая характеристика галогенов. Хлор. Цели:. Развивать. знания о семействе галогенов на примере хлора и его соединений, изучить строение ...Современная формулировка периодического закона и современное состояние периодической системы химических элементов Д. И. Менделеева
Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Тема. . Современная формулировка периодического закона и современное ...Положение неметаллов в периодической системе химических элементов Д.И. Менделеева, строение их атомов, физические свойства. Аллотропия
Тема:Положение неметаллов в периодической системе химических элементов Д.И. Менделеева, строение их атомов, физические свойства. Аллотропия. Цели ...Положение кислорода и серы в периодической системе химических элементов, строение их атомов. Озон-аллотропная модификация кислорода
Технологическая карта урока. . . Учитель Дьячук Е.Ю. учитель химии МБОУ СОШ №1 г.Оха Сахалинская область. Предмет. химия. . Класс. . ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:24 мая 2019
Категория:Химия
Содержит:36 слайд(ов)
Поделись с друзьями:
Скачать презентацию















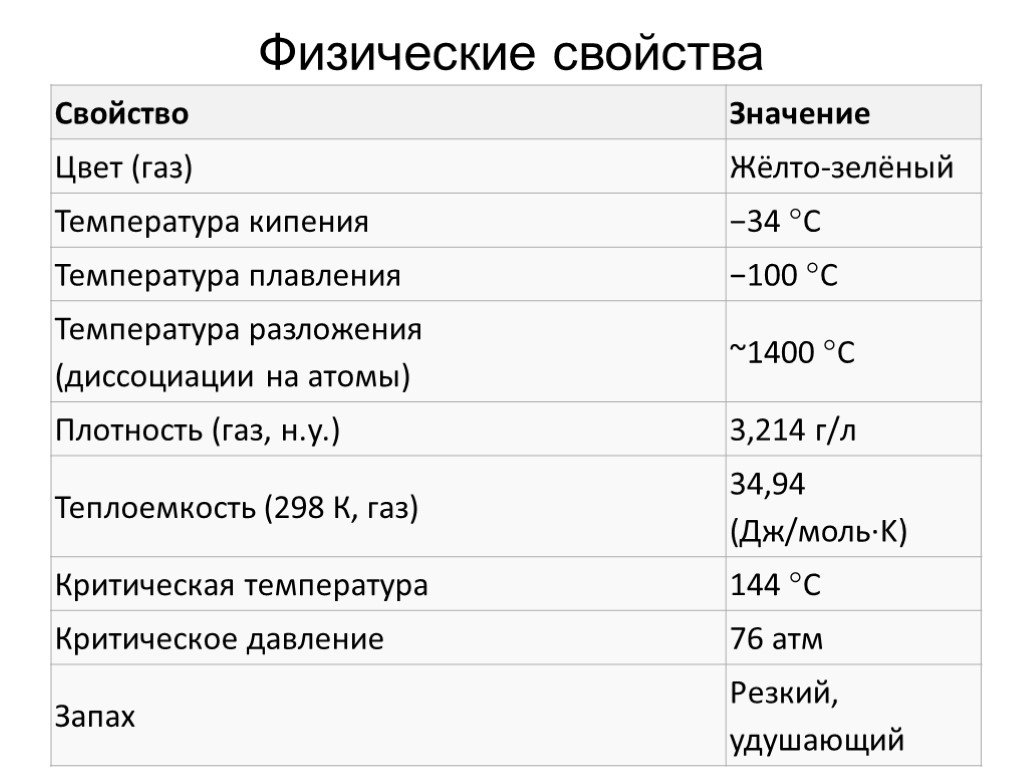
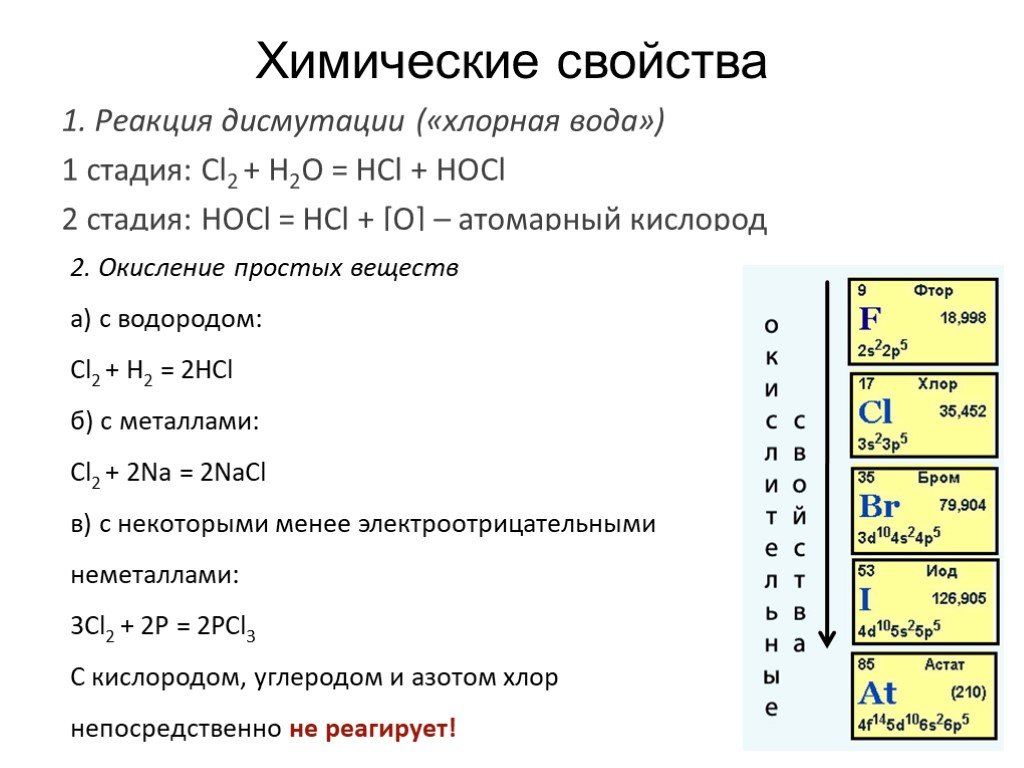









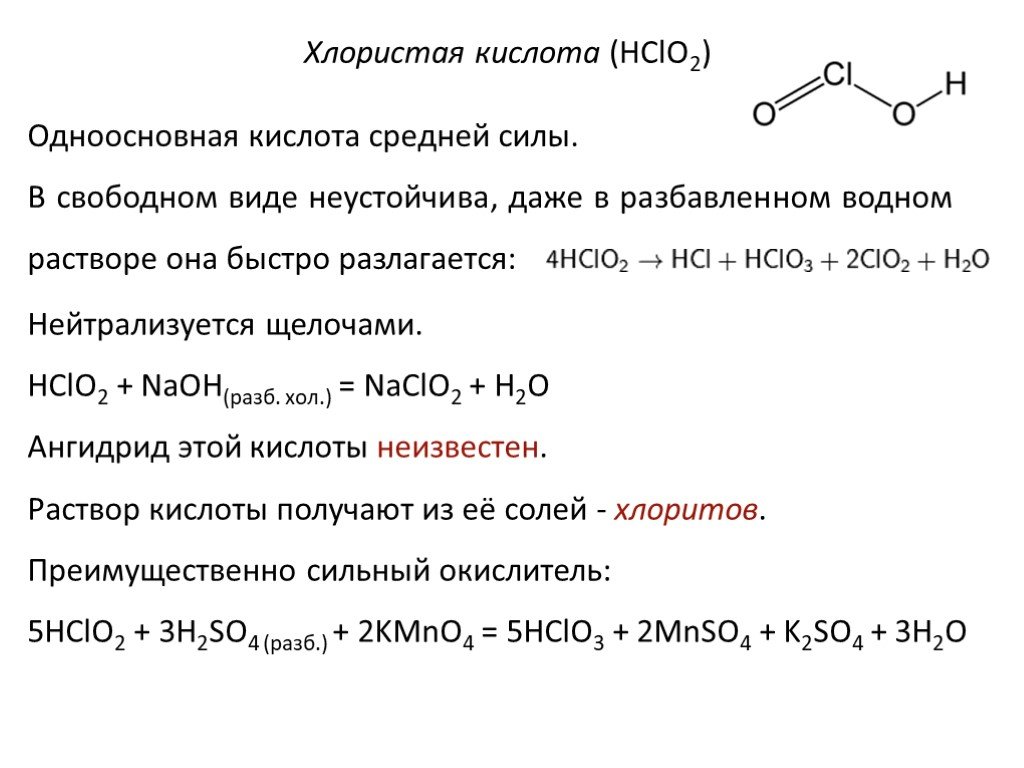
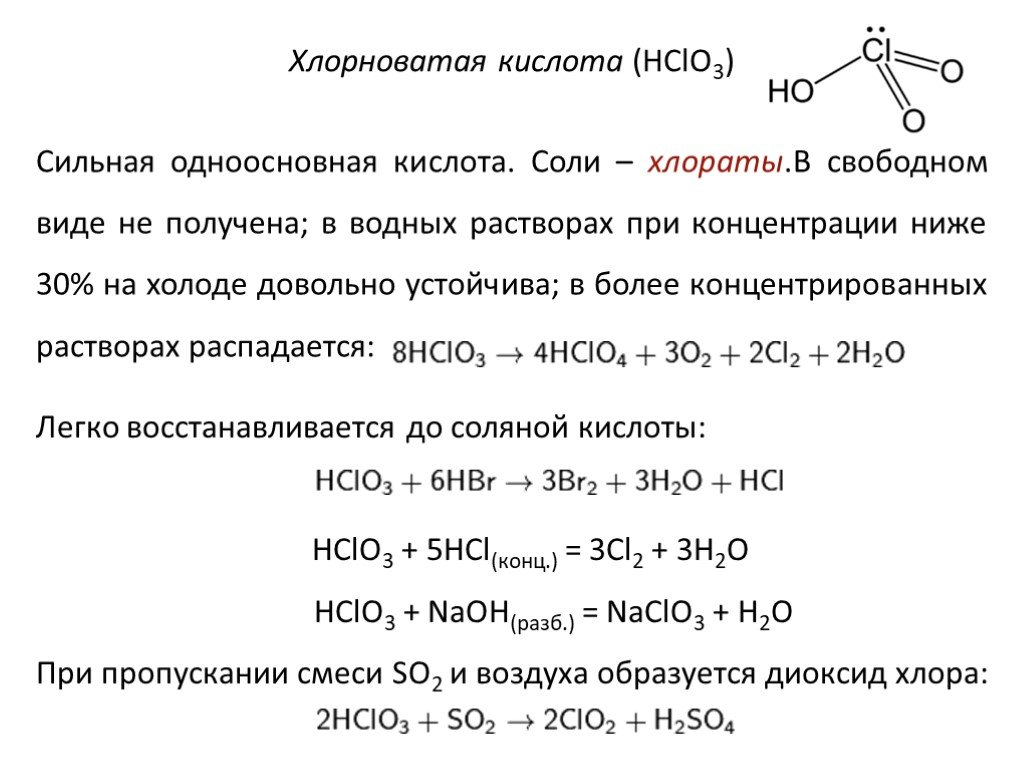



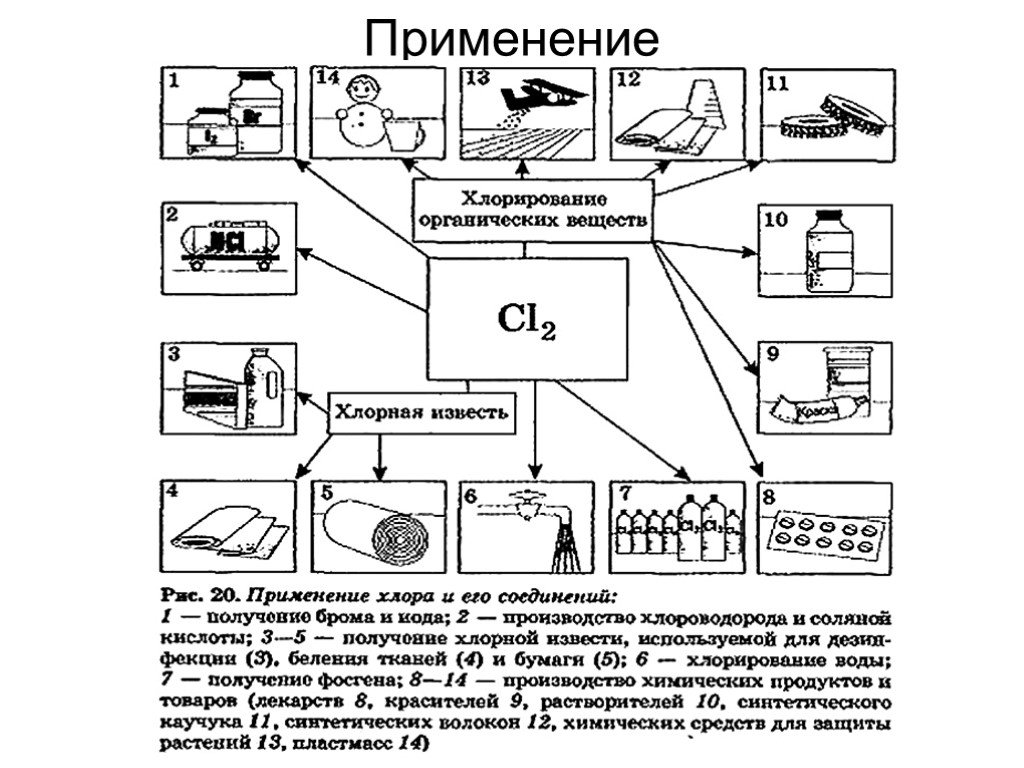


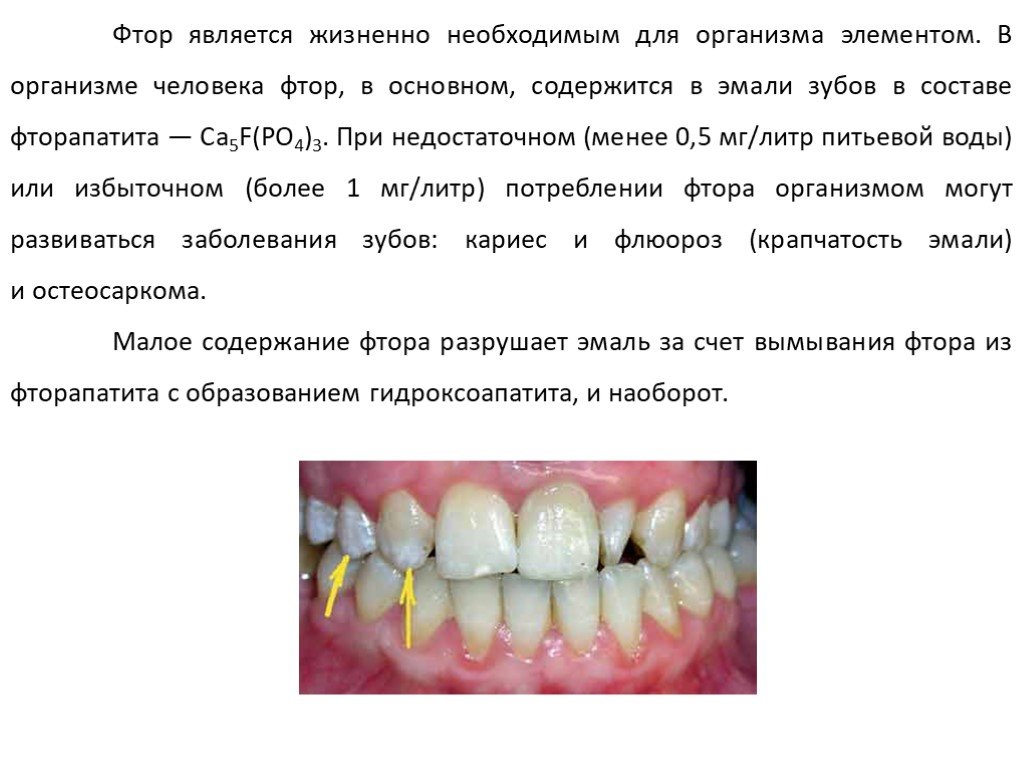















![Химические свойства. 1. Реакция дисмутации («хлорная вода») 1 стадия: Cl2 + H2O = HCl + HOCl 2 стадия: HOCl = HCl + [О] – атомарный кислород. 2. Окисление простых веществ a) с водородом: Cl2 + H2 = 2HCl б) с металлами: Cl2 + 2Na = 2NaCl в) с некоторыми менее электроотрицательными неметаллами: 3Cl2 + Химические свойства. 1. Реакция дисмутации («хлорная вода») 1 стадия: Cl2 + H2O = HCl + HOCl 2 стадия: HOCl = HCl + [О] – атомарный кислород. 2. Окисление простых веществ a) с водородом: Cl2 + H2 = 2HCl б) с металлами: Cl2 + 2Na = 2NaCl в) с некоторыми менее электроотрицательными неметаллами: 3Cl2 +](https://prezentacii.org/upload/cloud/19/05/10297/images/thumbs/screen16.jpg)



![Как окислитель реагирует: Mg + 2 HCl → MgCl2 + H2↑ Конц. соляная кислота реагирует с медью: 2 Cu + 4 HCl → 2 H[CuCl2] + H2↑ FeO + 2 HCl → FeCl2 + H2O При действии сильных окислителей или при электролизе хлороводород проявляет восстановительные свойства: MnO2 + 4 HCl → MnCl2 + Cl2↑ + 2 H2O При нагрев Как окислитель реагирует: Mg + 2 HCl → MgCl2 + H2↑ Конц. соляная кислота реагирует с медью: 2 Cu + 4 HCl → 2 H[CuCl2] + H2↑ FeO + 2 HCl → FeCl2 + H2O При действии сильных окислителей или при электролизе хлороводород проявляет восстановительные свойства: MnO2 + 4 HCl → MnCl2 + Cl2↑ + 2 H2O При нагрев](https://prezentacii.org/upload/cloud/19/05/10297/images/thumbs/screen20.jpg)
![Смесь 3v HCl : 1v HNO3 называется «царской водкой». Она способна растворять даже золото и платину. 4 H3O+ + 3 Cl− + NO3− = NOCl + Cl2 + 6 H2O Расстворение идет благодаря высокой концентрации хлорид-ионов : 3 Pt + 4 HNO3 + 18 HCl → 3 H2[PtCl6] + 4 NO↑ + 8 H2O Для хлороводорода также характерны реакци Смесь 3v HCl : 1v HNO3 называется «царской водкой». Она способна растворять даже золото и платину. 4 H3O+ + 3 Cl− + NO3− = NOCl + Cl2 + 6 H2O Расстворение идет благодаря высокой концентрации хлорид-ионов : 3 Pt + 4 HNO3 + 18 HCl → 3 H2[PtCl6] + 4 NO↑ + 8 H2O Для хлороводорода также характерны реакци](https://prezentacii.org/upload/cloud/19/05/10297/images/thumbs/screen21.jpg)