Презентация "Строение атомов" (11 класс) по химии – проект, доклад
Презентацию на тему "Строение атомов" (11 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 24 слайд(ов).
Слайды презентации
Список похожих презентаций
Строение атомов металлов
Домашнее задание. Параграф 8 По печатной тетради: На «3» - стр.7: № 6,9,10,11. стр.12: №4 На «4,5» - стр.8 №7,8; стр.11№16; стр.13 № 7(последний);стр.14 ...Электронное строение атомов элементов
Повторение. Число электронов в атоме элемента = числу протонов = заряду ядра атома = порядковому номеру элемента. Электроны в атомах располагаются ...Строение электронных оболочек атомов
Соотнесите химические формулы и формы существования химических элементов. 1) 2S 2) S8 3) 3H2O 4) Al2O3 5) 2Al 6) CuO. 1) свободные атомы 2) простые ...Строение молекулы аммиака
Строение молекулы аммиака. Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине; Атом азота образует с тремя атомами водорода ...Строение и функции белков
Элементарный состав белков. С (углерод) – 50-55%; О (кислород) – 21-24%; N (азот) – 15-17% (≈ 16%); Н (водород) – 6-8%; S (сера)– 0-2%. Азот - это ...Строение и свойства предельных и непредельных углеводородов
Разминка. I I Вариант. 1.Углеводороды, содержащие. только простые связи. 2.Вещесва, сходные по строению, но отличающие на одну или несколько групп ...Строение газообразных, жидких и твердых тел
Содержание:. Газы Газообразное состояние. Газы. Газ (газообразное состояние) (от нидерл. gas) — агрегатное состояние вещества, характеризующееся очень ...Гибридизация атомов углерода
1s sp3 – ГИБРИДИЗАЦИЯ. Электронная структура атома углерода. С – 1s22s22p2 С* – 1s22s12p3. Процессы выравнивания орбиталей по форме и энергии называют. ...Строение атомного ядра
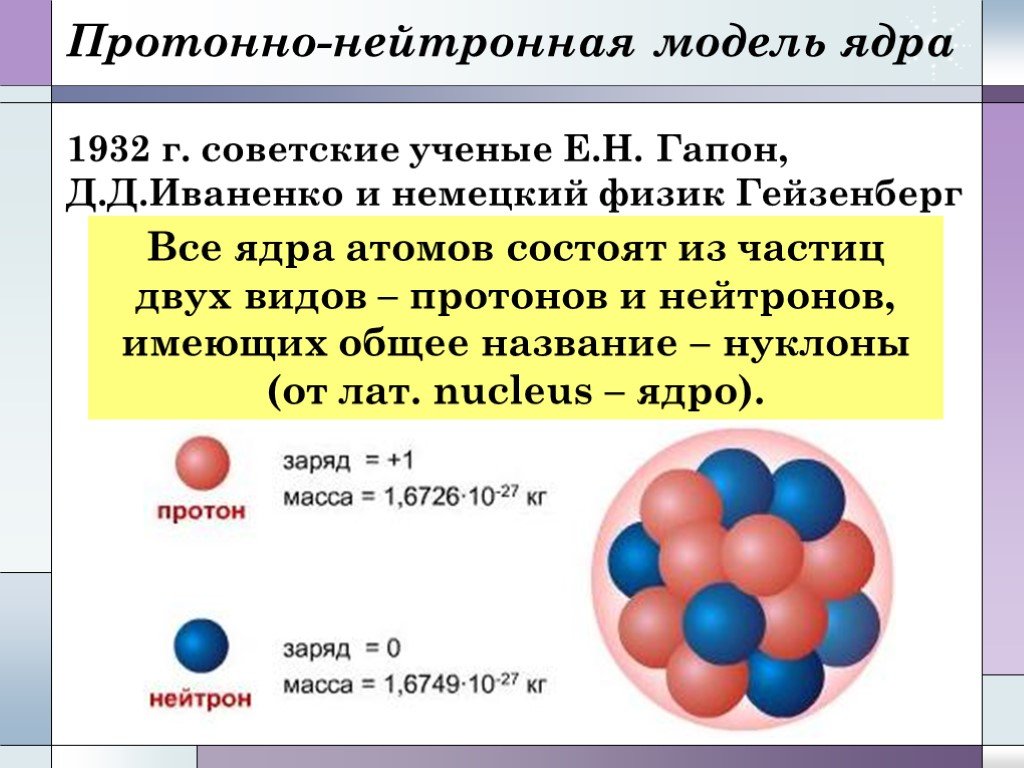
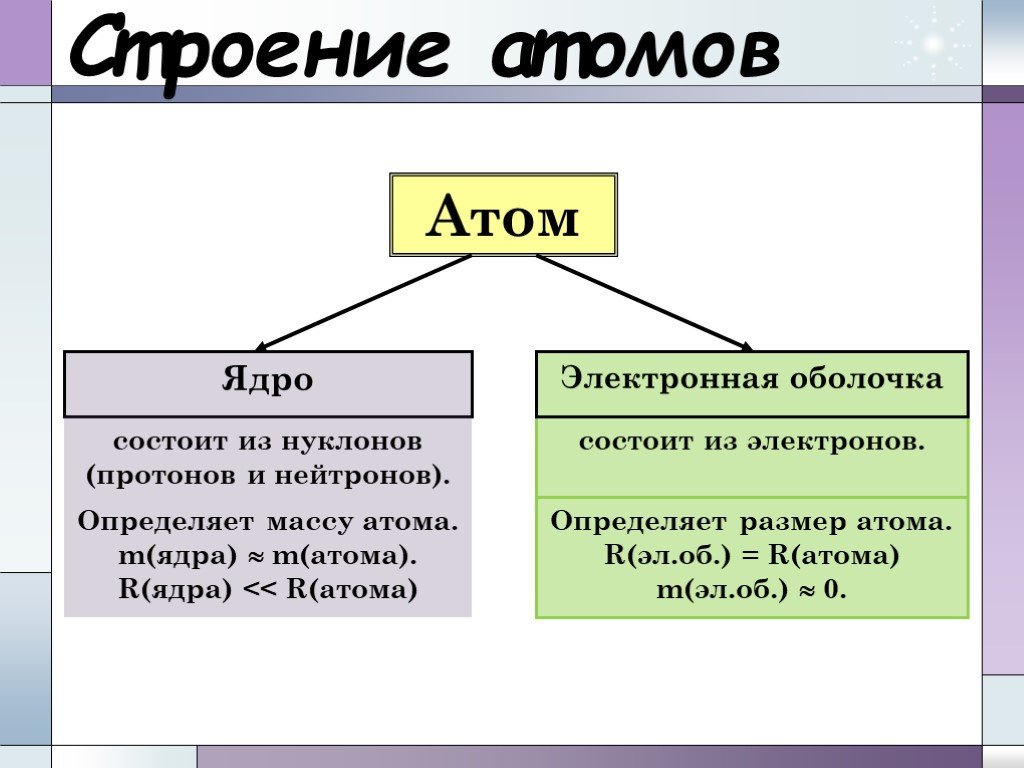
Ядро. Ядро представляет собой центральную часть атома (см. также АТОМА СТРОЕНИЕ). В нем сосредоточены положительный электрический заряд и основная ...Белки. Строение и свойства
Белки. Белки – это высокомолекулярные органические соединения, состоящие из остатков аминокислот представляющие собой биополимер, состоящий из мономеров, ...Строение атома
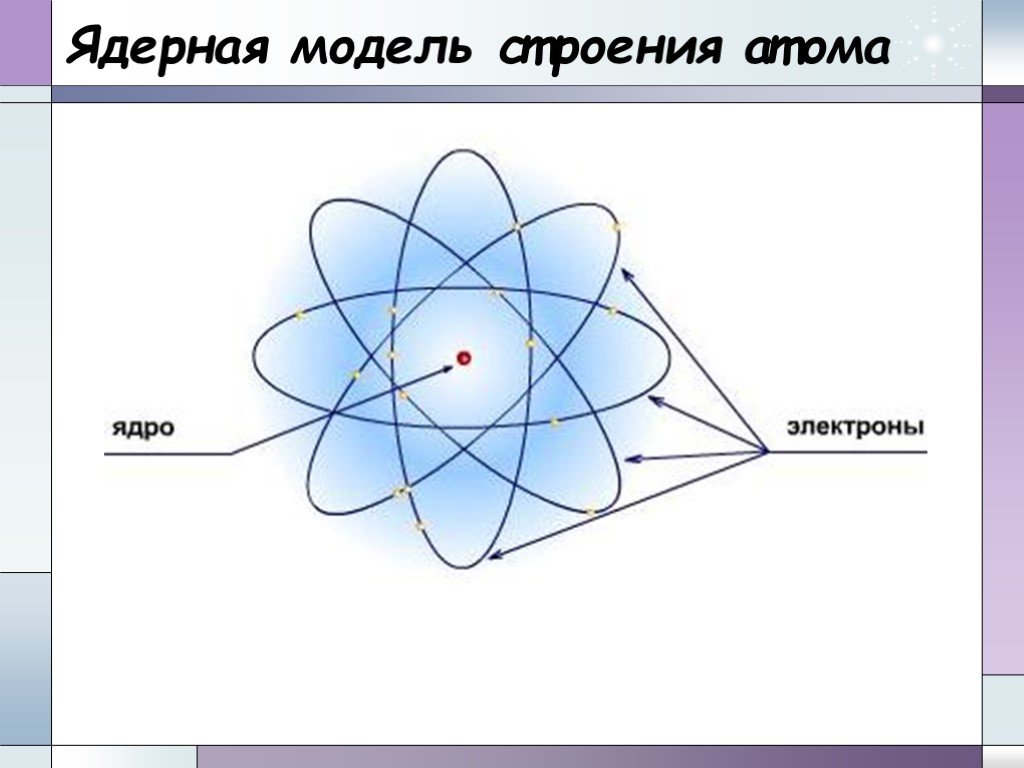
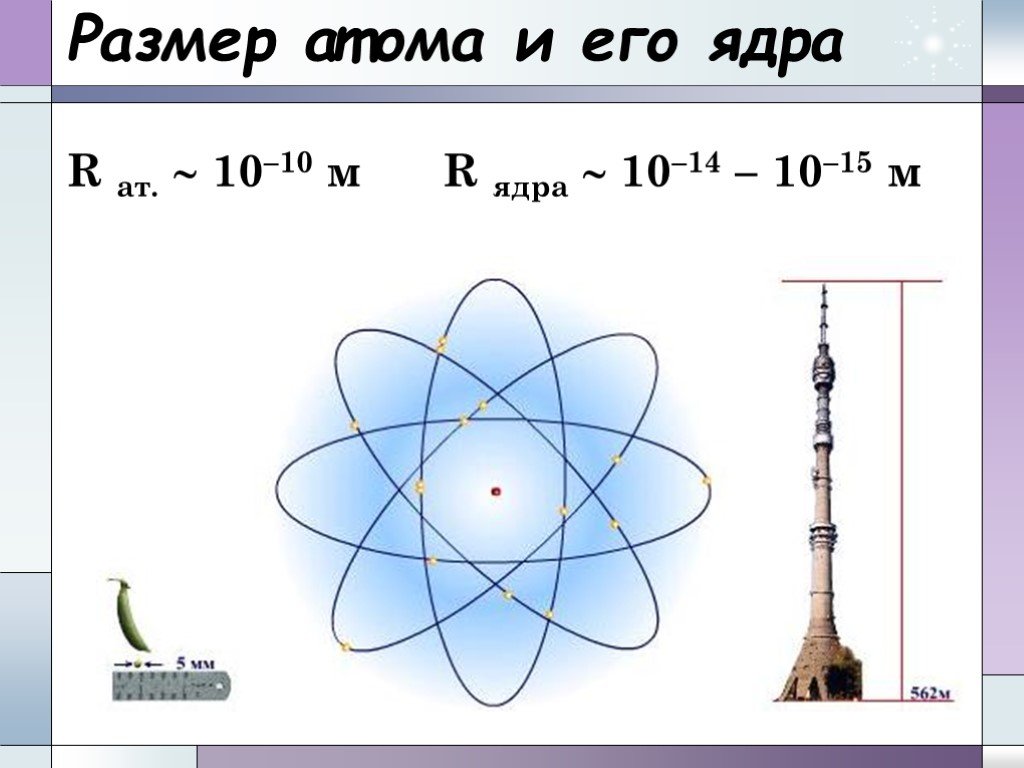
Планетарная модель атома. электрон +. Общий заряд атома равен 0. - 3. Сравнение размеров ядра и электрона. Распределение электронов по электронным ...Составление химических формул бинарных соединений по степени окисления атомов
Цель урока. Обучить учащихся составлению химических формул бинарных соединений по степеням окисления. 1. Что называется степенью окисления. 2. Чем ...Создание и использование комплекса моделей атомов и молекул для изучения строения вещества в курсе химии средней школы
Обзор содержания курса химии 8-11 классов. . . . Классификация моделей. Материальные Идеальные Статические Динамические Раздаточные Демонстрационные ...Сложные эфиры. Жиры Строение, получение, свойства
Сложные эфиры. При взаимодействии карбоновых кислот со спиртами (реакция этерификации) образуются сложные эфиры: O O R1- C + R2 – OH R1- C +2H2O O ...Положение металлов в таблице Д.И. Менделеева. Особенности строения атомов, свойства
Цель урока: 1. на основе положения металлов в ПСХЭ прийти к пониманию особенностей строения их атомов и кристаллов (металлической химической связи ...Подготовка к ЕГЭ "Строение атома"
Число электронов во внешнем электронном слое атома, ядро которого содержит 8 протонов, равно. 1) 8 2) 2 3) 6 4) 4. Число электронов в ионе железа ...Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома
ДЕВИЗ УРОКА:. Чтобы стать настоящим химиком, надо знать, уметь, думать!". ЭПИГРАФ УРОКА:. «… Другого ничего в природе нет, Ни здесь, ни там, в космических ...Строение органических соединений А.М. Бутлерова
Биография А.М.Бутлерова Теория химического строения органических веществ Предпосылки создания теории Теории до Бутлерова Основные положения теории ...Строение атома
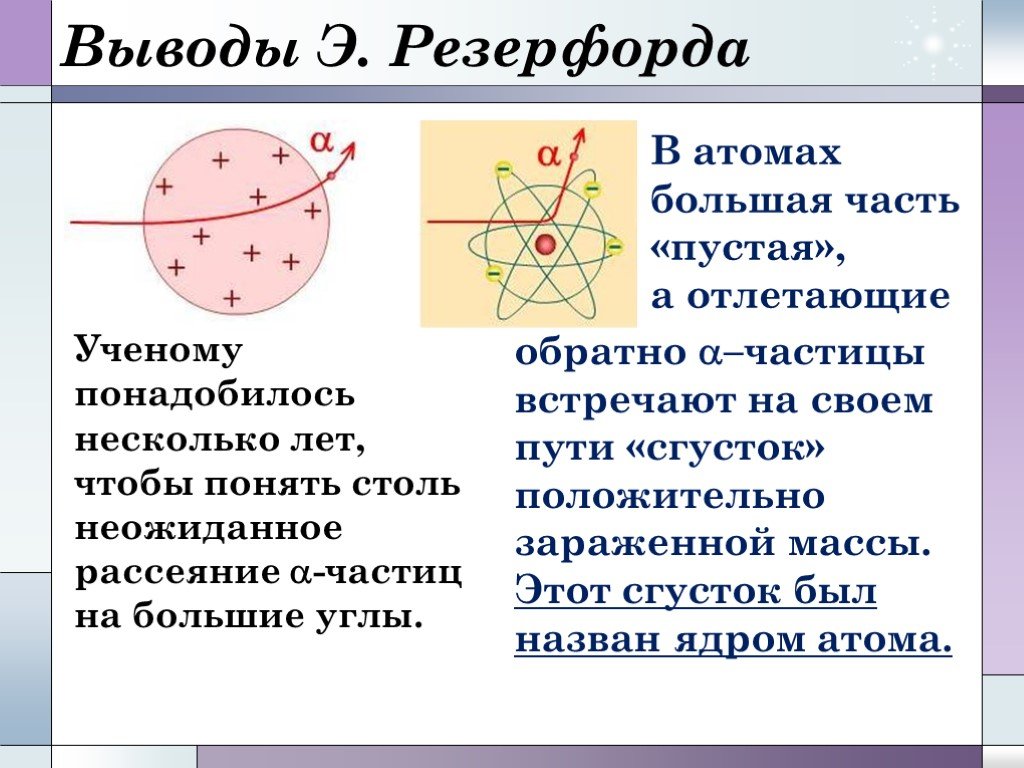
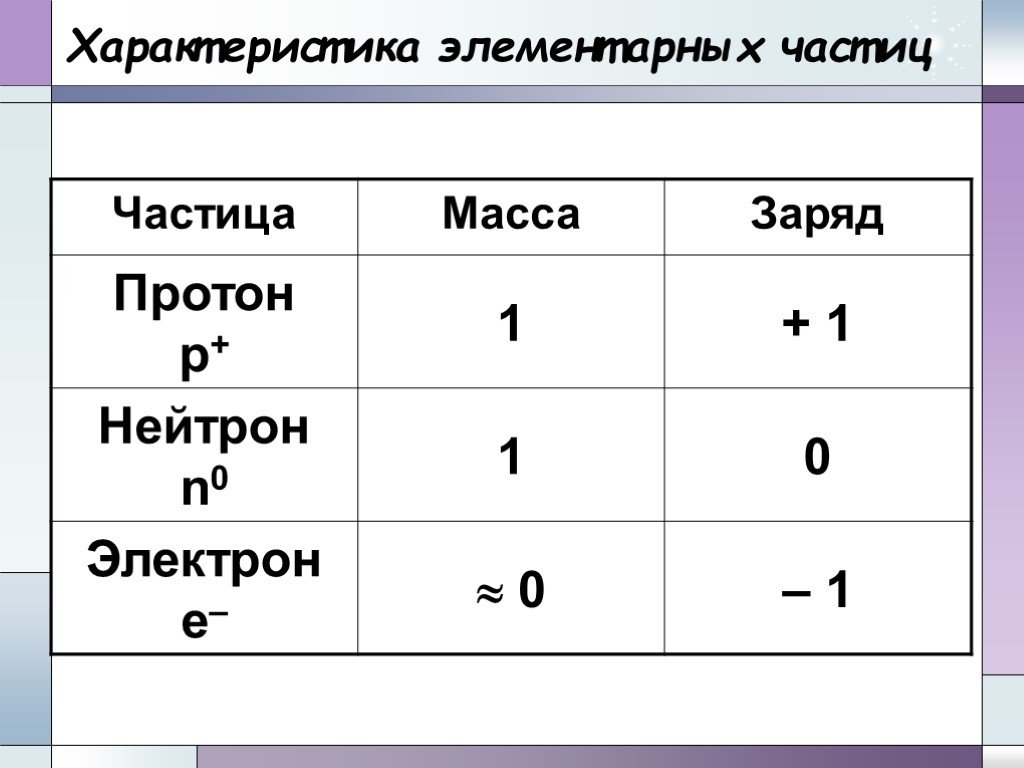
Химический элемент-это определенный вид атомов. Модель атома Резерфорда. протоны электроны нейтроны. Характеристики элементарных частиц. Количество ...Строение Бензола
Бензол С6Н6 – родоначальник ароматических углеводородов. Каждый из шести атомов углерода в его молекуле находится в состоянии sp2-гибридизации и связан ...Конспекты
Положение галогенов в Периодической таблице и строение их атомов
Урок химии по теме:. «Положение галогенов в Периодической таблице и строение их атомов. ». 8- класс. МОАУ СОШ №17 г.Белогорск. Печерица Наталья ...Положение неметаллов в периодической системе химических элементов Д.И. Менделеева, строение их атомов, физические свойства. Аллотропия
Тема:Положение неметаллов в периодической системе химических элементов Д.И. Менделеева, строение их атомов, физические свойства. Аллотропия. Цели ...Положение галогенов в периодической таблице Д.И. Менделеева и строение их атомов
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ. «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №39. ИМЕНИ П. Н. САМУСЕНКО». Положение ...Строение электронных оболочек атомов химических элементов
Областное государственное автономное общеобразовательное учреждение. «Центр образования «Ступени». план-конспект урока. Тема урок:. ...Строение атома. Электронные оболочки атомов
Урок повторение по теме:. «Строение атома. Электронные оболочки атомов». Учитель химии высшей категории Жансеитова Ф.М.,. . сш№ 9, г. Тараз. ...Строение атома
Тема урока: “Строение атома”. Тип урока:. урок ознакомления с новым материалом. . . Цель:. дать понятие о составе атома и составе атомного ядра; ...Строение атома
Урок по теме: «Строение атома». Задачи урока:. Образовательные. : сформировать представления о строении атома; дать понятие протон, электрон, ...Строение атома
Урок химии в 8 классе. Тема: «Строение атома». Цель урока:. формировать понятия -атом, орбиталь, изотопы, протон, нейтрон, электрон, умение работать ...Азот. Строение атома и молекулы, свойства простого вещества
Тема урока. «. Азот. Строение атома и молекулы, свойства простого вещества. » 9-й класс. . Цель урока:. . . изучение строения атома и молекулы ...Химическая связь. Строение вещества
Тема: Систематизация и обобщение знаний по теме «Химическая связь. Строение вещества». (стр. флипчарта 1 скрыть / показать). Цель:. . обобщить и ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:22 апреля 2018
Категория:Химия
Классы:
Содержит:24 слайд(ов)
Поделись с друзьями:
Скачать презентацию