Презентация "Строение атомов металлов" по химии – проект, доклад
Презентацию на тему "Строение атомов металлов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 13 слайд(ов).
Слайды презентации
Список похожих презентаций
Взаимодействие атомов элементов – неметаллов между собой
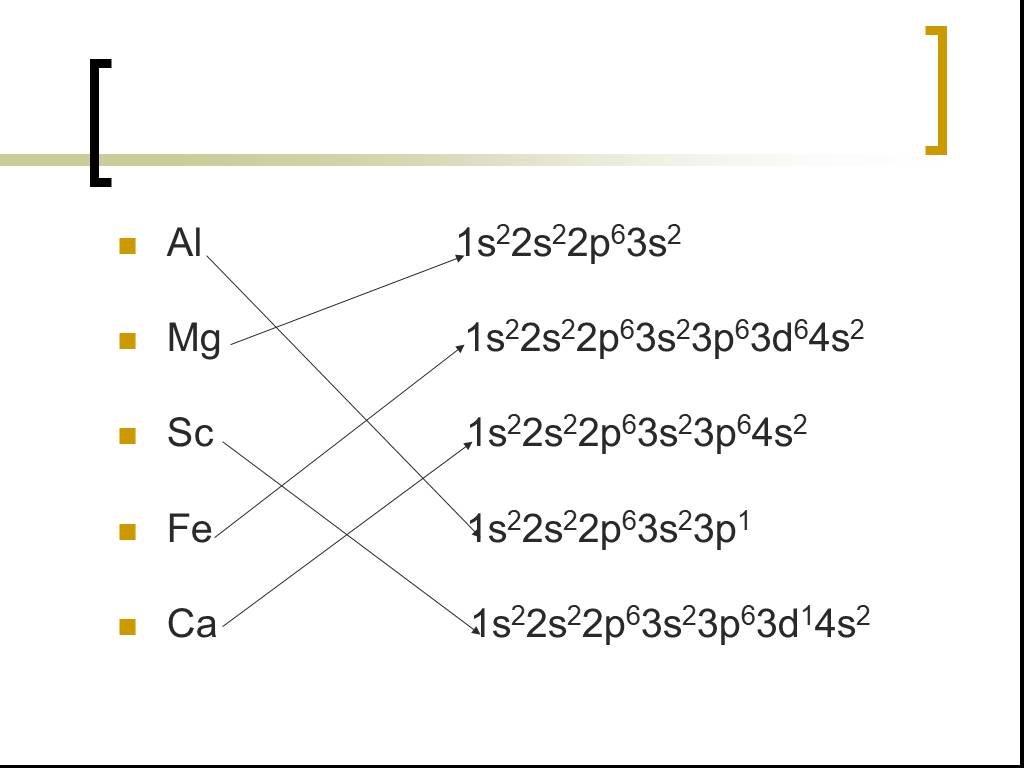
Что общего в составе частиц:. 1) 11H0, 21H0, 31H0 2) 168O0 , 168O2- , 178O0 3) 11H-, 21H-, 42He0. Разделите элементы на две группы: Cl, Mg, O, P, ...Положение металлов в таблице Д.И. Менделеева. Особенности строения атомов, свойства
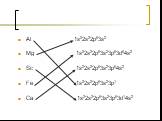
Цель урока: 1. на основе положения металлов в ПСХЭ прийти к пониманию особенностей строения их атомов и кристаллов (металлической химической связи ...Строение электронных оболочек атомов
Соотнесите химические формулы и формы существования химических элементов. 1) 2S 2) S8 3) 3H2O 4) Al2O3 5) 2Al 6) CuO. 1) свободные атомы 2) простые ...Строение атомов
План изучения. Важность познания атома. Модели строения атома. Опыт Эрнеста Резерфорда. Ядерная модель строения атома. Протонно-нейтронная модель ...Электронное строение атомов элементов
Повторение. Число электронов в атоме элемента = числу протонов = заряду ядра атома = порядковому номеру элемента. Электроны в атомах располагаются ...Строение атома и периодическая система химических элементов
Е 1s 3s 4s 3p 4p 3d n = 1 n = 2 n = 3 n = 4. Энергетическая диаграмма АО для многоэлектронных атомов. Многоэлектронные атомы. 1s. Порядок заполнения ...Коррозия металлов
Цель. Исследовать действие факторов окружающей среды на степень ржавления металлов. Гипотеза Если поместить железо в щелочную среду, то скорость коррозии ...Сравнительная характеристика металлов и их соединений
Пирит. Берилл. . Корунд (Al2O3). Рубин. Сапфир. Необычные кристаллы поваренной соли - "искусственные кораллы". Кристаллы соли Соляная шахта. Серебро. ...Строение атома
СТРОЕНИЕ АТОМА. Студент должен:. Знать: Основные положения теории строения атома (ядра и состояния электронов), формулировку периодического закона ...Сплавы драгоценных металлов
В зависимости от процентного содержания серебра и меди меняется цвет сплава. При содержании серебра более 30% цвет становится желто-белым и бледнеет ...Способы защиты от коррозии металлов
КОРРОЗИЯ МЕТАЛЛОВ – физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функциональных свойств ...Строение молекулы бензола
Цель урока. Изучить состав и строение молекулы бензола, рассмотреть гомологический ряд аренов, выяснить физические свойства бензола. Задача №1 Анализ ...Химические свойства металлов
Цель урока:. обобщить знание учащихся, полученные ранее при рассмотрении общих химических свойств металлов; повторить особенности протекания реакций ...Качественные реакции на ионы металлов
Проблемный вопрос: каким образом можно определить ионы металлов в растворах. Цель работы: научиться определять ионы металлов Задачи: расширить знания ...Строение вещества химия
СТРОЕНИЕ ВЕЩЕСТВА. Основополагающий вопрос КАК УСТРОЕН МИР? Проблемные вопросы Из чего сделано все на Земле? Почему все устроено так, а не иначе? ...История металлов
Цель:. Рассказать об открытии металлов. Гипотеза:. Возможно открытие металлов никак не повлияло на развитие цивилизаций. Медь. История цивилизаций ...Изучение свойств оксидов металлов
Цель: определить характер оксидов металлов, имеющихся в школьной лаборатории (оксиды бария, железа, кальция, меди, свинца), изучить их свойства. Задачи: ...Изучение коррозии и защиты металлов
Цель. Изучение проблемы коррозии металлов и исследование коррозийной стойкости металлов и способов их защиты. Задачи. изучить литературу по теме исследований; ...Грозит ли миру военный конфликт из-за металлов?
Плотность металлов. Металлы Лёгкие ρ5 гр/см3. Вся авиационная техника построена на основе сплавов лёгких металлов. Ртуть плотность - 14,19 г/см3. ...Горение металлов
Свойства летучих горючих металлов и их оксидов. На способность металлов возгораться и гореть большое влияние оказывают химические и физические свойства ...Конспекты
Положение неметаллов в периодической системе химических элементов Д.И. Менделеева, строение их атомов, физические свойства. Аллотропия
Тема:Положение неметаллов в периодической системе химических элементов Д.И. Менделеева, строение их атомов, физические свойства. Аллотропия. Цели ...Положение галогенов в Периодической таблице и строение их атомов
Урок химии по теме:. «Положение галогенов в Периодической таблице и строение их атомов. ». 8- класс. МОАУ СОШ №17 г.Белогорск. Печерица Наталья ...Строение электронных оболочек атомов химических элементов
Областное государственное автономное общеобразовательное учреждение. «Центр образования «Ступени». план-конспект урока. Тема урок:. ...Положение галогенов в периодической таблице Д.И. Менделеева и строение их атомов
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ. «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №39. ИМЕНИ П. Н. САМУСЕНКО». Положение ...Строение атома. Электронные оболочки атомов
Урок повторение по теме:. «Строение атома. Электронные оболочки атомов». Учитель химии высшей категории Жансеитова Ф.М.,. . сш№ 9, г. Тараз. ...Практическая работа № 1 Получение и свойства соединений металлов
Лысоконь Ирина Алексеевна. МБОУ СОШ № 2 ст. Архонская Пригородного района РСО-Алания. Учитель химии. Тема урока: Практическая работа № 1 Получение ...Химические свойства металлов. Ряд напряжения металлов
Дата_____________ Класс_______________. Тема:. . Химические свойства металлов. Ряд напряжения металлов. Цели урока:. расширить и углубить знания ...Химические свойства металлов
. Тема урока. Химические свойства металлов. . Класс. . 11. . . Тип урока. . Изучение и первичное закрепление нового материала. ...Характеристика щелочных металлов
Тема урока: Характеристика щелочных металлов. Цель урока:. . дать общую характеристику щелочных металлов по положению в периодической таблице ...Строение предельных одноатомных спиртов. Изомерия и номенклатура
Урок 10 класса. . (по учебнику Г.Е. Рудзитиса). Тема: Строение предельных одноатомных спиртов. . . Изомерия и номенклатура. Цель:. . 1. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 февраля 2019
Категория:Химия
Содержит:13 слайд(ов)
Поделись с друзьями:
Скачать презентацию





















![Задание 3. С раствором соли Zn + CuCl2 = ZnCl2 + Cu Zn + FeSO4 = ZnSO4 + Fe С раствором кислоты Zn + 2HCl = ZnCl2 + H2 Zn + H2SO4(p-p) = ZnSO4 + H2 С раствором щёлочи Zn + 2NaOH+2H2O = Na2[Zn(OH)4]+H2 тетрагидроксоцинкат натрия Задание 3. С раствором соли Zn + CuCl2 = ZnCl2 + Cu Zn + FeSO4 = ZnSO4 + Fe С раствором кислоты Zn + 2HCl = ZnCl2 + H2 Zn + H2SO4(p-p) = ZnSO4 + H2 С раствором щёлочи Zn + 2NaOH+2H2O = Na2[Zn(OH)4]+H2 тетрагидроксоцинкат натрия](https://prezentacii.org/upload/cloud/19/02/125781/images/thumbs/screen11.jpg)