Презентация "Хлор" по химии – проект, доклад
Презентацию на тему "Хлор" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 12 слайд(ов).
Слайды презентации
Список похожих презентаций
Хлор - физиологическая и патологическая роль в организме человека
Хлор-один из биогенных элементов. Постоянный компонент тканей растений и животных. Суточная потребность человека (2-4 г.) покрывается за счет пищевых ...Хлор
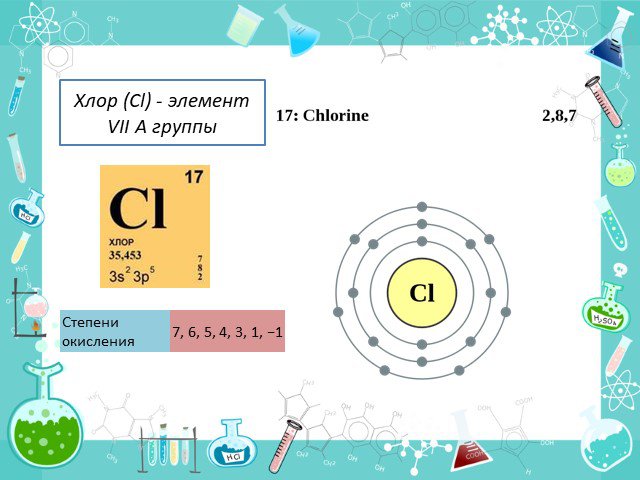
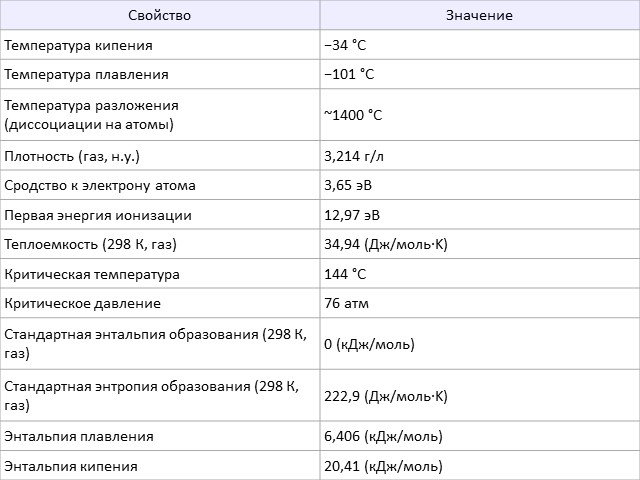
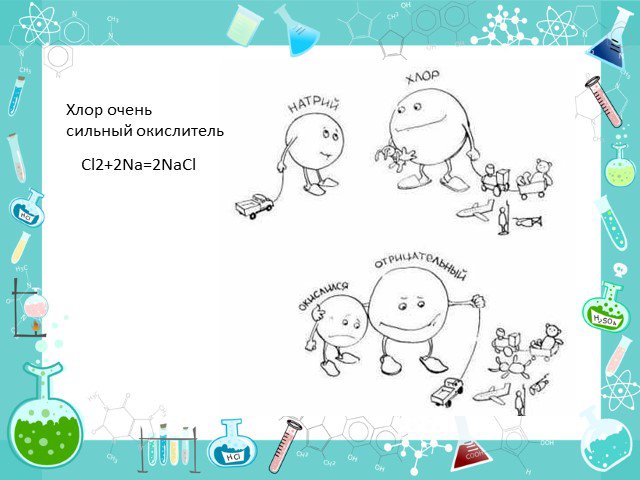
Положение в таблице Строение атома Физические свойства История открытия Минералы Получение Химические свойства Применение. Положение в таблице. Хлор ...Хлор
Xлор получен впервые в 1774 К. Шееле взаимодействием соляной кислоты с пиролюзитом МnO2. Однако, только в 1810 Г. Дэви установил, что хлор - элемент ...Хлор
Постановка проблемы: Хлор–опасен, но необходим. Причины: 1. Почему хлор получил такое название? 2. В 1916 г. в первую мировую войну немцы впервые ...Характеристика элементов VII группы главной подгруппы. Хлор
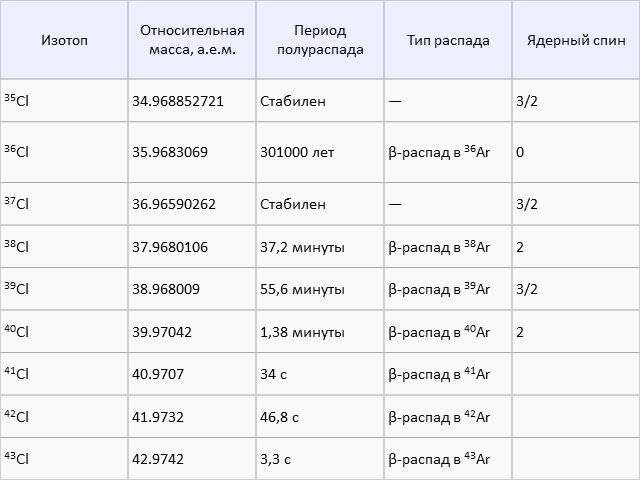
. . . . Нахождение в природе.В земной коре хлор - самый распространённый галоген. Поскольку хлор очень активен, в природе он встречается только ...
Конспекты
Хлор и его поражающие действия. Алгоритм действий при авариях на химически опасных объектах
Конспект урока в 8 классе. по теме. «Хлор и его поражающие действия. . . Алгоритм действий при авариях на химически опасных объектах». Цели ...Общая характеристика галогенов. Хлор
Тема:. Общая характеристика галогенов. Хлор. Цели:. Развивать. знания о семействе галогенов на примере хлора и его соединений, изучить строение ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Назарова М.
Содержит:12 слайд(ов)
Поделись с друзьями:
Скачать презентацию