Презентация "Оксиды азота" (7 класс) по химии – проект, доклад
Презентацию на тему "Оксиды азота" (7 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 17 слайд(ов).
Слайды презентации
Список похожих презентаций
Оксиды азота
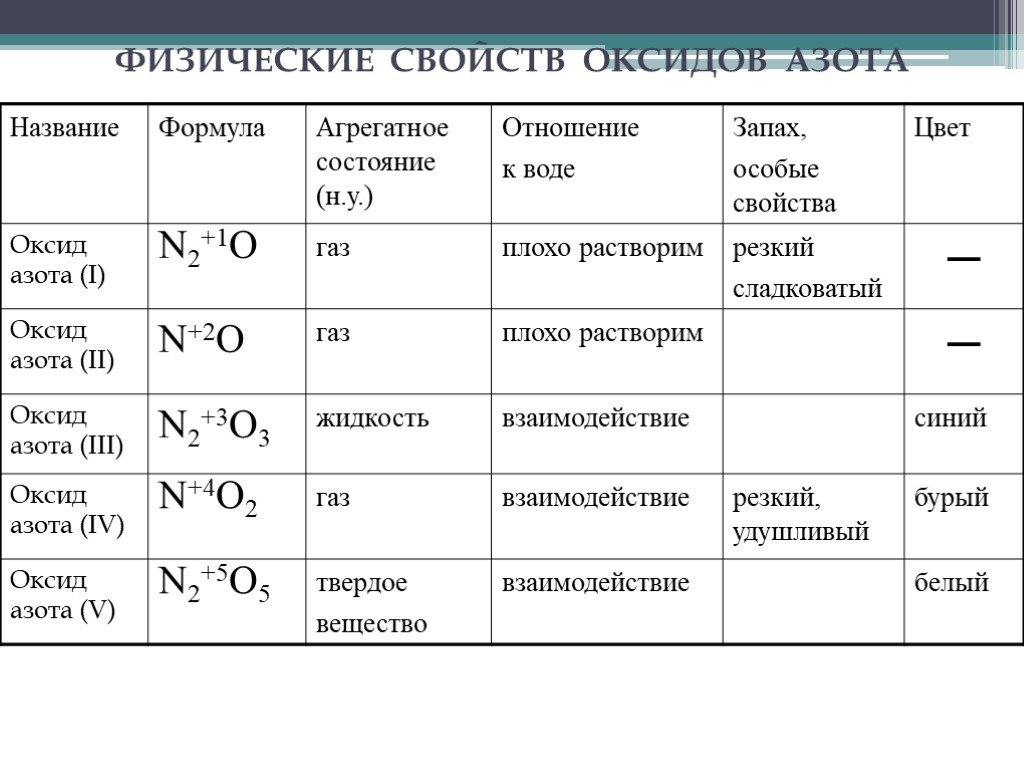
Содержание. Виды оксидов азота. Оксид азота(I). Оксид азота(II). Оксид азота(III). Оксид азота(IV). Азотный ангидрид. Виды оксидов азота. N2O NO N2O3 ...Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ
В 300 мг 20% раствора HNO3 растворили 10 мл аммиака. Определить массу полученной соли. Задача:. CO2 углекислый газ Без цвета Без запаха В воде растворяется ...Оксиды углерода
Оксиды углерода (II) и (IV). Тема: Содержание. Входной тест Строение молекул Физические свойства Физиологическое воздействие Получение Химические ...Кислородные соединения азота
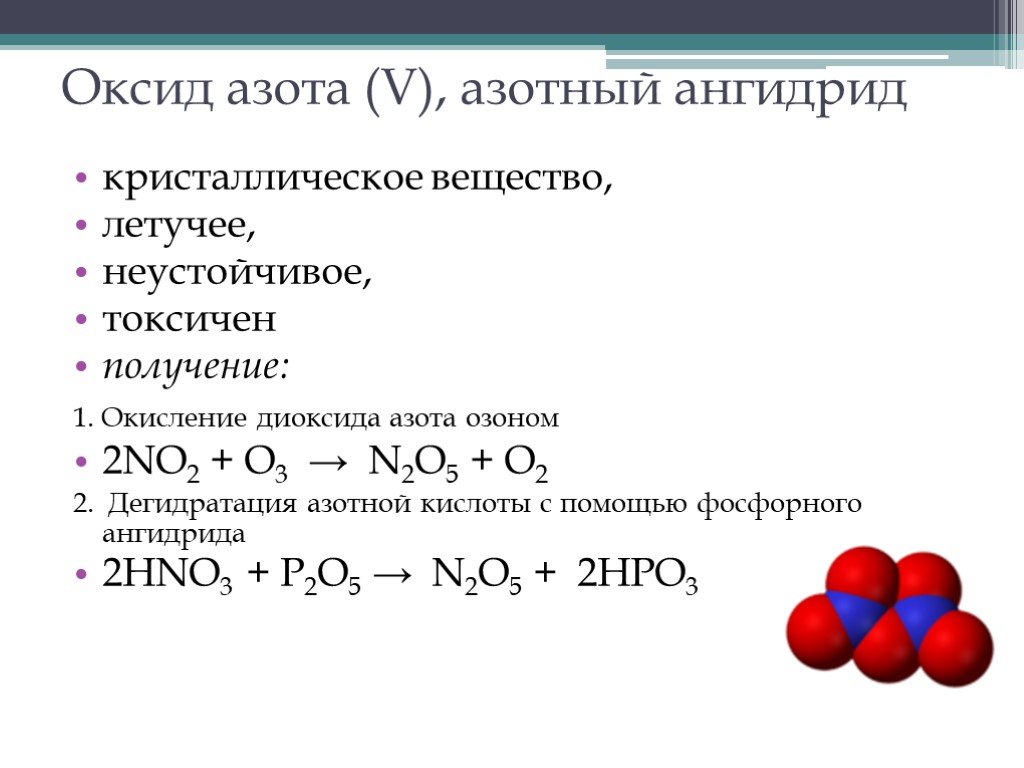
Оксиды азота:. . Вещества, образующиеся из оксидов азота:. N2O NO - несолеобразующие N2 N2+3O3-2 HNO2 Соли нитриты NO2 + H2O = HNO3+ HNO2 N2+5O5-2 ...Формулы оксида азота
Что относится к кислородным соединениям? Оксиды Кислоты (кислородсодержащие). Оксиды азота и кислоты, содержащие азот. Оксиды азота. Степени окисления ...Подгруппа углерода и азота
Цель урока:. Закрепить и обобщить знания об основных физических и химических свойствах углерода, азота и их соединений. Продолжить формировать умение ...Подгруппа азота
Выбери игру.Управление презентацией. 1. Главный слайд - № 2 (по гиперссылке необходимо перейти на любую из игр).
На главный слайд (№ 2).
Завершить ...
Оксиды, их применение
Один из распространенных оксидов – диоксид углерода CO2 – содержится в составе вулканических газов. В природе. Газ, необходимый растениям для фотосинтеза. ...Оксиды
Ребята, у нас с вами сегодня не просто урок, а научно-исследовательская лаборатория, а вы не ученики, а лаборанты-исследователи, которые должны самостоятельно ...Оксиды
Оксиды это…? Сложные вещества, состоящие из двух химических элементов одним из которых является кислород со степенью окисления -2. Оксиды делятся ...Оксиды
Цели урока:. 1. Сформировать понятия об оксидах; 2. Закрепить на оксидах значение химической номенклатуры для бинарных соединений; 3. Показать значение ...Круговорот азота в природе
Круговорот азота представляет собой ряд замкнутых взаимосвязанных путей, по которым азот циркулирует в земной биосфере. Различные микроорганизмы извлекают ...Круговорот азота
Цель: Изучить биохимические процессы круговорота азота в природе; Узнать, что такое круговорот азота; Задачи: Что такое азот? Что такое Круговорот ...Классификация неорганических веществ. Оксиды
ОКСИДЫ. Оксиды- бинарные соединения с кислородом в степени окисления (-2). Общая формула оксидов: ЭmOn где m число атомов элемента Э, а n – число ...Кислородные соединения азота и их свойства
Цель урока:. Расширить, обобщить, закрепить, оценить знания по теме: «Кислородные соединения азота» Повторить свойства азотной кислоты Закрепить особенности ...Оксиды, их классификация
Это газ, необходимый растениям для фотосинтеза. Это газ, выделяемый нами при выдохе. Что это за газ? … на рукомойнике моём Позеленела медь, Но так ...Оксиды, их классификация и свойства
Что такое оксиды? Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2. Классификация ...Оксиды
КЛАССИФИКАЦИЯ ОКСИДОВ. Оксиды 1) несолеобразующие N2O, NO, CO 2) Солеобразующие Основные Амфотерные Кислотные CaO ZnO P2O5 соответствуют соответствуют ...Подгруппа азота
1.С ростом порядкового номера элемента кислотные свойства оксидов в ряду…. N2O - P2O3 - As2O3 - Sb2O3 -Bi2O3. а) усиливаются б) ослабевают в) остаются ...Оксиды
Важнейшие классы неорганических веществ. Al(OH)3 MgO FeO Cu(OH)2 H2CO3 HNO3 H2 SO4 Ca(OH)2 Na2SO4 Al(NO3)3 СaCO3 K3PO4 H2SiO3. Распределить вещества ...Конспекты
Соли аммония. Оксиды азота (II) и (IV)
Урок 20. Соли аммония. Оксиды азота (II) и (IV). Цели урока:. 1. Охарактеризовать соли аммония и оксиды азота (II) и (IV) по следующей схеме: ...Оксиды серы. Серная кислота
Тема:. Оксиды серы. Серная кислота. . Цели:. Ознакомить. учащихся физическими и химическими свойствами оксида серы и серной кислоты. Формировать. ...Кислород в природе как химический элемент. Оксиды
МОУ Бендерская гимназия №2. . Урок химии 8 класс. По теме:«Кислород в природе как химический элемент. Оксиды». . ...Соединения азота
Урок химии в 9 классе по теме: «Соединения азота». Составитель урока. : учитель химии МОУ СОШ № 2 Нытвенского района Пермского края Ощепкова Ирина ...Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, физические и химические свойства, получение и применение
Дата_____________ Класс_______________. Тема:. . Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, ...Подгруппа азота
Урок-семинар в 9 классе. по теме: «Подгруппа азота». Девиз урока: « Мало знать, надо и применять. Мало хотеть, надо и делать» (Гёте). Цели ...Оксиды, их классификация и свойства
Тема урока. Оксиды, их классификация и свойства. Цель:. Формирование целостного представления об оксидах, как классе неорганических соединений. ...Оксиды, гидроксиды и соли железа(II) и железа(III)
Дата_____________ Класс_______________. Тема:. Оксиды, гидроксиды и соли железа(II) и железа(III). . Цели урока:. рассмотреть электронное строение ...Оксиды
Разработала : Сысоева Е.А. ,учитель химии МОУ «СОШ№9». Тема «Оксиды». 8класс. Цель. : сформировать понятие об оксидах, номенклатуре оксидов ...Оксиды
Муниципальное казенное образовательное учреждение. «Украинская средняя общеобразовательная школа». Омская область, Исилькульский район. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:10 января 2019
Категория:Химия
Содержит:17 слайд(ов)
Поделись с друзьями:
Скачать презентацию