Презентация "Оксиды" (8 класс) по химии – проект, доклад
Презентацию на тему "Оксиды" (8 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 8 слайд(ов).
Слайды презентации
Список похожих презентаций
Оксиды
Цели урока:. 1. Сформировать понятия об оксидах; 2. Закрепить на оксидах значение химической номенклатуры для бинарных соединений; 3. Показать значение ...Оксиды, их классификация и свойства
Что такое оксиды? Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2. Классификация ...Оксиды углерода
Оксиды углерода (II) и (IV). Тема: Содержание. Входной тест Строение молекул Физические свойства Физиологическое воздействие Получение Химические ...Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ
В 300 мг 20% раствора HNO3 растворили 10 мл аммиака. Определить массу полученной соли. Задача:. CO2 углекислый газ Без цвета Без запаха В воде растворяется ...Оксиды азота
Оксиды азота. Физические свойства, токсичность, методы получения. ФИЗИЧЕСКИЕ СВОЙСТВ ОКСИДОВ АЗОТА. Оксид азота (I), закись азота, «веселящий газ». ...Оксиды углерода
. . . . . . . . Вывод однозначен – все это аллотропные модификации атома углерода! У элемента номер шесть Достоинств очень много есть. «Людям я совсем ...Оксиды
Цель урока. Обобщить знания о составе оксидов, рассмотреть их классификацию и свойства основных и кислотных оксидов. Оксиды Оксиды — это сложные вещества, ...Оксиды азота
Содержание. Виды оксидов азота. Оксид азота(I). Оксид азота(II). Оксид азота(III). Оксид азота(IV). Азотный ангидрид. Виды оксидов азота. N2O NO N2O3 ...Оксиды
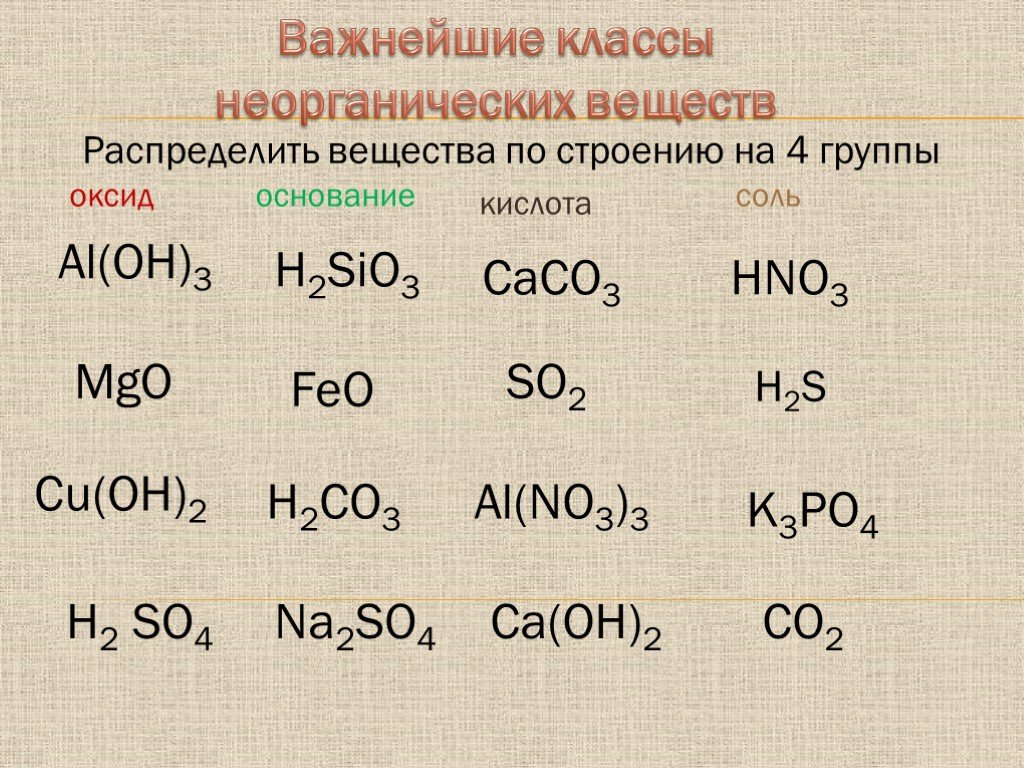
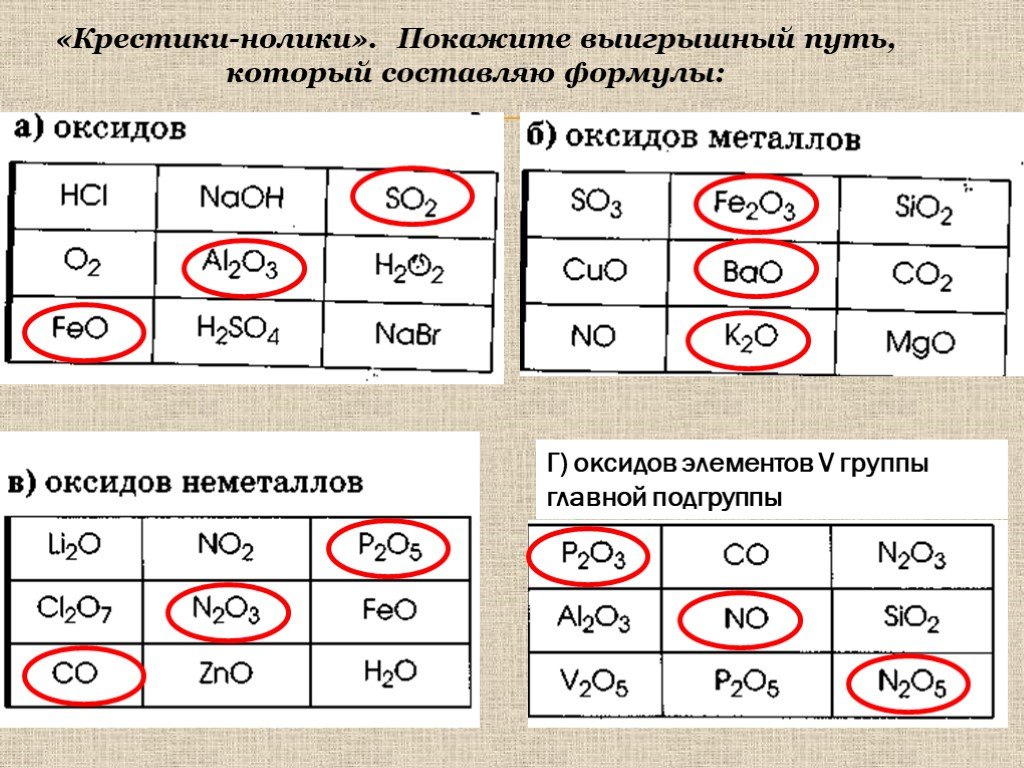
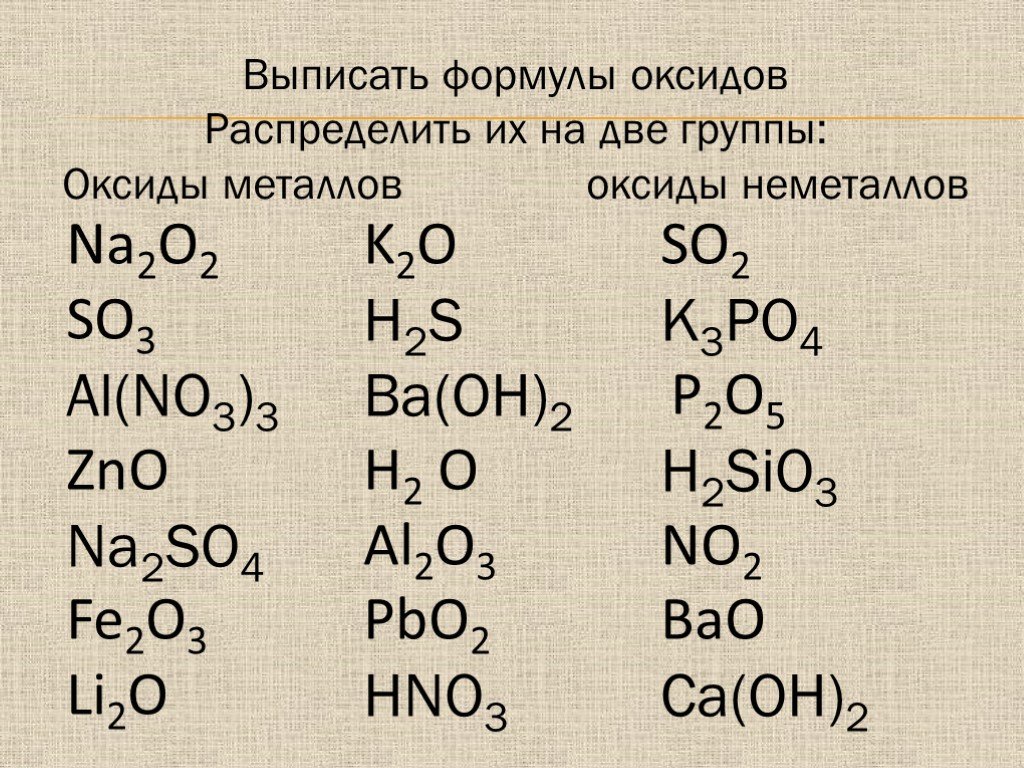
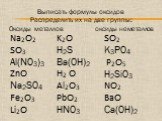
КЛАССИФИКАЦИЯ ОКСИДОВ. Оксиды 1) несолеобразующие N2O, NO, CO 2) Солеобразующие Основные Амфотерные Кислотные CaO ZnO P2O5 соответствуют соответствуют ...Оксиды
Ребята, у нас с вами сегодня не просто урок, а научно-исследовательская лаборатория, а вы не ученики, а лаборанты-исследователи, которые должны самостоятельно ...Оксиды
Оксиды это…? Сложные вещества, состоящие из двух химических элементов одним из которых является кислород со степенью окисления -2. Оксиды делятся ...Оксиды, их применение
Один из распространенных оксидов – диоксид углерода CO2 – содержится в составе вулканических газов. В природе. Газ, необходимый растениям для фотосинтеза. ...Оксиды, их классификация
Это газ, необходимый растениям для фотосинтеза. Это газ, выделяемый нами при выдохе. Что это за газ? … на рукомойнике моём Позеленела медь, Но так ...Классификация неорганических веществ. Оксиды
ОКСИДЫ. Оксиды- бинарные соединения с кислородом в степени окисления (-2). Общая формула оксидов: ЭmOn где m число атомов элемента Э, а n – число ...Химические оксиды
Н2О. самое распространенное вещество на нашей планете. Вода покрывает 71% площади поверхности Земли. Льдом покрыто 20% суши. Вода влияет на климат. ...Обобщение темы: «Кислоты, основания, оксиды и соли, их классификация и свойства»
Вопрос №1. Сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид – ионов, называются: 1) кислоты 2) основания 3) оксиды 4) соли ...тест оксиды
Результат теста. Верно: 6 Ошибки: 2 Отметка: 3. Время: 0 мин. 38 сек. ещё исправить. Выберите формулу оксида натрия. 1 2 4 Н2СО3 СО2 N2О Na2О. Выберите ...Кислотные оксиды
№ 3 стр. 99. CaCl2 MgCO3 Zn(NO3)2 Al2(SO4)3 K2CO3 Na2SO4 Na2SiO3 AgCl MgSO3 Al2S3. H O S. Образование солей. Zn. Номенклатура солей. + =. Составить ...Важнейшие представители бинарных соединений – оксиды и летучие водородные соединения
Н2О - вода. СО2 углекислый газ. СУХОЙ ЛЁД. NH3 аммиак. HCL хлороводород. Бесцветный газ. Тяжелее воздуха. Хорошо растворяется в воде. Раствор хлороводорода ...Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
SiO2 , H2O , CO2 , AI2O3 , Fe2O3 , CO. Всесильная стихия природы-вода во все времена, во все периоды истории покоряла ум и воображение людей. Человек ...Конспекты
Оксиды углерода (II) и (IV). Карбонаты
Открытый урок по химии в 9 классе по теме:. . . «Оксиды углерода (. II. ) и (. IV. ). Карбонаты». Учитель МКОУ СОШ с.п. Кара-Суу Жабоева Раиса ...Оксиды, гидроксиды и соли железа(II) и железа(III)
Дата_____________ Класс_______________. Тема:. Оксиды, гидроксиды и соли железа(II) и железа(III). . Цели урока:. рассмотреть электронное строение ...Оксиды серы. Серная кислота
Тема:. Оксиды серы. Серная кислота. . Цели:. Ознакомить. учащихся физическими и химическими свойствами оксида серы и серной кислоты. Формировать. ...Оксиды углерода
Цель. : сформировать знания об оксиде углерода (II) и оксиде углерода (IV). Задачи:. На основе электронного строения атома углерода определить ...Кислород, его общая характеристика и нахождение в природе. Оксиды
Муниципальное бюджетное общеобразовательное учреждение. «Краснощёковская средняя общеобразовательная школа№1». Краснощековского района. . Алтайского ...Оксиды
Конспект урока химии для 8 классапо теме «Оксиды». УМК «Химия. 8 класс» О. С. Габриеляна. Урок « Оксиды» относится к блочной теме « Соединения ...Оксиды
"Оксиды". Цели урока:. Сформулировать у учащихся понятия об оксидах, их классификация. . Закрепить на оксидах знание химической номенклатуры ...Сера и ее соединения. Аллотропия серы. Сероводород. Оксиды серы
Тема: Сера и ее соединения. Аллотропия серы. Сероводород. Оксиды серы (. IV, VI. ). . Цели урока:. рассмотреть вещество «сера», аллотропию серы, ...Оксиды
Муниципальное бюджетное общеобразовательное учреждение. «Гимназия № 7 имени Героя России С.В.Василева» г. Брянска. Технологическая ...Оксиды
Обобщающий урок по теме « Оксиды». Цель урока:. Систематизировать знания. об оксидах. . Задачи:. . . Образовательные задачи:. . Актуализировать ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:9 мая 2018
Категория:Химия
Классы:
Содержит:8 слайд(ов)
Поделись с друзьями:
Скачать презентацию