Конспект урока «Оксиды» по химии для 8 класса
Конспект урока химии для 8 класса
по теме «Оксиды»
УМК «Химия. 8 класс» О. С. Габриеляна
Урок « Оксиды» относится к блочной теме « Соединения химических элементов» и является вторым по счету. Занятие носит проблемный характер, построен на применении знаний учащихся о бинарных соединениях и валентности элементов.
Тип урока: урок изучения нового материала
Цель урока: сформировать понятие об оксидах как об одном из классов химических соединений; рассмотреть состав, строение, номенклатуру.
Задачи (шаги, с помощью которых достигаются цели урока):
Образовательные задачи:
-
дать понятие об оксидах
-
продолжить формирование умения составлять формулы веществ, используя валентность элементов, названия веществ.
-
закрепить знания химической номенклатуры для бинарных соединений
-
показать значение оксидов в природе и жизни человека.
Развивающие задачи:
-
Развивать речевые навыки, наблюдение и умение делать выводы
-
развивать умение работать коллективно
-
Развивать интерес к химической науке
Воспитательные задачи:
-
Воспитывать умение работать в атмосфере поиска, творчества, прививать чувство ответственности за выполненную работу, самостоятельность, общительность, коммуникабельность.
Оборудование: ноутбук, проектор, экран, ПСХЭ Д.И. Менделеева, дидактический материал, учебник; на столах учащихся образцы природных минералов и руд, содержащих оксиды.
Ход урока:
-
Организационный момент
Приветствие, проверка готовности к уроку
Цель: Включение детей в деятельность на личностно-значимом уровне.
Добрый день! Я рада нашей встрече, и пусть за окном полярная ночь, но в нашем классе тепло и уютно и это нам поможет работать плодотворно и эффективно.
-
Актуализация знаний.
Мотивация учебной деятельности на успешную работу
Цель: Повторение изученного материала, необходимого для «открытия нового знания»
Вначале урока учитель проводит самостоятельную работу, где отрабатываются умения учащихся определять валентность химических элементов по формулам бинарных соединений и, наоборот, записывать формулы по валентности.
Самостоятельная работа «Валентность химических элементов»
| Символ химического элемента | Валентность | Формула соединения | Символ химического элемента | Валентность | |
| 1 | Na | ? | NaCl | Cl | I |
| 2 | Al | ? | Al2O3 | ? | ? |
| 3 | ? | ? | CaO | ? | ? |
| 4 | K | ? | ? | N | ? |
| 5 | C | IV | ? | O | ? |
( учащиеся работают индивидуально, самоконтроль по шаблону)
-
Изучение нового материала.
(Цель: формирование системно-информационного анализа, развитие умений определять цели и задачи деятельности, выбирать средства реализации цели)
Класс веществ, который нам предстоит изучить, всегда содержит кислород, представители этого класса получаются при взаимодействии с кислородом, это бинарные соединения.
Выпишите формулы этих соединений. (см. формулы в с/р, один ученик -у доски, остальные в тетрадях)
Al2O3
CaO Какой класс сложных веществ нам предстоит изучить?
CO2 Назовите тему сегодняшнего урока? (учащиеся: оксиды)
- Верно. Вы правильно определили тему сегодняшнего урока
«Оксиды. Состав, классификация, номенклатура».
( Запись темы урока «Оксиды» в тетрадь)
Этап «открытия нового знания»
-
Определение класса оксидов
Проанализируйте формулы. Что общего во всех этих веществах?
( Учащиеся выделяют общие признаки оксидов, работая в паре)
- Сформулируем определение оксидов, ответив на 3 вопроса.
В ходе анализа справа от формул учитель делает краткую запись на доске, а учащиеся в тетради:
а) какие вещества по составу?
б) сколько элементов в составе?
в) какой элемент обязательно входит в состав оксидов, его валентность?
Al2O3 1. Сложные вещества.
CaO 2. Состоят из 2 х.э.
CO2 3. О, II
(создание проблемной ситуации и ее решение)
А это оксид? H2O2
( учащиеся- это не оксид, т.к. валентность кислорода равна 1)
- Дайте определение оксидам (Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород c валентностью -2).
(учащиеся записывают определение в тетрадь).
Первичная проверка усвоения нового материала.
Игра «Волшебный цветок»
Сорвать все лепестки с формулами оксидов.
(Учащиеся работают в группах, выбирают формулы оксидов, мотивируя свой выбор).
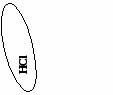
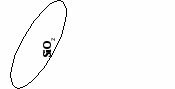
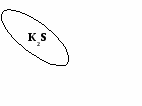
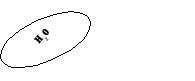
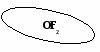

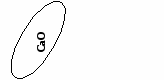
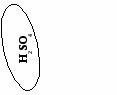

(создание проблемной ситуации и ее решение)
OF2 можно ли отнести к оксидам? ( учащиеся обращаются к алгоритму составления оксидов)
г) Алгоритм составления формул оксидов (учащиеся работают с учебником).
Учащиеся: OF2 – фторид кислорода.
Выведите общую формулу класса оксидов.
II
ЭxОy
Классификация оксидов (оксиды металлов, оксиды неметаллов).
Первичная проверка усвоения нового материала.
Составьте формулы оксидов: оксид бария, оксид алюминия, оксид калия, оксид углерода(IV), оксид серы(VI) , оксид железа(III)
Физминутка. Трудным оказался путь, надо бы передохнуть. (Зарядка для глаз)
2) Номенклатура (названия) оксидов.
Попробуйте правильно назвать оксиды, формулы которых записаны К2О, FeO, Fe2O3
Названия оксидов, в состав которых входят химические элементы с постоянной валентностью, даются без упоминания валентности.
Если же они образованны химическими элементами с переменной валентностью, то рядом с названием оксида ставится в скобках валентность
Алгоритм построения названий оксидов:
Оксид + название элемента в родительном падеже (валентность в случае ее переменности) Учащиеся записывают алгоритм в тетрадь.
Первичная проверка усвоения нового материала.
(работа в группах, самоконтроль по шаблону) У вас на столах лежат карточки.
Выпишите в столбик из перечня химических формул веществ формулы оксидов и дайте им названия:
MgO, KOH, O3, SO3, SO2, Al2S3, CaCO3, Аl2O3, Mg(OH)2, CO2, Na3N, HCl, CaO, H2CO3, P2O5, FeCl3, Na2O, H2SO4, СuО, Cu2O, HNO3 ,NH3
3) Многие оксиды встречаются в природе в виде полезных ископаемых, они находятся в окружающем нас воздухе, образуются в результате деятельности человека. Сейчас вы познакомитесь с образцами оксидов. (работа с коллекцией природных оксидов)
-
Н2О - вода - оксид водорода
-
Al2О3- оксид алюминия - глинозём
-
SiO2 - кварц, кремнезём, речной песок, яшма – оксид кремния
-
СаО - оксид кальция - негашеная известь
-
MnO2 - оксид марганца (IV) - пиролюзит
-
MgO - оксид магния - жженая магнезия
-
Fe2O3 - оксид железа (III) - красный железняк (гематит)
Те оксиды, с которыми вы познакомились используются человеком в строительстве, для производства металлов, стекла, как поделочные материалы.
4) Составьте формулы названных в тексте оксидов (работа с текстом в группе, самоконтроль по шаблону)
В земной коре – литосфере – находится оксид алюминия ________ (глина), оксид кремния (IV) _____ (песок), оксид железа (III) ______ (содержится в красном железняке). Водная оболочка Земли – гидросфера – оксид водорода _____. В воздухе есть оксид углерода (IV) ______ (углекислый газ). В результате хозяйственной деятельности человека образуются вещества, загрязняющие атмосферу: оксид углерода (II) _____ (угарный газ), оксид серы (IV) ______ (сернистый газ), оксид азота (II) ____ и оксид азота (IV) ______.
Ответ: оксид алюминия - Al2O3, оксид кремния - SiO2, оксид железа (III) - Fe2O3, оксид водорода - Н2О, оксид углерода (IV) - СО2, оксид серы (IV) - SO2, оксид азота (II) – NO, оксид азота (IV) - NO2
5) Сообщения учащихся
-
Вода́ (оксид водорода) — прозрачная жидкость, не имеющая цвета, запаха и вкуса. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, лёд на полюсах).
-
Натуральный рубин - самый дорогой драгоценный камень в мире. Всё потому, в природе очень редко встречаются совершенные рубины ещё и больших размеров. Рубин - разновидность корунда. Химическая формула Al2O3
-
Углекислый газ (Оксид углерода(IV) ) — CO2, газ без цвета, обладает кислым запахом и вкусом (что используется в производстве газированной воды), растворим в воде, при сильном охлаждении кристаллизуется в виде белой снегообразной массы — «сухого льда». При атмосферном давлении он не плавится, а испаряется, температура сублимации −78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании человека, животных и растений. Мало растворим в воде (1 объём углекислого газа в одном объёме воды при 15 °С).
-
Глина - широко распространенная горная порода. Состав глины. Во всех сортах природной глины всегда содержатся: а) глинозем, т. е. окcид алюминия Al2O3; б) кремнезем или оксид кремния(IV) SiO2; в) гидратная вода, Н2O, как вещество удаляемое после выслушивания при прокаливании. Из глиняного теста делают различные изделия - кувшины, кринки, горшки, миски и т. п., которые после обжига становятся совершенно твердыми и не пропускают воду. Кирпичные заводы вырабатывают из глины строительные кирпичи, также обладающие большой механической прочностью. Это указывает еще на одно важное свойство глины - ее способность твердеть после обжига, давая материал, не размокающий в воде и непроницаемый для нее.
IV. Контроль знаний, обратная связь
( самостоятельная работа учащихся, оценка своей работы по ключу)
Тест по теме: «Оксиды».
1.Общая формула оксидов.
А) ЭxОy Б) ЭхНу В) ЭхНуО
2. Ряд формул, в котором все вещества оксиды:
А) ZnO, ZnCl2, H2O Б) CaO, NaOH, NH3 В)SO3, MgO, CuO
3. Оксид марганца (IV) имеет формулу
А)Mn2O7 Б) MnO2 В) MnF4
4. Установите соответствие между формулой оксида и названием
Формула оксида Название оксида
1.NO А) оксид азота (II)
2.N2O3 Б) оксид азота (IV)
3.NO2 В) оксид азота (III)
Г) оксид азота (V)
5. Запишите формулы: оксид натрия, оксид углерода (IV), оксид фосфора (V)
V.Подведение итогов. Рефлексия.
(Цель: формирование у учащихся способности подводить итоги урока, обобщать, делать выводы, характеризовать свои действия)
Молодцы, вы сегодня хорошо работали. Мы все вместе узнали что-то новое и всё же каждый для себя совершил какое- то открытие. Поделитесь этим открытием, закончите предложение:
Сегодня на уроке
-
Мне удалось...
-
Я узнал(а) много нового …
-
Я научился …
-
Мне необходимо …
Запишите продолжение этого предложения в тетрадях. Итак, озвучьте свои записи.
(мы сегодня научились находить формулы оксидов среди других веществ, называть оксиды и составлять формулы по названиям, познакомились с отдельными представителями оксидов.)
Позвольте и мне продолжить эту фразу.
Сегодня на уроке мне удалось пообщаться с замечательными молодыми людьми, которые станут украшением нашего общества.
Так как, урок необычный, я разрешаю вам поставить каждому из вас себе оценку.
Оцените себя.
-
Домашнее задание: § 18 упр. 1
Используя дополнительную литературу подготовить сообщение на тему: «Применение оксидов».
Здесь представлен конспект к уроку на тему «Оксиды», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (8 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

