Презентация "Соединения химических элементов. Степень окисления" по химии – проект, доклад
Презентацию на тему "Соединения химических элементов. Степень окисления" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 7 слайд(ов).
Слайды презентации
Список похожих презентаций
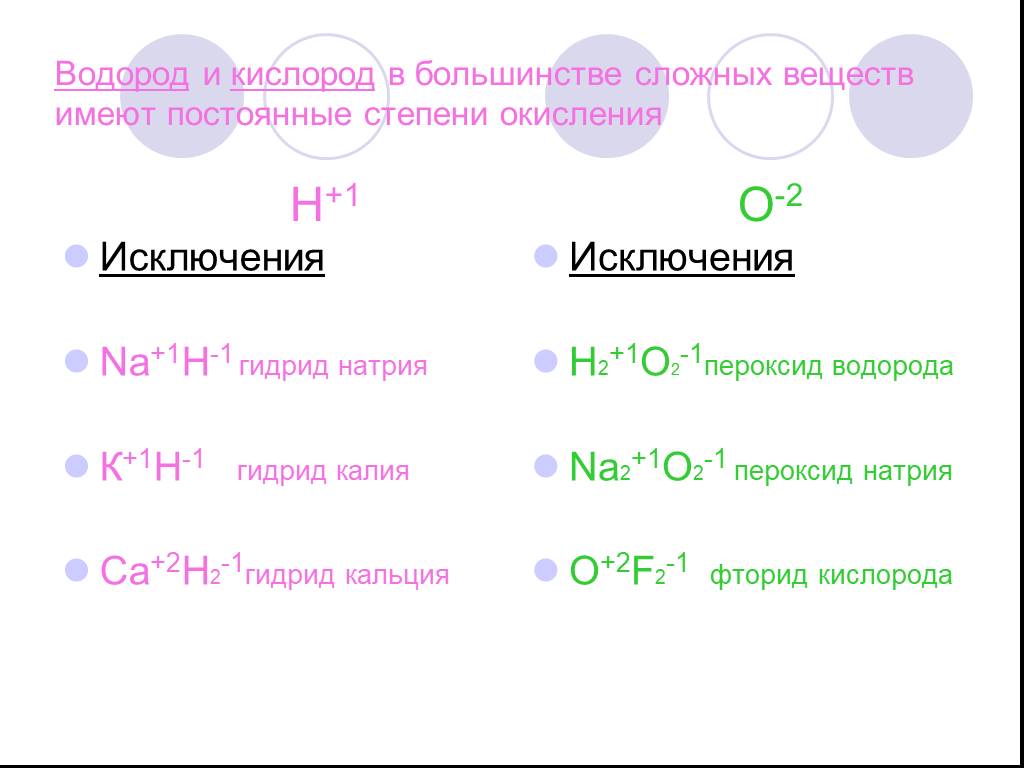
Соединения химических элементов
Конфуций сказал:. «Учиться, а время от времени повторять изученное, разве неприятно?». Задание 1.Выписать оксиды и распределить их в два столбика: ..."Соединения химических элементов"
Цель урока. обобщить и систематизировать знания по теме «Соединения химических элементов», подготовиться к контрольной работе. Конкурс 1 «Найди родственников». ...Соединения химических элементов
1 Станция «Теоретическая». Из предложенного списка веществ выписать отдельно: оксиды, кислоты, соли, основания: Н2SО4, Аl (NО3)3, МgСl2, Са(ОН)2, ...Путешествие по Периодической системе химических элементов
Загадки Ребусы Шарады. Он и легок и пластичен, С блеском серебристым, Но снаружи никогда не бывает чистым. Мы найдем его на кухне, И на стройке, и ..."Знаки химических элементов. Периодическая таблица
скисание молока, испарение воды, образование ржавчины, горение древесины, гашение соды уксусом, горение свечи, таянье льда, кипение воды, подгорание ...Биогенная классификация химических элементов
бром железо натрий. Элементы необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами. Введение в ...Атомы химических элементов. Структура Периодической системы
Цель урока:. Цель урока: Обобщение знаний о строении атома, изотопах, формирование понятия «химический элемент», закрепление знаний о структуре Периодической ...Периодический закон. Периоды Периодическая система химических элементов Д.И. Менделеева. Группы
Периодический закон. Свойства химических элементов, а также образуемых ими простых и сложных веществ находится в периодической зависимости от относительных ...Характеристика химических элементов и их соединений на основе положения элементов в периодической системе.
Цель урока? Химический элемент. Семейство Щелочные Ме Халькогены Период Группы Изотопы Валентность Д.И.Менделеев. Горячий стул. Химический диктант ...Валентность химических элементов
Валентность некоторых химических элементов в химических соединениях. С постоянной валентностью. C переменной валентностью. Определение валентности ...Валентность и степень окисления
Из атомов мир создавала Природа. Два атома лёгких взяла водорода. Прибавила атом один кислорода. И получилась частица …. Н2О Почему такой состав имеет ...Периодическая таблица химических элементов
Тема урока: Классификация химических элементов. Начало классификации. К 70-м годам прошлого века было уже известно более 60 химических элементов. ...Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома
ДЕВИЗ УРОКА:. Чтобы стать настоящим химиком, надо знать, уметь, думать!". ЭПИГРАФ УРОКА:. «… Другого ничего в природе нет, Ни здесь, ни там, в космических ...Степень окисления
Определите тип химической связи для веществ:. Na NaCl Cl2 HCl металлическая ионная. Ковалентная неполярная. Ковалентная полярная. У каких веществ ...Степень окисления
Цель урока:. Разобраться, что такое «степень окисления» Научиться находить степень окисления по формуле. Поваренная соль NaCl. «Хлеб да соль» - пожелание ...Знаки химических элементов
Другого ничего в природе нет ни здесь, ни там, в космических глубинах: все — от песчинок малых до планет — из элементов состоит единых. Как формула, ...Знаки химических элементов
Водород Н Гидрогениум Аш. Ртуть Hg. Гидраргерум Гидраргерум. Углерод С Карбониум Цэ. Хлор Cl Хлорум Хлор. Медь Сu Купрум Купрум. Хром Cr Хромиум Хром. ...Знаки химических элементов
Другого ничего в природе нет ни здесь, ни там, в космических глубинах: все — от песчинок малых до планет — из элементов состоит единых. Как формула, ...Знаки химических элементов
Другого ничего в природе нет Ни здесь, ни там, в космических глубинах: Все - от песчинок малых до планет - Из элементов состоит единых. Степан Щипачев ...Степень окисления
Цель урока:. Разобраться, что такое «степень окисления» Научиться находить степень окисления по формуле. Поваренная соль NaCl. «Хлеб да соль» - пожелание ...Конспекты
Соединения химических элементов
Автор: Деревенчук Лариса Викторовна. 8 класс. Тема урока: Соединения химических элементов. Тип урока:. урок обобщения и систематизации знаний. ...Соединения химических элементов
Обобщающий урок по теме. :. « Соединения химических элементов». Цель урока:. . . Обобщить и систематизировать знания учащихся о классификации ...Соединения химических элементов
Предмет: Химия. Класс: 8. Учитель: Григорьева Ольга Анатольевна учитель первой категории. Урок № 13 в разделе « Соединения химических элементов». ...Соединения химических элементов
Урок повторения и обобщения материала в 8 классе по теме. «Соединения химических элементов». Цель:. продолжить формирование умений решать расчетные ...Степень окисления элементов
Тема урока: Степень окисления элементов. . Цели. урока. 1.Образовательные. :. Сформулировать понятие о степени окисления. Научить определять ...Валентность и степень окисления атомов. Периодичность в изменении свойств соединений элементов
План учебного занятия №4. . Дата Предмет. химия. группа. Ф.И.О. преподавателя:. Кайырбекова И.А. . І. Тема занятия:. . Валентность и степень ...Знатоки химических элементов
Урок химии, 8 класс. . . Урок-игра. « Знатоки химических элементов». Николаенко Виктория Викторовна, учитель химии и биологии Мартыновской общеобразовательной ...Введение. Атомы химических элементов
МОУ ИРМО «Никольская СОШ». 8 класс. Учитель:. . Г.М. Донская. 2014 – 2015 учебный год. . Урок – обобщение по темам. ...Валентность химических элементов
Тема:. Валентность химических элементов. Цель:. Ознакомление с понятием «валентность». Определение валентности элементов по формулам их соединений. ...Валентность химических элементов
Муниципальное бюджетное образовательное учреждение. . средняя общеобразовательная школа № 144. . ул. Красных партизан, 8а г. Нижний Новгород, ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:22 марта 2019
Категория:Химия
Содержит:7 слайд(ов)
Поделись с друзьями:
Скачать презентацию