"Соединения химических элементов" презентация, проект, доклад
Презентацию на тему ""Соединения химических элементов"" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 17 слайд(ов).
Слайды презентации
Список похожих презентаций
Соединения химических элементов
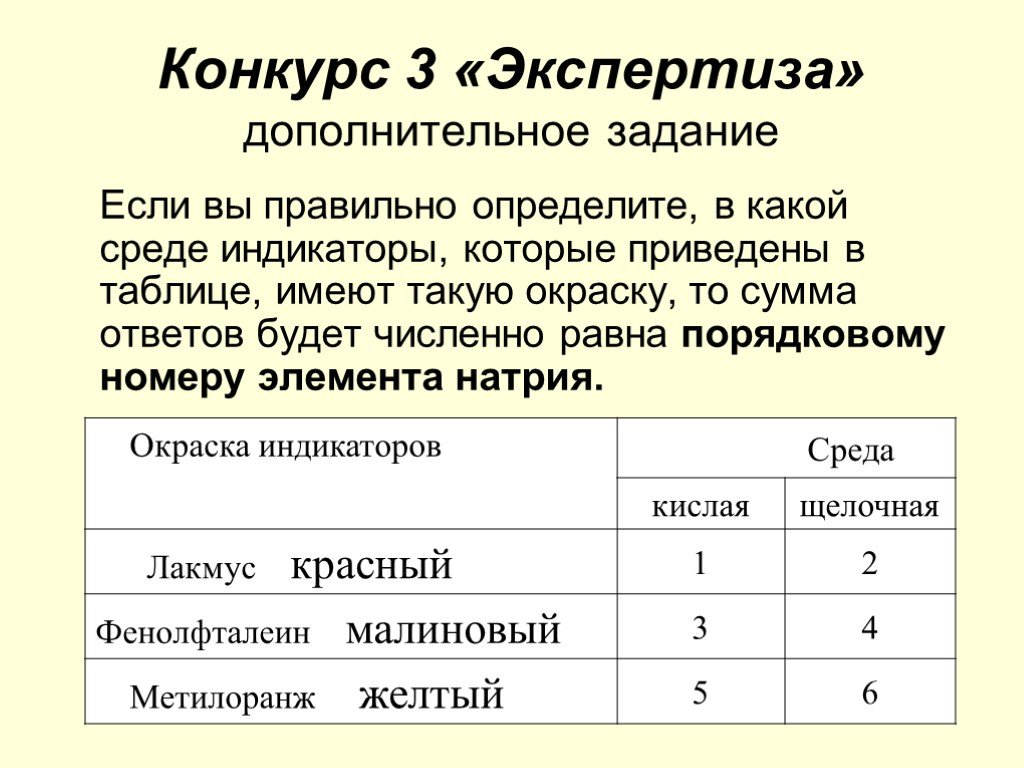
Конфуций сказал:. «Учиться, а время от времени повторять изученное, разве неприятно?». Задание 1.Выписать оксиды и распределить их в два столбика: ...Соединения химических элементов
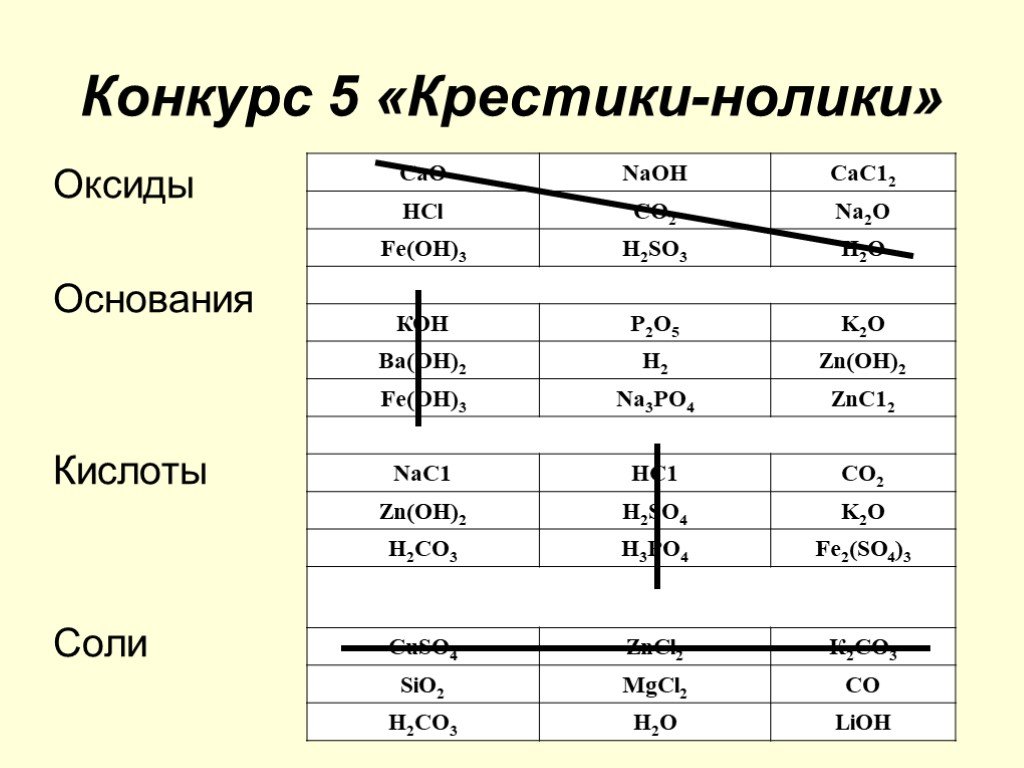
1 Станция «Теоретическая». Из предложенного списка веществ выписать отдельно: оксиды, кислоты, соли, основания: Н2SО4, Аl (NО3)3, МgСl2, Са(ОН)2, ...Соединения химических элементов. Степень окисления
Бинарные соединения – сложные вещества, состоящие из двух химических элементов. NaCl Хлорид натрия Na0+Cl0=Na+Cl‾ Связь ионная +11Na )2)8)1 Атом натрия ...Атомы химических элементов. Структура Периодической системы
Цель урока:. Цель урока: Обобщение знаний о строении атома, изотопах, формирование понятия «химический элемент», закрепление знаний о структуре Периодической ...Атомы химических элементов
Задание 1: найдите в каждом ряду один химический элемент, который отличается от остальных по положению в периодической системе химических элементов ...Биогенная классификация химических элементов
бром железо натрий. Элементы необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами. Введение в ...Путешествие по Периодической системе химических элементов
Загадки Ребусы Шарады. Он и легок и пластичен, С блеском серебристым, Но снаружи никогда не бывает чистым. Мы найдем его на кухне, И на стройке, и ...Элемент периодической системы химических элементов Д.И.Менделеева -АЛЮМИНИЙ
Около 100 лет назад Николай Гаврилович Чернышевский, сказал об алюминии, что этому металлу суждено великое будущее, что алюминий – металл социализма. ...Валентность химических элементов
Валентность некоторых химических элементов в химических соединениях. С постоянной валентностью. C переменной валентностью. Определение валентности ...Периодический закон. Периоды Периодическая система химических элементов Д.И. Менделеева. Группы
Периодический закон. Свойства химических элементов, а также образуемых ими простых и сложных веществ находится в периодической зависимости от относительных ..."Знаки химических элементов. Периодическая таблица
скисание молока, испарение воды, образование ржавчины, горение древесины, гашение соды уксусом, горение свечи, таянье льда, кипение воды, подгорание ...Периодическая таблица химических элементов
Тема урока: Классификация химических элементов. Начало классификации. К 70-м годам прошлого века было уже известно более 60 химических элементов. ...Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома
ДЕВИЗ УРОКА:. Чтобы стать настоящим химиком, надо знать, уметь, думать!". ЭПИГРАФ УРОКА:. «… Другого ничего в природе нет, Ни здесь, ни там, в космических ...Знаки химических элементов
Другого ничего в природе нет ни здесь, ни там, в космических глубинах: все — от песчинок малых до планет — из элементов состоит единых. Как формула, ...Знаки химических элементов
Другого ничего в природе нет ни здесь, ни там, в космических глубинах: все — от песчинок малых до планет — из элементов состоит единых. Как формула, ...Знаки химических элементов
Водород Н Гидрогениум Аш. Ртуть Hg. Гидраргерум Гидраргерум. Углерод С Карбониум Цэ. Хлор Cl Хлорум Хлор. Медь Сu Купрум Купрум. Хром Cr Хромиум Хром. ...Периодическая система химических элементов Д.И. Менделеева
Цель. Сформировать представление о строении периодической системы Рассмотреть закономерности свойств химических элементов. Меню. Содержание. Историческая ...Периодическая система химических элементов Д.И. Менделеева и строение атома
Цель:. Повторить основные теоретические вопросы программы 8 класса; Закрепить знания о причинах изменения свойств химических элементов на основании ...Периодическая система химических элементов Д.И. Менделеева
МЕНДЕЛЕЕВ Дмитрий Иванович (1834-1907). выдающийся русский деятель науки и культуры, автор фундаментальных исследований по химии, химической технологии, ...Строение атома и периодическая система химических элементов
Е 1s 3s 4s 3p 4p 3d n = 1 n = 2 n = 3 n = 4. Энергетическая диаграмма АО для многоэлектронных атомов. Многоэлектронные атомы. 1s. Порядок заполнения ...Конспекты
Соединения химических элементов
Предмет: Химия. Класс: 8. Учитель: Григорьева Ольга Анатольевна учитель первой категории. Урок № 13 в разделе « Соединения химических элементов». ...Соединения химических элементов
Автор: Деревенчук Лариса Викторовна. 8 класс. Тема урока: Соединения химических элементов. Тип урока:. урок обобщения и систематизации знаний. ...Соединения химических элементов
Урок повторения и обобщения материала в 8 классе по теме. «Соединения химических элементов». Цель:. продолжить формирование умений решать расчетные ...Соединения химических элементов
Обобщающий урок по теме. :. « Соединения химических элементов». Цель урока:. . . Обобщить и систематизировать знания учащихся о классификации ...Введение. Атомы химических элементов
МОУ ИРМО «Никольская СОШ». 8 класс. Учитель:. . Г.М. Донская. 2014 – 2015 учебный год. . Урок – обобщение по темам. ...Валентность химических элементов
Тема:. Валентность химических элементов. Цель:. Ознакомление с понятием «валентность». Определение валентности элементов по формулам их соединений. ...Валентность химических элементов
Муниципальное бюджетное образовательное учреждение. . средняя общеобразовательная школа № 144. . ул. Красных партизан, 8а г. Нижний Новгород, ...Валентность химических элементов
10. . . Урок по теме: «Валентность химических элементов». Тип урока. : комбинированный, изучение нового материала. Цель урока:. сформировать ...Положение углерода и кремния в периодической системе химических элементов, строение их атомов. Углерод, аллотропные модификации
Дата_____________ Класс_______________. Тема:. . Положение углерода и кремния в периодической системе химических элементов, строение их атомов. ...Атомы химических элементов
Зачет по теме «Атомы химических элементов». Дайте определение:. . Уровень 1 (оценка «3»). – необходимо ответить на любые 5 вопросов. Уровень ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:21 ноября 2018
Категория:Химия
Содержит:17 слайд(ов)
Поделись с друзьями:
Скачать презентацию