Презентация "Степень окисления" (8 класс) по химии – проект, доклад
Презентацию на тему "Степень окисления" (8 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 23 слайд(ов).
Слайды презентации
Список похожих презентаций
Степень окисления
Цель урока:. Разобраться, что такое «степень окисления» Научиться находить степень окисления по формуле. Поваренная соль NaCl. «Хлеб да соль» - пожелание ...Степень окисления
Цель урока:. Разобраться, что такое «степень окисления» Научиться находить степень окисления по формуле. Поваренная соль NaCl. «Хлеб да соль» - пожелание ...Степень окисления
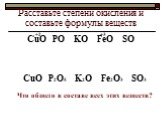
Задание № 1. Определить тип химической связи в молекулах: Na, NaCl, Cl2, HCl. Степень окисления. Степень окисления - это условный заряд атомов, вычисленный ...Степень окисления
Ковалентная неполярная связь.Ионная связь Na+1Cl-1, Ca+2F-12, Na+12O-2 Cl20, O20, N20 S0, P0, Si0.
Ковалентная полярная связь.
Si+4O-22 H+1F-1, ...
Соединения химических элементов. Степень окисления
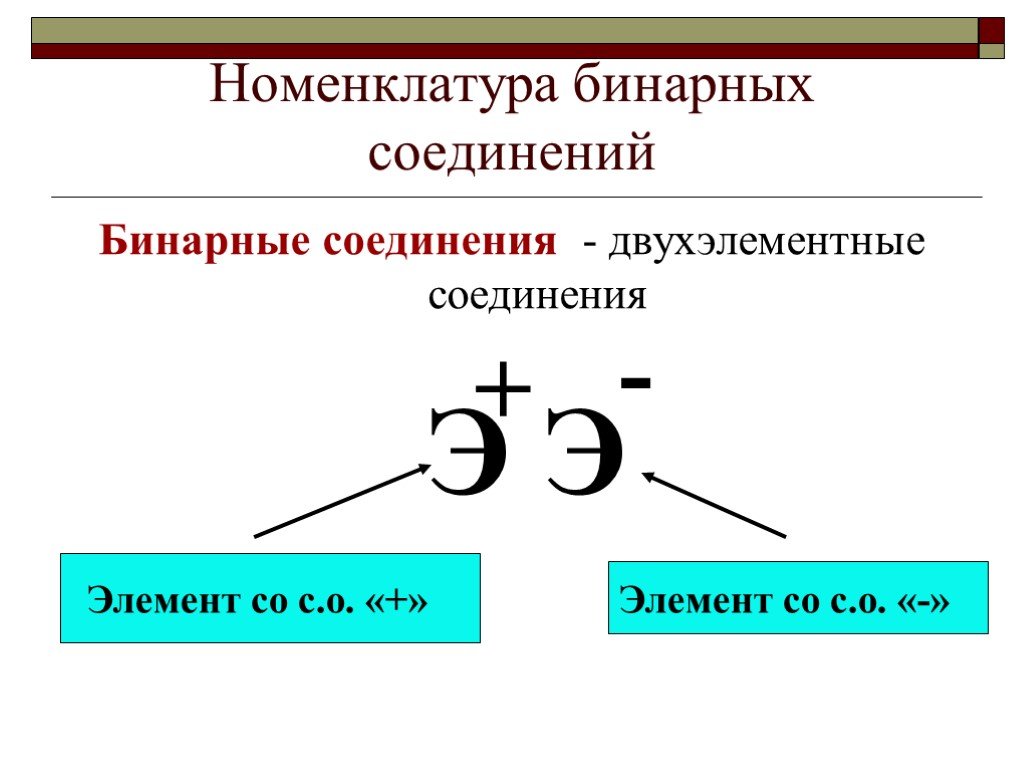
Бинарные соединения – сложные вещества, состоящие из двух химических элементов. NaCl Хлорид натрия Na0+Cl0=Na+Cl‾ Связь ионная +11Na )2)8)1 Атом натрия ...Химия. Готовимся к ЕГЭ. Степень окисления.
Аннотация. Ресурс по химии адресован учащихся 8,9,11-классов для организации самостоятельной работы в период подготовки к итоговой аттестации, а также ...Валентность и степень окисления
Из атомов мир создавала Природа. Два атома лёгких взяла водорода. Прибавила атом один кислорода. И получилась частица …. Н2О Почему такой состав имеет ...Типы окисления
Цели лекции. Формировать знания о типах окисления Сформировать знания об антиоксидантной системе организма. Задачи лекции. Дать понятие оксидазному ...Степени окисления соединений
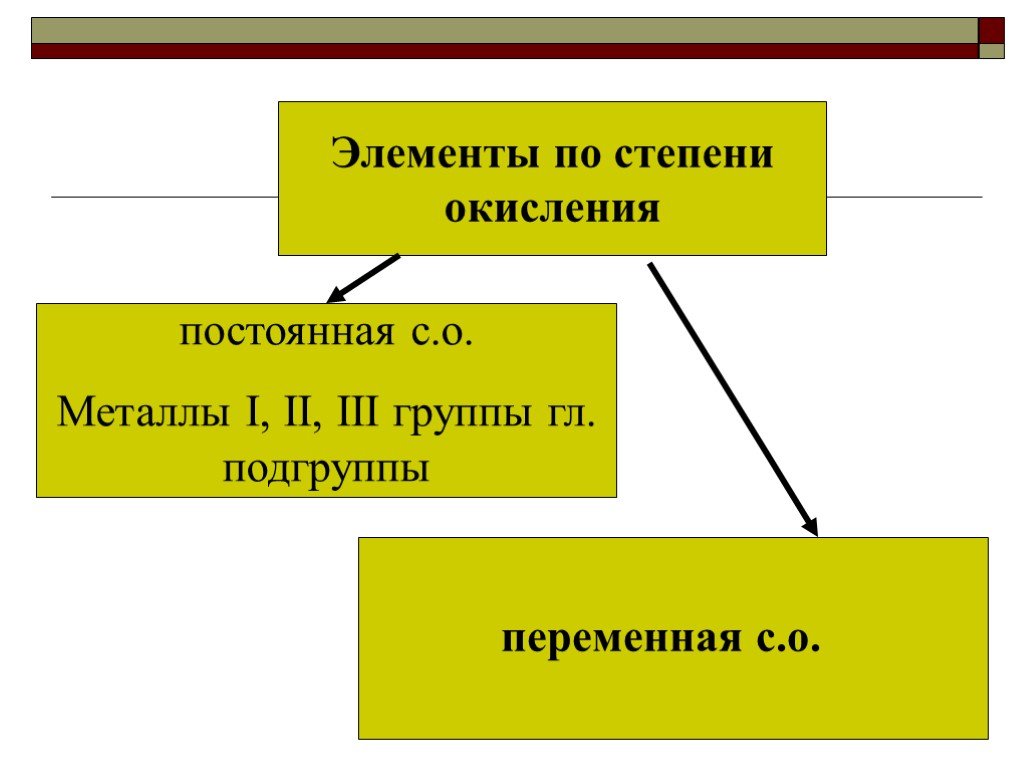
Степень окисления. Определяется количеством электронов, которое может отдавать или принимать элемент, вступая в соединение Условный заряд элемента, ...Составление химических формул бинарных соединений по степеням окисления
«Свои способности человек может узнать, только попытавшись приложить их» Сенека младший. Определите степени окисления элементов. Al2O3 Ca3N2 K2Se ...Составление химических формул бинарных соединений по степени окисления атомов
Цель урока. Обучить учащихся составлению химических формул бинарных соединений по степеням окисления. 1. Что называется степенью окисления. 2. Чем ...Реакции окисления и восстановления органических соединений
Реакции окисления-восстановления реакции, в ходе которых происходит изменение степени окисления одного или нескольких атомов углерода. 4 (3)+(+1)= ...Защита зоны электродуговой сварки от окисления
Окисление. В зоне сварки кислород является наиболее вредной примесью, так как окисляет элементы, которые входят в состав металла шва, и ухудшает его ...Своя игра. Физика и химия
Интегрированный урок ФИЗИКА+ХИМИЯ. Авторы: Орлова И.В., Шувалова Л.В. Муниципальное образовательное учреждение Фоминская средняя общеобразовательная ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Углеводы химия
Содержание. Классификация углеводов Моносахариды Нахождение в природе Изомерия Получение Физические свойства Химические свойства Источники информации. ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...Конспекты
Степень окисления. Реакции окисления – восстановления
Урок- упражнение , 8 класс. Степень окисления. Реакции окисления – восстановления. . . Цели урока:. Образовательные:. - повторить основные ...Степень окисления элементов
Тема урока: Степень окисления элементов. . Цели. урока. 1.Образовательные. :. Сформулировать понятие о степени окисления. Научить определять ...Степень окисления. Окислительно-восстановительные реакции
Казахстан, Северо-Казахстанская область, район имени Габита Мусрепова, село Сокологоровка. КГУ «Сокологоровская средняя школа». ...Степень окисления
Класс:. 8. Предмет:. химия. Общая тема:. Соединения химических соединений. Автор учебника и УМК:. Габриелян О. С. Химия. 8 кл. — М.: Дрофа, 2006—2008; ...Степень окисления
Урок химии в 8 классе по теме. «Степень окисления». Задачи:. образовательные - актуализировать знания о строение атомов металлов и неметаллов, ...Степень окисления
Урок по теме «Степень окисления» с мультимедийным приложением. Цель:. сформировать понятие о степени окисления на основании знаний учащихся о видах ...Степень окисления
Конспект урока. . Тема урока: Степень окисления. . Тип урока:. изучение нового материала. Цели урока. :. . 1.Сформировать умения определять ...Валентность и степень окисления атомов. Периодичность в изменении свойств соединений элементов
План учебного занятия №4. . Дата Предмет. химия. группа. Ф.И.О. преподавателя:. Кайырбекова И.А. . І. Тема занятия:. . Валентность и степень ...Валентность и степень окисления атомов
Тема урока: «Валентность и степень окисления атомов». Цель урока:. Определить понятие валентности и степени окисления атомов. . Задачи:. . обучающие:. ...Слабые и сильные электролиты. Степень диссоциации
Дата ____________ Класс _____________. Тема: Слабые и сильные электролиты. Степень диссоциации. Цели урока:. сформировать понятия о сильных и ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:10 сентября 2018
Категория:Химия
Классы:
Содержит:23 слайд(ов)
Поделись с друзьями:
Скачать презентацию