Презентация "Основания и их классификация" по химии – проект, доклад
Презентацию на тему "Основания и их классификация" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 25 слайд(ов).
Слайды презентации
Список похожих презентаций
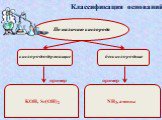
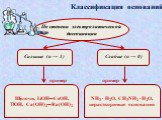
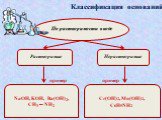
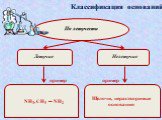
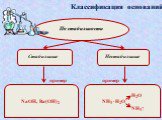
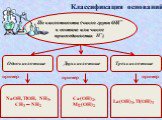
Основания, их классификация
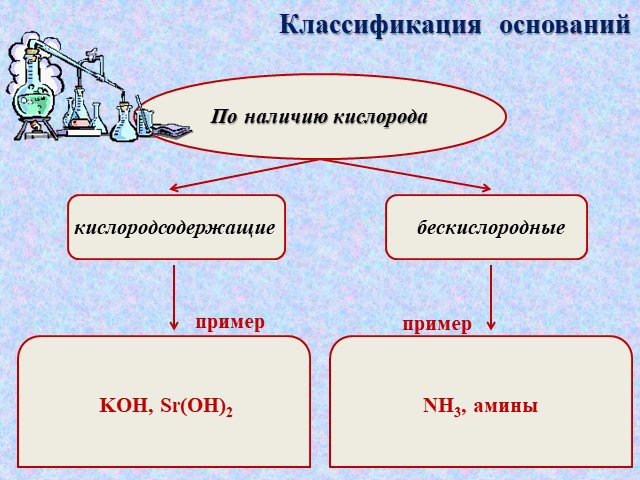
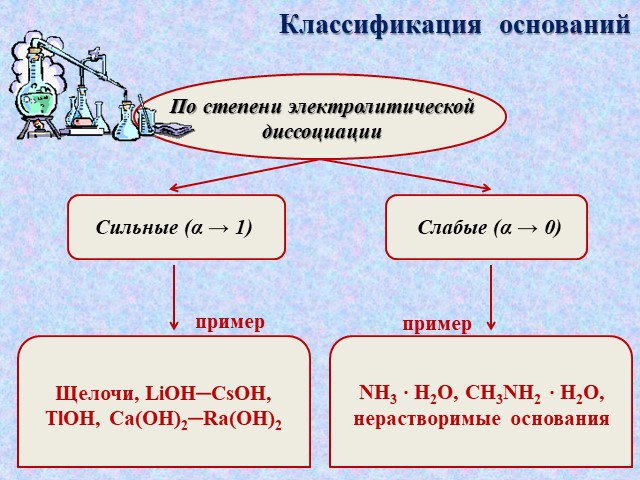
NаОН, КОН, Са(ОН)2, Fе(ОН)3. :. Основания - это сложные вещества, в которых атом металла связан с одной или несколькими гидроксогруппами (ОН). Общая ...Обобщение темы: «Кислоты, основания, оксиды и соли, их классификация и свойства»
Вопрос №1. Сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид – ионов, называются: 1) кислоты 2) основания 3) оксиды 4) соли ...Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации. 1) сформировать понятие об основаниях как электролитах; 2) рассмотреть ...Кислоты, их классификация и свойства
images.yandex.ru. Дайте характеристику оксидам. Металла(неметалла) Солеобразующий (несолеобразующий) Кислотный (основный). MgO CO SiO2 CO2 N2O5 Li2O. ...Дисперсные системы, их классификация.
Цели урока. 1.Получить представление о дисперсных системах в природе и производственных процессах. 2.Формировать понятие о единстве мира на примере ...Оксиды, их классификация и свойства
Что такое оксиды? Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2. Классификация ...Биогенная классификация химических элементов
бром железо натрий. Элементы необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами. Введение в ...Оксиды, их классификация
Это газ, необходимый растениям для фотосинтеза. Это газ, выделяемый нами при выдохе. Что это за газ? … на рукомойнике моём Позеленела медь, Но так ...Оксиды, их применение
Один из распространенных оксидов – диоксид углерода CO2 – содержится в составе вулканических газов. В природе. Газ, необходимый растениям для фотосинтеза. ...Нитраты, их влияние на организм человека
Цель работы. Изучить литературу о нитратах и нитритах, овладеть методикой их определения, определить содержание нитратов и нитритов в разных сортах ...Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение.
Залежи нефти находятся в недрах Земли на разной глубине, где нефть заполняет свободное пространство между некоторыми породами. Сегодня нефть является ...Неметаллы и их характеристика
Разгадайте ребусы и назовите три химических элемента названия которых здесь зашифрованы:. уГ+лес,Т=Д , газ + , ,,,+. К какой группе относятся эти ...Ароматические эфирные масла и их использование
Объект исследования:. Ароматические эфирные масла. Предмет исследования:. влияние ароматических масел на организм человека; эфирные масла – натуральные ...Основания
Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними ионов гидроксильных групп. Валентность гидроксогруппы –. Количество ...Галогены и их соединения
СОДЕРЖАНИЕ. 1. Общая характеристика галогенов 2. Фтор 3. Хлор 4. Бром 5. Йод 6. Соединения галогенов. Общая характеристика галогенов. Hal неметаллы ...Галогены и их соединения
Цели урока:. Рассмотреть свойства и применение важнейших соединений галогенов. Изучить качественные реакции на галогенид-ионы. Рассмотреть свойства ...Галогены и их соединения
Опыт и наблюдение- таковы величайшие источники мудрости, доступ к которым открыт для каждого человека. (Чаннинг.). Вопросы:. Что такое «вытеснительный ...Влияние тепловой кулинарной обработки овощей и хранения их в горячем состоянии на содержание витамина С
Проблема Как при тепловой кулинарной обработке овощей и хранения их в горячем состоянии сохранить витамин С ? Цель Определить степени изменения содержания ...Вещества и их свойства
Физические тела – любые предметы, имеющие форму и объем. Например, физическими телами являются самые разнообразные предметы: алюминиевая ложка, гвоздь, ...Биополимеры и их структурные компоненты
«жизнь – это особая форма существования биополимерных тел (систем), характеризующихся хиральной чистотой и способностью к самоорганизации и саморепликации ...Конспекты
Основания, их классификация и свойства
Клюкина Ольга Владимировна, учитель химии МАОУ Банниковская СОШ. . Химия 8 класс. Тема урока: «Основания, их классификация и свойства». Цели:. ...Основания, их классификация и свойства
Урок №68. Тема урока:. Основания, их классификация и свойства. Л.р.№15 «Химические свойства оснований». Цели и задачи урока:. Углубить знания ...Основания, их классификация и химические свойства в свете теории электролитической диссоциации
ТЕМА УРОКА :. Основания, их классификация и химические свойства в. . свете теории электролитической диссоциации. . . II. слайд:. ЦЕЛЬ УРОКА:. ...Оксиды, их классификация и свойства
Тема урока. Оксиды, их классификация и свойства. Цель:. Формирование целостного представления об оксидах, как классе неорганических соединений. ...Соли, их классификация и химические свойства в свете теории электролитической диссоциации
Муниципальное общеобразовательное учреждение. . средняя общеобразовательная школа №2. г. Алексеевки Белгородской области. Конспект ...Номенклатура и классификация неорганических соединений
Проверочная работа. по теме «Номенклатура и классификация неорганических соединений». (11 класс). Вариант № 1. 1. . Назовите . соединения:. ...Оксиды, их классификация и свойства
Тимофеева Ольга Николаевна. . Приложение 4.1.4. Конспект урока химии. Тема урока:. Оксиды, их классификация и свойства. Класс: 8. . Тип ...Классификация химических реакций и закономерности их протекания
Практическая работа №2. . «Решение экспериментально-теоретических задач по теме «Классификация химических реакций и закономерности их протекания»». ...Основания, их состав, названия. Щелочи. Индикаторы
Тема урока:. Основания, их состав, названия. Щелочи. Индикаторы. Цели урока:. -. сформировать знания о составе оснований, валентности. . гидроксильной ...Кислоты, их состав, классификация и значение
Тема урока:. «Кислоты, их состав, классификация и значение.». Задачи урока:. Образовательные:. . Рассмотреть состав и классификацию кислот;. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Ефремова С.А., учитель химии
Содержит:25 слайд(ов)
Поделись с друзьями:
Скачать презентацию





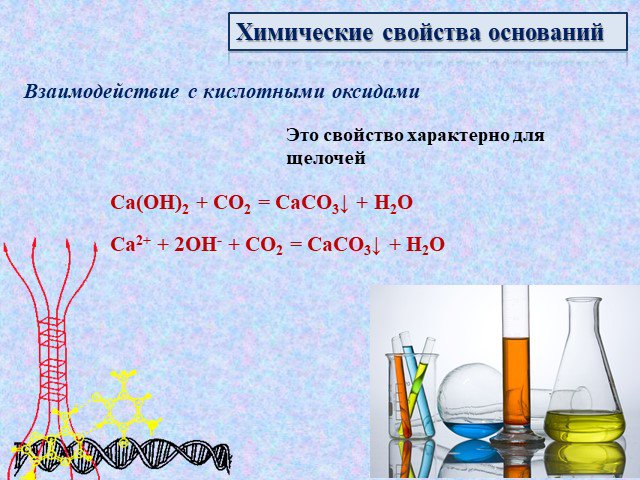

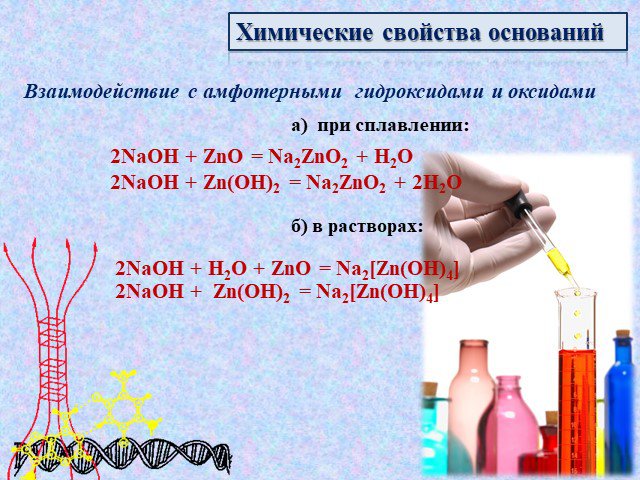


















![Взаимодействие с амфотерными гидроксидами и оксидами. а) при сплавлении: 2NaOH + ZnO = Na2ZnO2 + H2O 2NaOH + Zn(OH)2 = Na2ZnO2 + 2H2O б) в растворах: 2NaOH + H2O + ZnO = Na2[Zn(OH)4] 2NaOH + Zn(OH)2 = Na2[Zn(OH)4] Взаимодействие с амфотерными гидроксидами и оксидами. а) при сплавлении: 2NaOH + ZnO = Na2ZnO2 + H2O 2NaOH + Zn(OH)2 = Na2ZnO2 + 2H2O б) в растворах: 2NaOH + H2O + ZnO = Na2[Zn(OH)4] 2NaOH + Zn(OH)2 = Na2[Zn(OH)4]](https://prezentacii.org/upload/cloud/14/09/4700/images/thumbs/screen13.jpg)