Презентация "Оксид серы (IV). Сернистая кислота" по химии – проект, доклад
Презентацию на тему "Оксид серы (IV). Сернистая кислота" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 22 слайд(ов).
Слайды презентации
Список похожих презентаций
Оксид углерода (IV) - углекислый газ
Физические свойства CO2. Оксид углерода (IV) – бесцветный газ, без запаха, со слегка кисловатым вкусом; примерно в 1,5 раза тяжелее воздуха, хорошо ...Токсикологическая характеристика оксидов серы
Физические свойства. SO2 (серистый ангидрид; сернистый газ). SO3 (серный ангидрид). Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) ...азотная кислота
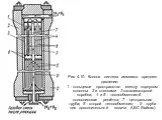
Рисунок 1.2 – Четырехполочная колонна синтеза аммиака мощностью 1360 т/сут 1 – люк для выгрузки катализатора; 2 – центральная труба; 3 – корпус катализа-торной ...Серная кислота
Серная кислота. Ar S 1s2 2s2 2p4 О Н. Структурная формула. H O. Химические свойства. H2SO4 H+→ H0 S+6→ S+4. Разбавленная серная кислота. + Оксиды ...Азотная кислота
Разминка:. А1. Степень окисления азота в азотной кислоте 1) +4 2) +5 3) +2 4) +3. Подготовка к Е Г Э. А 2. По физическим свойствам азот и аммиак 1) ...Химические свойства серы
Цель урока. Охарактеризовать серу в свете трёх форм существования этого химического элемента: в форме атомов, простого вещества, а следовательно, ...Соединения серы
Оксид серы (VI). Физические свойства серной кислоты. Безводная серная кислота - это бесцветная маслянистая жидкость без запаха, смешивается с водой ...Соляная кислота и её соли
« Просто знать - ещё не всё, знания нужно уметь использовать». Гёте. видео. Получение соляной кислоты:. 1.В промышленности получают сжиганием водорода ...Азотная кислота и ее соли
План изучения азотной кислоты. 1.Состав . 2.Строение. 3.Физические свойства. 4.Химические свойства. 5.Получение и применение. Состав и строение азотной ...Серная кислота 1
Цель урока. Изучить химические свойства и стадии получения серной кислоты. Химические свойства. С основаниями (реакция нейтрализации) H2SO4 + NaOH ...Азотная кислота и её свойства
Индивидуальная работа. Осуществите превращения 1 вариант: N2 → NO→NO2 2 вариант: N2→NH3→(NH4)SO4 3 вариант: NH3→N2→K3N. HNO. Содержание. Структурная ...Азотная кислота и её соли
Вспомните! Какие степени окисления проявляет азот в своих оксидах? Какие окислы азота вы знаете? Расскажите о N2O, NO, NO2? Какое из этих соединений ...Азотная кислота и ее свойства
Сегодня на уроке мы должны:. записать молекулярную и структурную формулы азотной кислоты; изучить химические свойства азотной кислоты в свете ОВР; ...Азотная кислота
«Азотная кислота».Тема урока:. I. Строение молекулы.
Электронная формула :O : H :O: N : :O.
Структурная формула O // H ─ O ─ N \\ O.
Молекулярная ...
Азотная кислота
НЕМНОГО ИСТОРИИ. Монах-алхимик Бонавентура в 1270 году в поисках универсального растворителя «алкагеста» решил нагреть смесь железного купороса с ...Серная кислота
Оглавление. Определение и свойства Название Олеум Химические свойства История Сырье для производства Стадии получения Процесс добычи. Серная кислота. ...Азотная кислота и ее соли
Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде «Ямщик мудрости», а с ХV века это вещество добывалось ...Серная кислота
Характеристика кислоты. Получение. Химические свойства. Соли Применение ВЫВОД. Серная кислота в природе. С О Д Е Р Ж А Н И Е. Физические свойства. ...Азотная кислота и её соли
Познакомиться с азотной кислотами, её солями- нитратами, их физическими и химическими свойствами ; Экспериментально изучить свойства азотной кислоты ...Серная кислота урок
Девиз урока:. «Лик планеты химически резко меняется человеком сознательно и главным образом бессознательно» (В. И. Вернадский). Цель урока:. Вспомнить ...Конспекты
Оксид серы (VI). Серная кислота
муниципальное бюджетное общеобразовательное учреждение. средняя общеобразовательная школа № 44 города Кропоткин. . муниципального образования ...Оксид серы (VI), серная кислота
МКОУ «СОШ а.Жако». Разработка урока по химии в 9 классе на тему:. Оксид серы (VI. ), серная кислота. Учитель ...Оксид серы (VI). Серная кислота и её соли
Дата_____________ Класс_______________. Тема: Оксид серы (VI). Серная кислота и её соли. Цели урока:. познакомить учащихся со свойствами серной ...Оксиды серы. Серная кислота
Тема:. Оксиды серы. Серная кислота. . Цели:. Ознакомить. учащихся физическими и химическими свойствами оксида серы и серной кислоты. Формировать. ...Сера и ее соединения. Аллотропия серы. Сероводород. Оксиды серы
Тема: Сера и ее соединения. Аллотропия серы. Сероводород. Оксиды серы (. IV, VI. ). . Цели урока:. рассмотреть вещество «сера», аллотропию серы, ...Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения
Дата_____________ Класс_______________. Тема:. . Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения. Цели урока:. знать ...Сернистый газ. Сернистая кислота и её соли
Дата_____________ Класс_______________. Тема: Сернистый газ. Сернистая кислота и её соли. Цели урока:. рассмотреть сернистую кислоту и ее соли, ...Оксид фосфора (V). Фосфорная кислота и ее соли
Плесовских Ольга Анатольевна. учитель химии. МОУ «Средняя общеобразовательная школа №2 г. Надыма». Конспект урока. Тема: Оксид фосфора ...Серная кислота
Казенное общеобразовательное учреждение. «Вечерняя (сменная) общеобразовательная школа 1». г. Омска. Конспект урока по химии. в 9 классе. ...Сера. Сероводород. Сероводородная кислота
Тема:. Сера. Сероводород. Сероводородная кислота. Цели:. Способствовать. формированию знаний у учащихся о положении серы в ПСХЭ. Ознакомить. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:12 декабря 2018
Категория:Химия
Содержит:22 слайд(ов)
Поделись с друзьями:
Скачать презентацию