Презентация "Электролитическая диссоциация" (8 класс) по химии – проект, доклад
Презентацию на тему "Электролитическая диссоциация" (8 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 13 слайд(ов).
Слайды презентации
Список похожих презентаций
Электролитическая диссоциация кислот
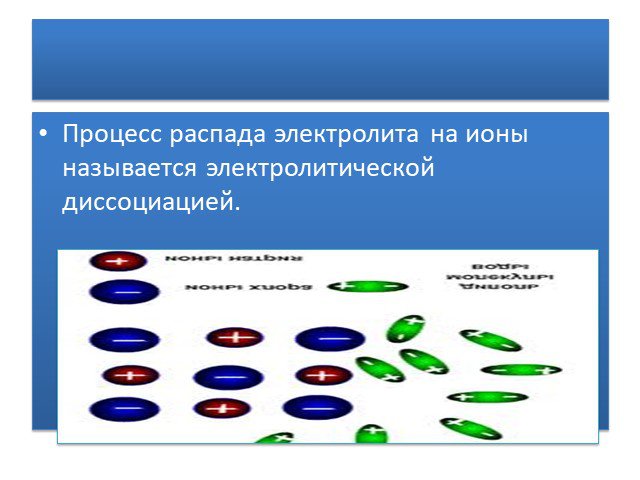
HCl ↔. 1. Запишите уравнение электролитической диссоциации молекулы соляной кислоты. HCl ↔ H HCl ↔ H+ HCl ↔ H+ + HCl ↔ H+ + Cl HCl ↔ H+ + Cl- 2HCl ...Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах
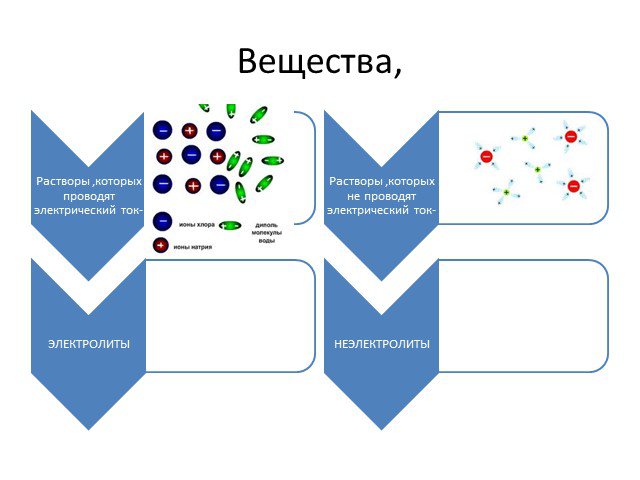
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ Растворы всех веществ можно разделить на две группы: проводят электрический ток или проводниками не являются. ...Электролитическая диссоциация
вещества, растворы и расплавы которых проводят электрический ток. Вещества. Электропроводность. Электролиты Неэлектролиты. вещества, растворы и расплавы ...Электролитическая диссоциация веществ. Реакции ионного обмена и условия их протекания
1. Веществом, при диссоциации которого образуются катионы металла и анионы кислотного остатка, является. А. NH4NO3 Б. HNO3 В. NaOH Г. Na2SO4. 2. К ...Электролитическая диссоциация
Прибор для определения электропроводности. Электролиты – это вещества, водные растворы которых проводят электрический ток. Проверка электропроводности ...Электролитическая диссоциация
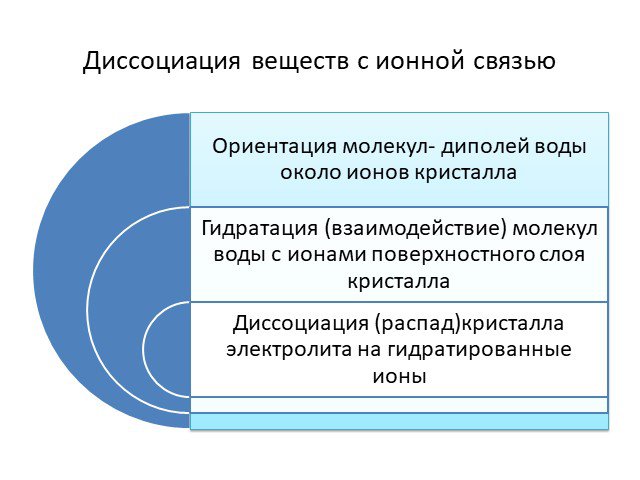
Русецкая О.П.Электролитическая диссоциация. 1 1. Рис.1 Электролиты Неэлектролиты. «Капля воды и камень точит».
1. Электролиты и неэлектролиты. ...
Электролитическая диссоциация
Вещества. ЭЛЕКТРОЛИТЫ НЕЭЛЕКТРОЛИТЫ. Неэлектролиты – вещества, растворы и расплавы которых не проводят электрический ток. Электролиты – вещества, ...Электролитическая диссоциация
Цели урока. Обобщить сведения об ионах Закрепить умение записывать процесс диссоциации при помощи химических знаков и формул Сформулировать основные ...Классы неорганических веществ. Электролитическая диссоциация
К Л А С С Ы Н Е О Р Г А Н И Ч Е С К И Х В Е Щ Е С Т В. ф о р м у л а к с и д ы т н в я е й щ ч 1 2 4 5 6 7 8 9 10. 3. Вещества, окрашивающие индикаторы ...«Растворы. Электролитическая диссоциация»
…у тебя нет ни вкуса, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что необходима для жизни: ты ...Процессы в растворах электролитическая диссоциация
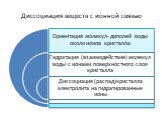
Вещества. Электролиты - вещества, растворы и расплавы которых не проводят электрический ток. Неэлектролиты - вещества, растворы и расплавы которых ...Конспекты
Электролитическая диссоциация кислот, щелочей и солей
Дата ____________ Класс _____________. Тема:. Электролитическая диссоциация кислот, щелочей и солей. Цели урока:. рассмотреть свойства кислот, ...Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах
Дата _______________ Класс ___________. Тема:. Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах. Цели урока:. ...Электролитическая диссоциация
Дата _____________ Класс ___________________. Тема:. Практическая работа №1 Решение экспериментальных задач по теме «Электролитическая диссоциация». ...Электролитическая диссоциация
Учитель химии МОУ гимназии № 32. . Кудравец Е.А. . Дидактическая разработка урока в 8 классе. «Электролитическая диссоциация». Цель урока:. ...Электролитическая диссоциация
Тема урока. Электролитическая диссоциация. Электролиты и неэлектролиты. . . Тип урока. урок изучения нового материала, урок-исследование. . ...Электролитическая диссоциация
Черкашина Л.И.,. . КГУ СОШ №. 32. г. Караганда. Тема: Электролитическая диссоциация. (Урок – обобщения). 9 класс. Цели:. . 1). . Обобщить, ...Электролитическая диссоциация
Тема урока:. Электролитическая диссоциация. Цели урока:. 1)Сформировать понятия об электролитах и неэлектролитах. 2)Рассмотреть механизм ...Электролитическая диссоциация
Кузьмина Светлана Ниловна, учитель химии МБОУ «Гимназия №1» г. Чебоксары. Тема «Электролитическая диссоциация». Цель урока:. формирование ...Электролитическая диссоциация
Методическая разработка урока. . в 8 классе по теме. «ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ». Рыбакова Лариса Юрьевна. ,. муниципальное общеобразовательное ...Электролитическая диссоциация
"Электролитическая диссоциация". Урок обобщения знаний с мультимедийным сопровождением.(слайд 1). Цели:. - обобщить, систематизировать и углубить ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 января 2015
Категория:Химия
Классы:
Содержит:13 слайд(ов)
Поделись с друзьями:
Скачать презентацию