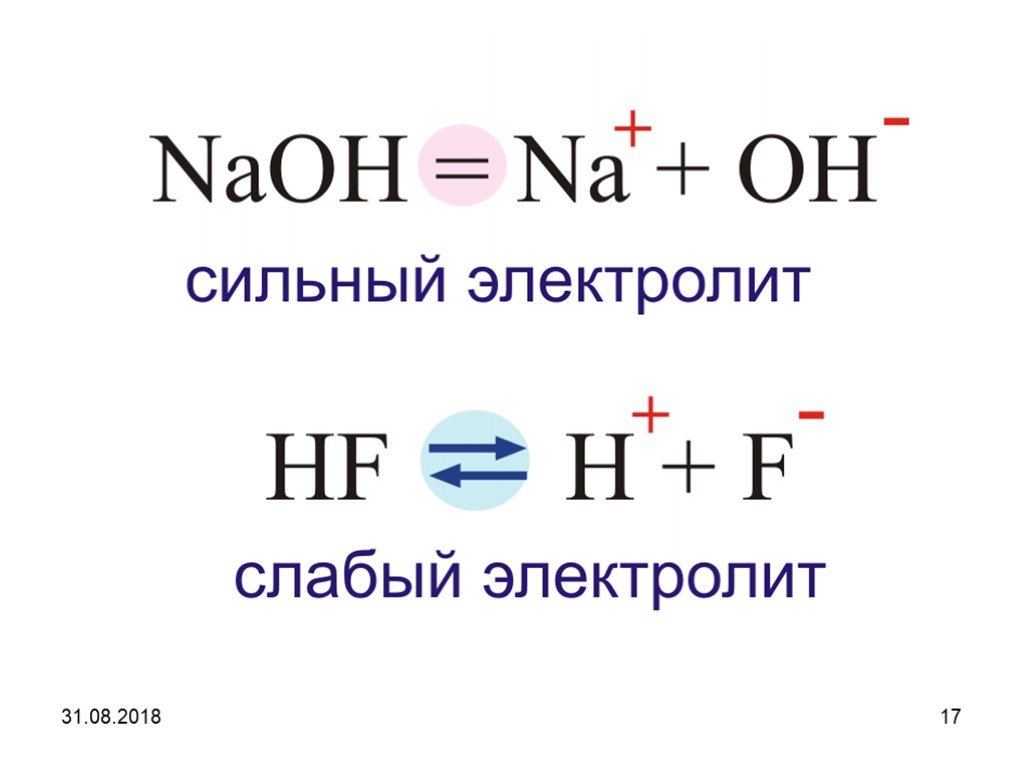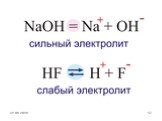Презентация "Электролитическая диссоциация" (9 класс) по химии – проект, доклад
Презентацию на тему "Электролитическая диссоциация" (9 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 21 слайд(ов).
Слайды презентации
Список похожих презентаций
«Электролитическая диссоциация» химия
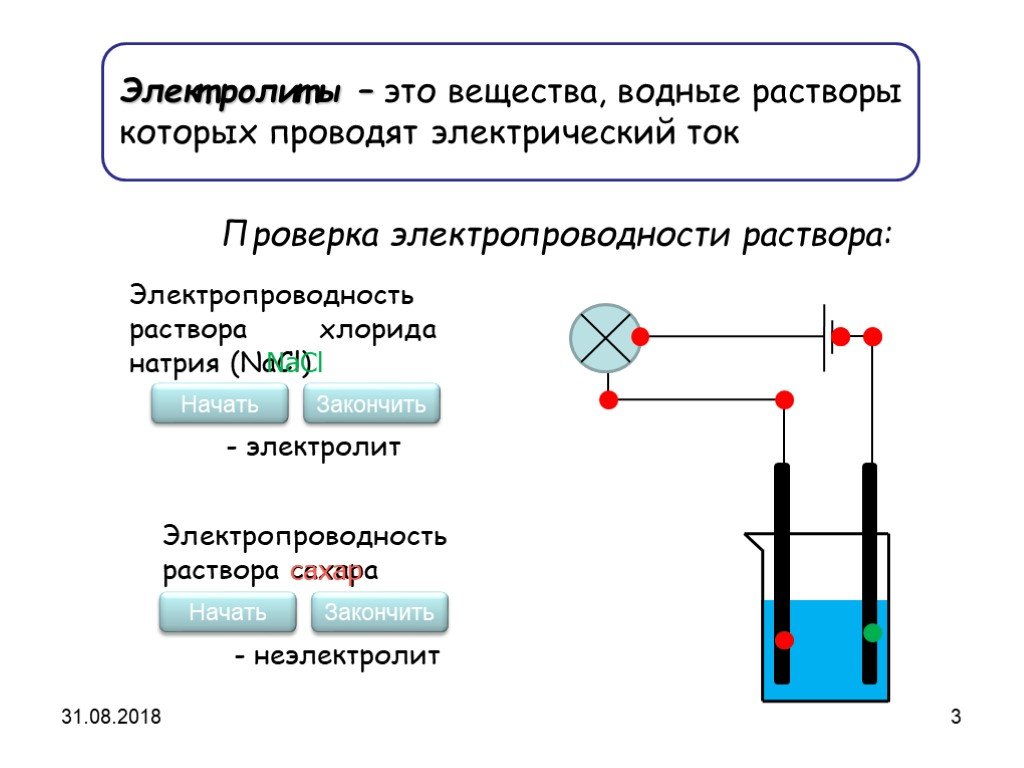
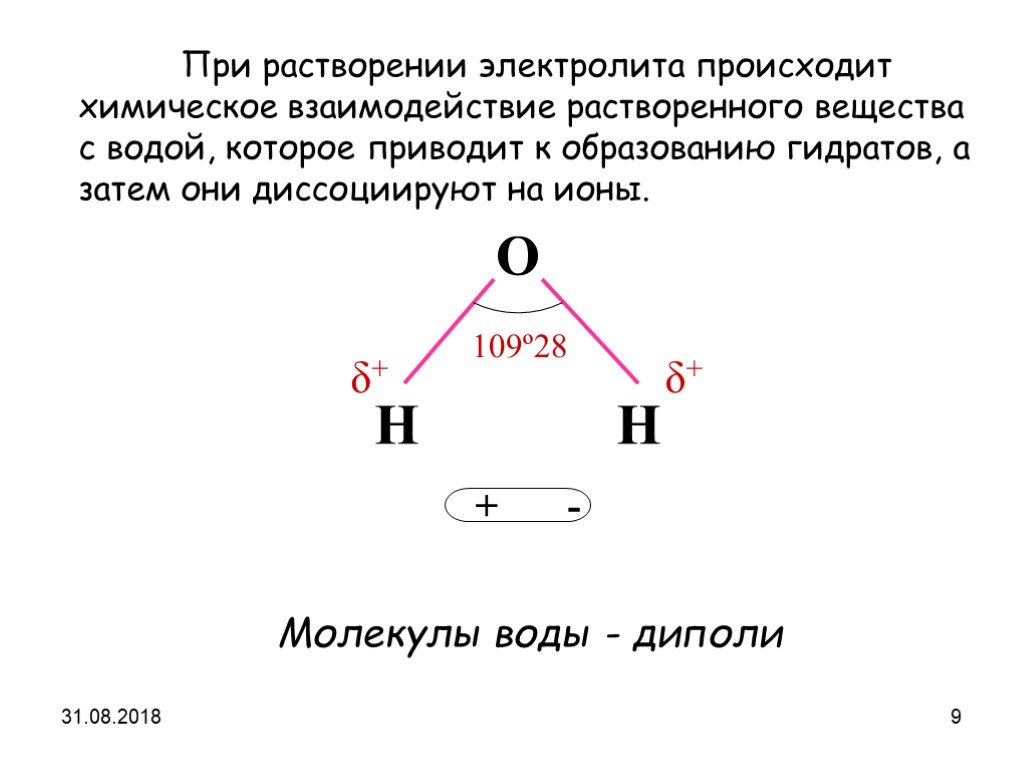
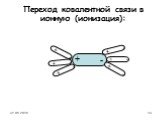
Электролитическая диссоциация. H2O. Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электролитической диссоциацией. ...«Растворы. Электролитическая диссоциация»
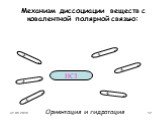
…у тебя нет ни вкуса, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что необходима для жизни: ты ...Электролитическая диссоциация кислот
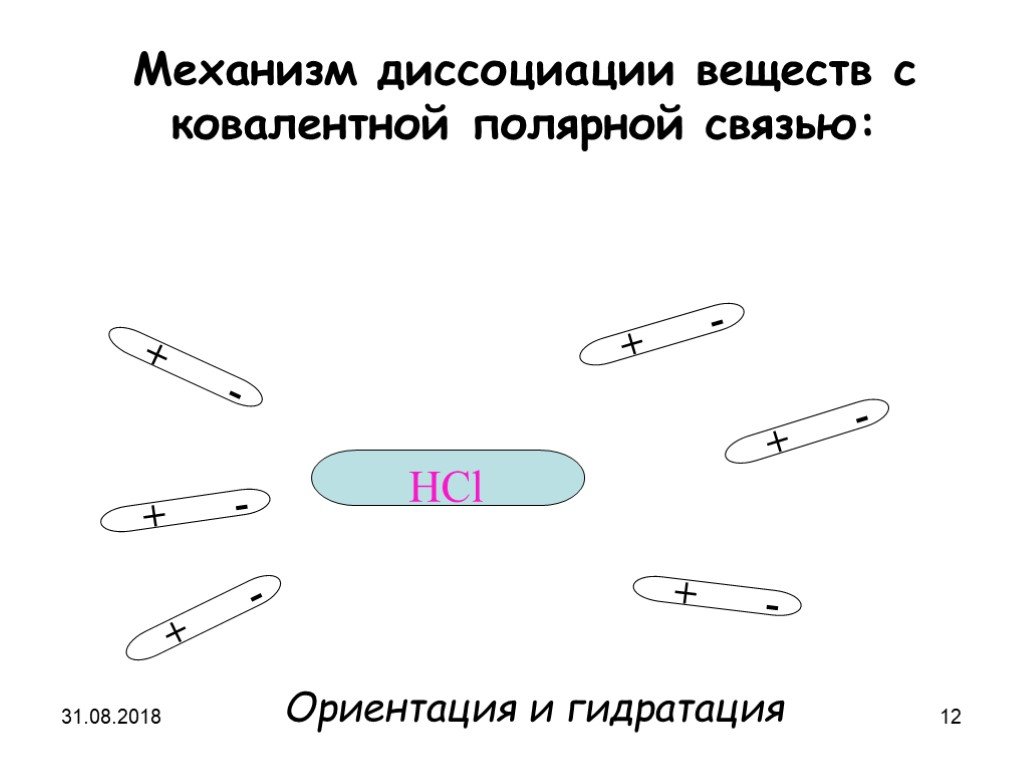
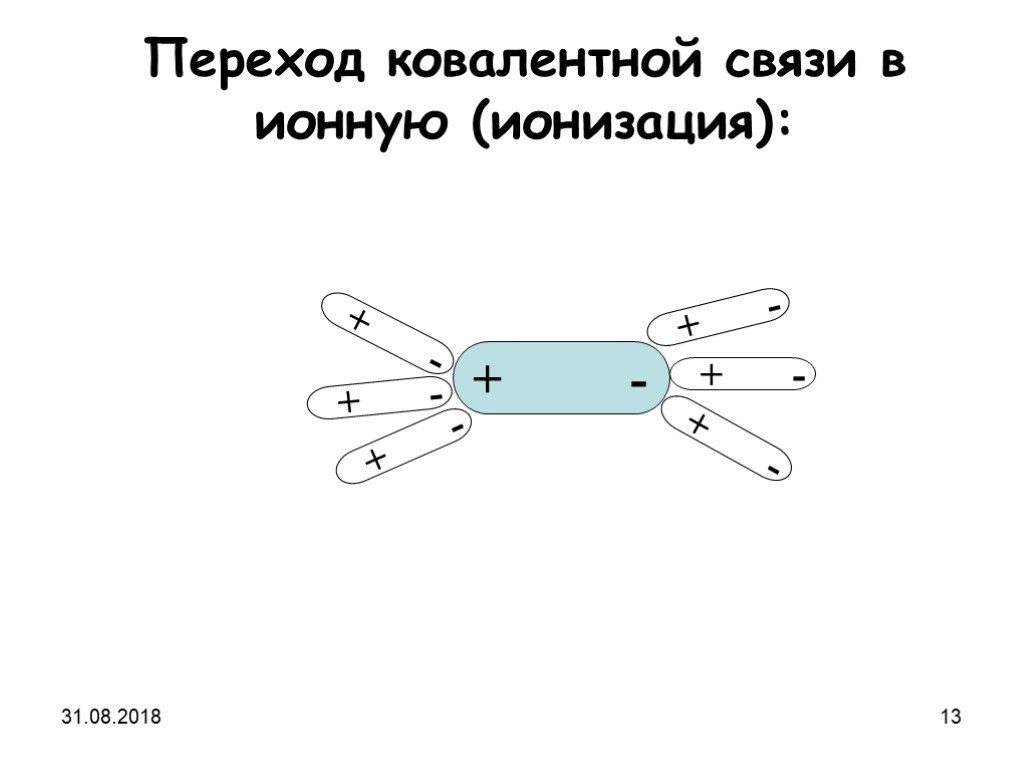
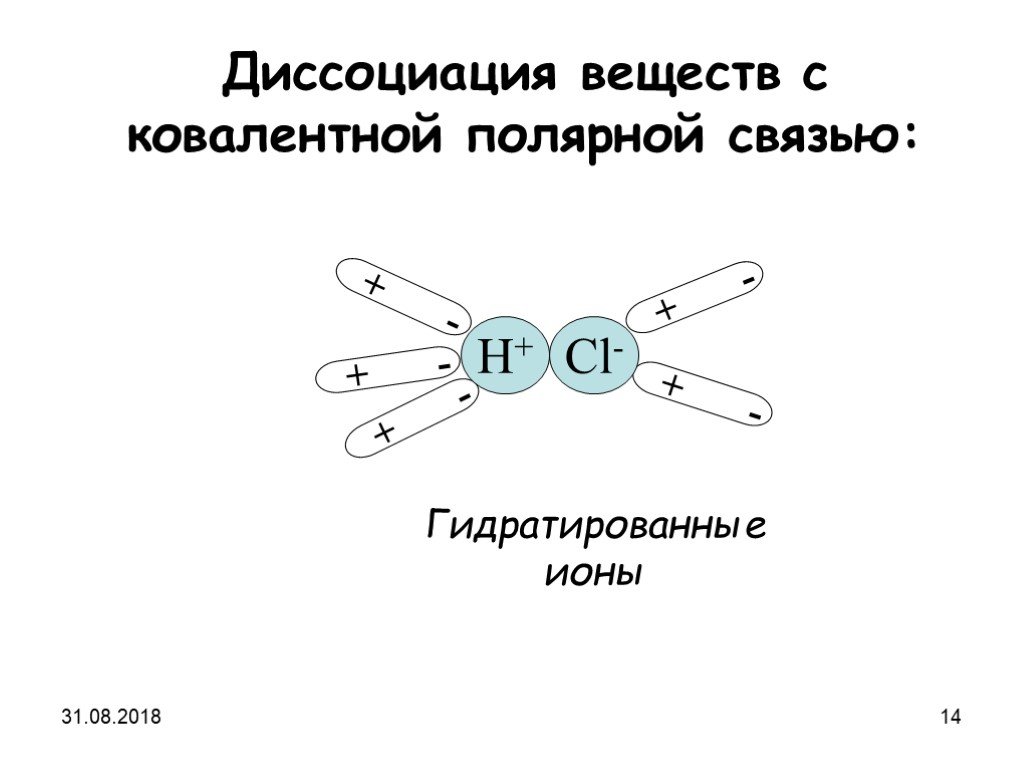
HCl ↔. 1. Запишите уравнение электролитической диссоциации молекулы соляной кислоты. HCl ↔ H HCl ↔ H+ HCl ↔ H+ + HCl ↔ H+ + Cl HCl ↔ H+ + Cl- 2HCl ...Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах
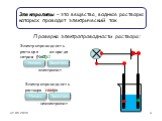
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ Растворы всех веществ можно разделить на две группы: проводят электрический ток или проводниками не являются. ...Электролитическая диссоциация
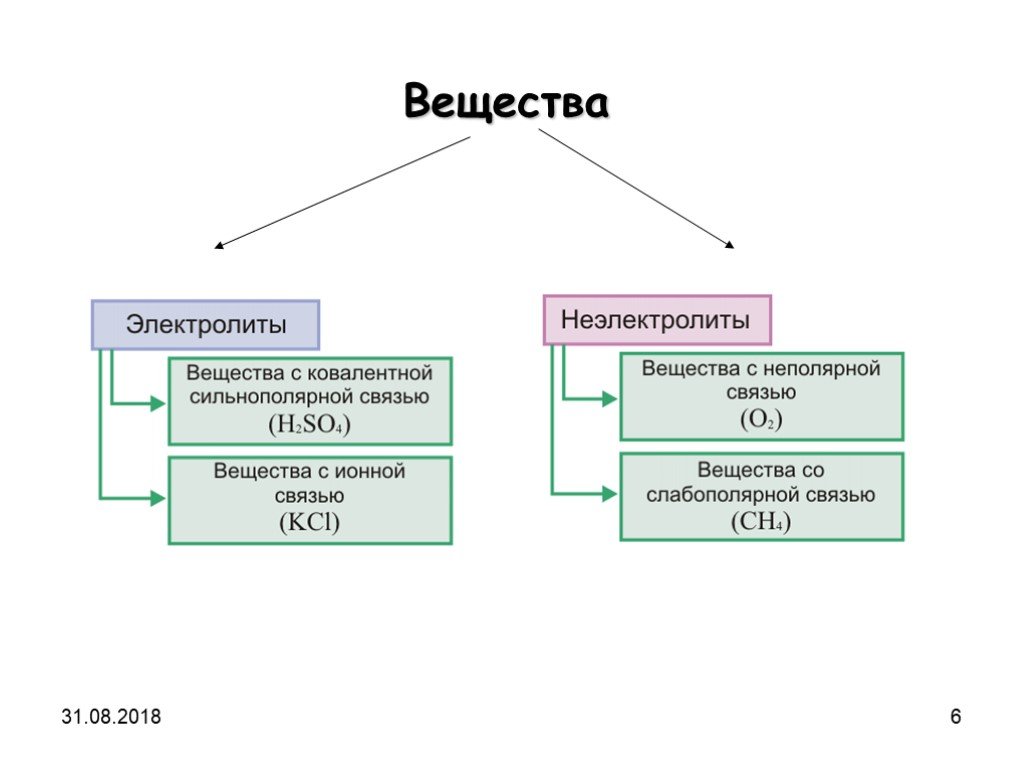
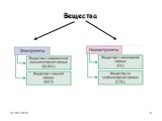
вещества, растворы и расплавы которых проводят электрический ток. Вещества. Электропроводность. Электролиты Неэлектролиты. вещества, растворы и расплавы ...Электролитическая диссоциация веществ. Реакции ионного обмена и условия их протекания
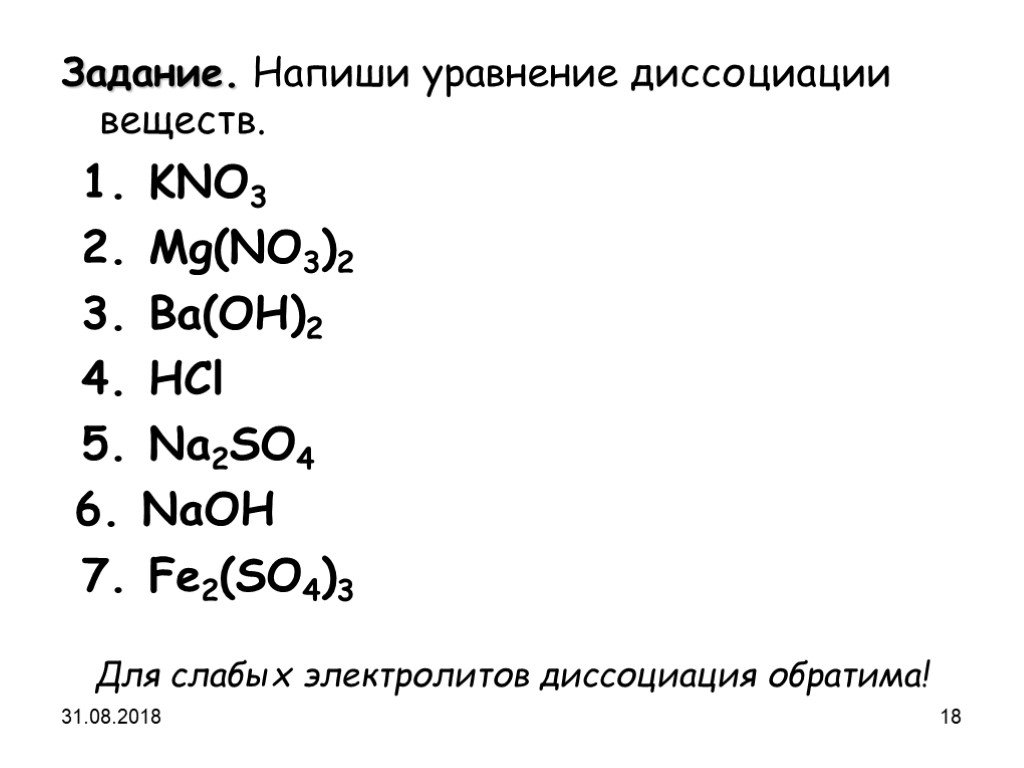
1. Веществом, при диссоциации которого образуются катионы металла и анионы кислотного остатка, является. А. NH4NO3 Б. HNO3 В. NaOH Г. Na2SO4. 2. К ...Электролитическая диссоциация
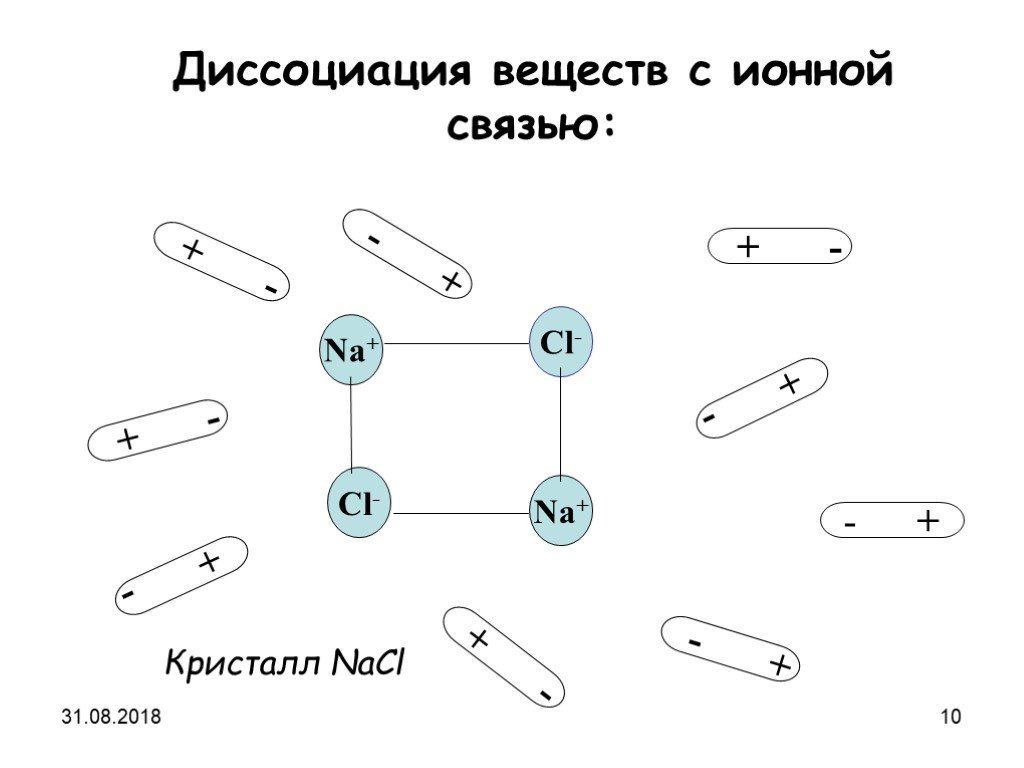
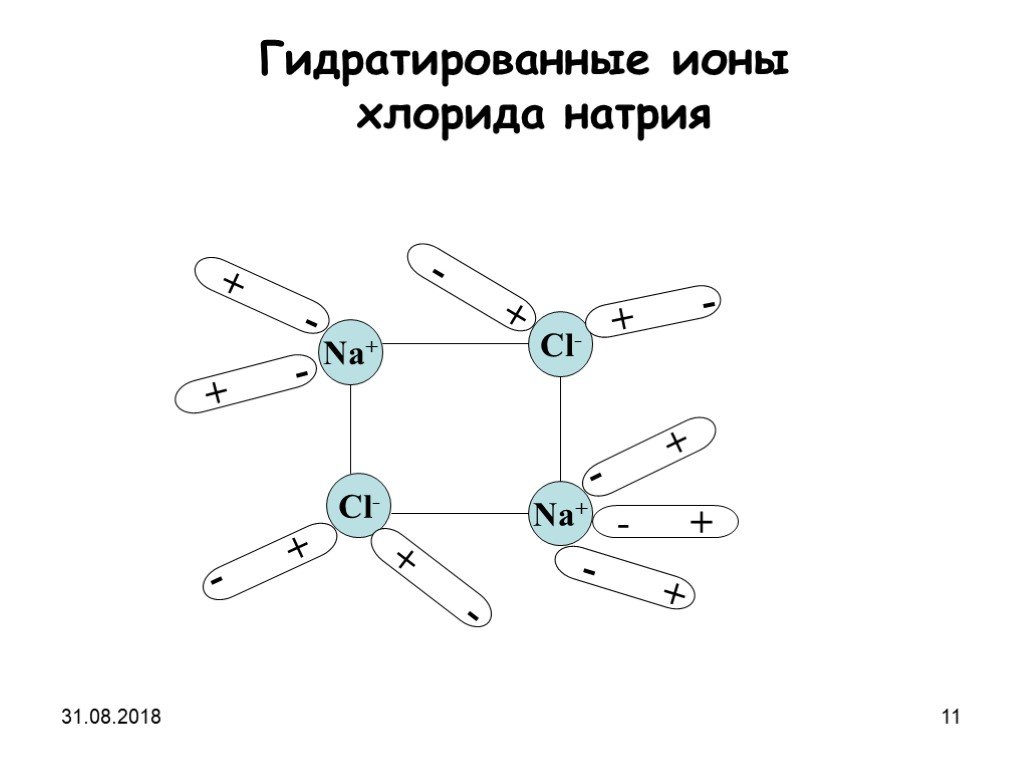
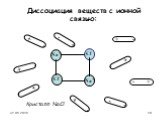
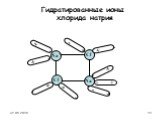
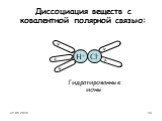
Процесс распада электролита на ионы называется электролитической диссоциацией. Вещества,. Диссоциация веществ с ионной связью. Диссоциация веществ ...Электролитическая диссоциация
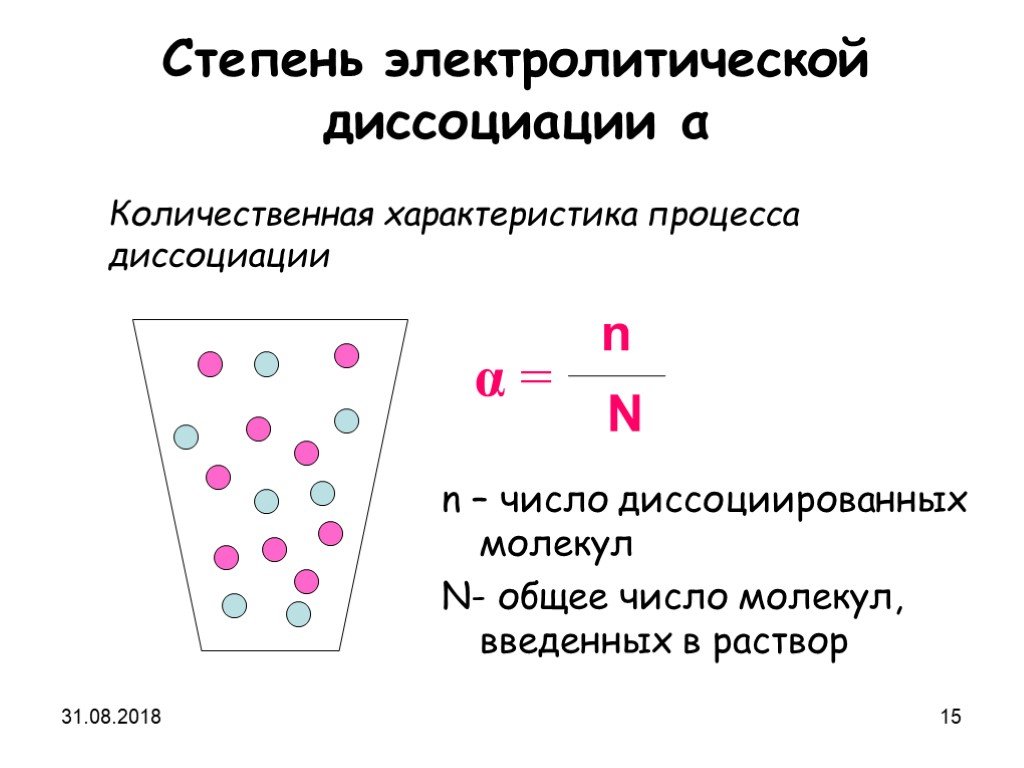
Русецкая О.П.Электролитическая диссоциация. 1 1. Рис.1 Электролиты Неэлектролиты. «Капля воды и камень точит».
1. Электролиты и неэлектролиты. ...
Электролитическая диссоциация
Вещества. ЭЛЕКТРОЛИТЫ НЕЭЛЕКТРОЛИТЫ. Неэлектролиты – вещества, растворы и расплавы которых не проводят электрический ток. Электролиты – вещества, ...Электролитическая диссоциация
Цели урока. Обобщить сведения об ионах Закрепить умение записывать процесс диссоциации при помощи химических знаков и формул Сформулировать основные ...Классы неорганических веществ. Электролитическая диссоциация
К Л А С С Ы Н Е О Р Г А Н И Ч Е С К И Х В Е Щ Е С Т В. ф о р м у л а к с и д ы т н в я е й щ ч 1 2 4 5 6 7 8 9 10. 3. Вещества, окрашивающие индикаторы ...Процессы в растворах электролитическая диссоциация
Вещества. Электролиты - вещества, растворы и расплавы которых не проводят электрический ток. Неэлектролиты - вещества, растворы и расплавы которых ...Древняя и античная химия
На протяжении многих тысячелетий человек был частью природы. Он жил согласно с ней и не пытался, да и не мог выделиться. И первым толчком к формированию ...Органические вещества химия
Органическая химия – это дремучий лес, в который и не отважишься войти. Фридрих Велер. С глубокой древности человечество использовало для удовлетворения ...Всё на свете химия!
А что же такое химия? Наука о веществах и превращениях друг в друга. Химия в быту. Химия в быту, сравнительно молодая наука, является нашим незаменимым ...Органическая химия
Цель: уяснить знания о предмете изучения и особенностях органической химии. Широко распростирает химия руки свои в дела человеческие … куда ни посмотрим, ...Органическая химия А.А.Карцовой и А.Н.Лёвкина
. H3C-O-CH3 CH3-CH2-CH3 6 C УГЛЕРОД 12,011. Основные классы органических веществ. H2C=CH─CH2─CH3 HC≡C─CH2─CH3 H2C=CH─CH=CH2 CH3─CH2─OH CH3─CH2─NH2 ...«Нуклеиновые кислоты» химия
Цель урока: сформировать у студентов понимание взаимосвязанности и взаимозависимости веществ в клетке. Задачи урока: повторить строение и основные ...Органическая химия
ФЕНОЛЫ. 2. Классификация и изомерия Как и спирты, фенолы бывают одноатомные (одна -OH) и многоатомными (несколько -OH). Для фенолов характерна изомерия ...Ломоносов и химия
В 2011 году исполнится 300 лет со дня рождения великого русского ученого, основателя Московского государственного университета Михаила Васильевича ...Конспекты
Электролитическая диссоциация кислот, щелочей и солей
Дата ____________ Класс _____________. Тема:. Электролитическая диссоциация кислот, щелочей и солей. Цели урока:. рассмотреть свойства кислот, ...Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах
Дата _______________ Класс ___________. Тема:. Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах. Цели урока:. ...Электролитическая диссоциация
Дата _____________ Класс ___________________. Тема:. Практическая работа №1 Решение экспериментальных задач по теме «Электролитическая диссоциация». ...Электролитическая диссоциация
Учитель химии МОУ гимназии № 32. . Кудравец Е.А. . Дидактическая разработка урока в 8 классе. «Электролитическая диссоциация». Цель урока:. ...Электролитическая диссоциация
Тема урока. Электролитическая диссоциация. Электролиты и неэлектролиты. . . Тип урока. урок изучения нового материала, урок-исследование. . ...Электролитическая диссоциация
Черкашина Л.И.,. . КГУ СОШ №. 32. г. Караганда. Тема: Электролитическая диссоциация. (Урок – обобщения). 9 класс. Цели:. . 1). . Обобщить, ...Электролитическая диссоциация
Тема урока:. Электролитическая диссоциация. Цели урока:. 1)Сформировать понятия об электролитах и неэлектролитах. 2)Рассмотреть механизм ...Электролитическая диссоциация
Кузьмина Светлана Ниловна, учитель химии МБОУ «Гимназия №1» г. Чебоксары. Тема «Электролитическая диссоциация». Цель урока:. формирование ...Электролитическая диссоциация
Методическая разработка урока. . в 8 классе по теме. «ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ». Рыбакова Лариса Юрьевна. ,. муниципальное общеобразовательное ...Электролитическая диссоциация
"Электролитическая диссоциация". Урок обобщения знаний с мультимедийным сопровождением.(слайд 1). Цели:. - обобщить, систематизировать и углубить ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:5 сентября 2018
Категория:Химия
Содержит:21 слайд(ов)
Поделись с друзьями:
Скачать презентацию