Презентация "Токсикологическая характеристика оксидов серы" (11 класс) по химии – проект, доклад
Презентацию на тему "Токсикологическая характеристика оксидов серы" (11 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 19 слайд(ов).
Слайды презентации
Список похожих презентаций
Общая характеристика оксидов
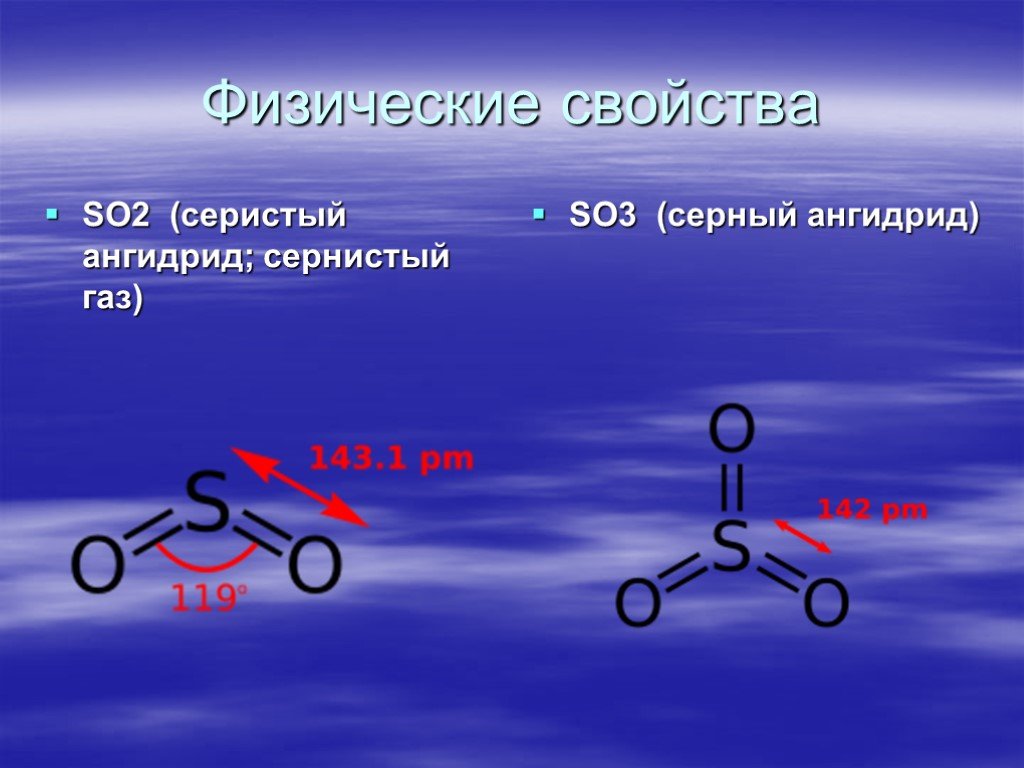
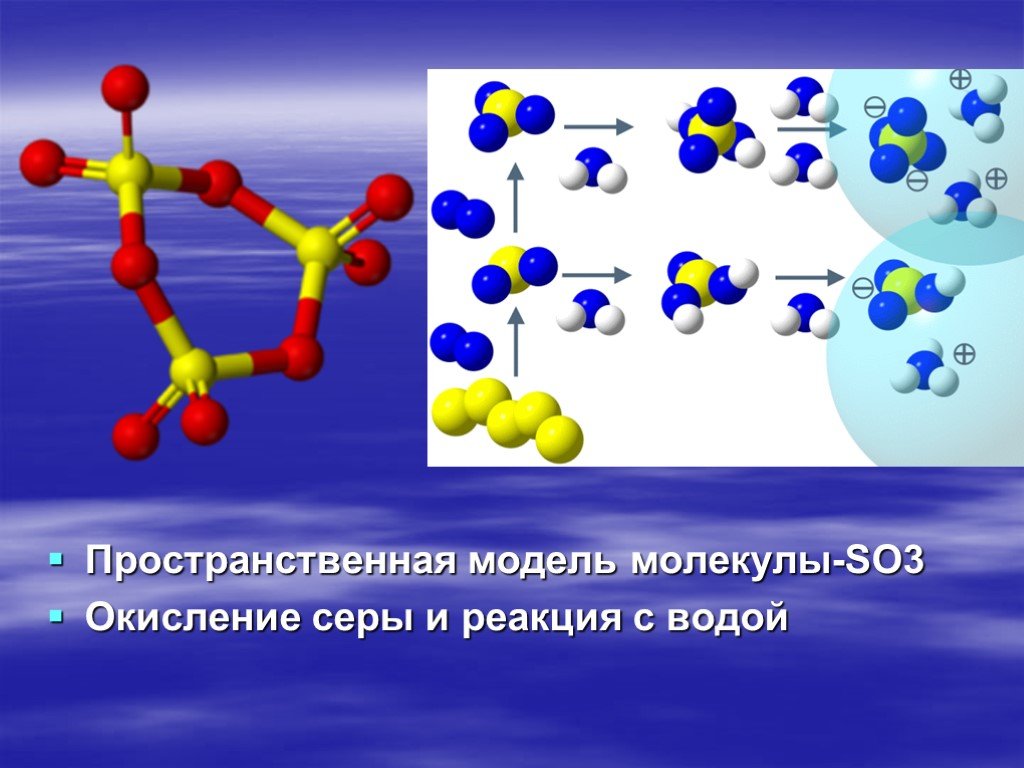
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. Например: CaO, SO2, Al2O3, CO. Оксиды. Оксиды – соединения элементов ...Соединения серы
С О Е Д И Н Е Н И Я С Е Р Ы. степень окисления серы -2. Сероводород - Н2S. Сульфиды неметаллов – CS2, P2S3. Сульфиды металлов – Al2S3, K2S. Н2S СЕРОВОДОРОД. ...Свойства серы
Сера известна человечеству с древних времен, т. к. она в природе встречается в самородном виде. Считалось, что голубое пламя и запах, распространяемый ...Основные соединения серы
Почему геохимик А.Е.Ферсман назвал серу «двигателем химической промышленности»? Цели урока:. Рассмотреть свойства важнейших соединений серы – сероводорода ...Общая характеристика элементов подгруппы кислорода
ПАМЯТКА К ИЗУЧЕНИЮ ПОДГРУППЫ ЭЛЕМЕНТОВ. 1.Пользуясь Периодической системой, выпишите символы и названия химических элементов, относящихся к данной ...Общая характеристика элементов VA-группы. Азот
Элементы VA-группы. Элементы VА-группы. Общая электронная формула: […] ns 2 (n–1)d 10np 3. Степени окисления: –III, 0, +III, +V. Валентные возможности: ...Общая характеристика подгруппы углерода
Сравнительная характеристика элементов IV группы главной подгруппы. 2s22p2 3s23p2 4s24p2 5s25p2 6s26p2 C Si Ge Sn Pb 73 119 )) ))))) ))) )))))) ))))))) ...Химические свойства оксидов
Классификация оксидов по химическим свойствам. ОКСИДЫ. Несолеобразующие Безразличные СО, NO, N2O, SiO. Солеобразующие Основные ВаО, СаО Кислотные ...Кислород и сера и их характеристика
Положение в периодической системе. КИСЛОРОД и СЕРА элементы VIA группы периодической системы Элементы этой группы имеют общее название - ХАЛЬКОГЕНЫ, ...Изучение свойств оксидов металлов
Цель: определить характер оксидов металлов, имеющихся в школьной лаборатории (оксиды бария, железа, кальция, меди, свинца), изучить их свойства. Задачи: ...Загальна характеристика добрив
Добрива — органічні й неорганічні речовини, які застосовують для поліпшення умов живлення культурних рослин з метою підвищення врожаю й поліпшення ...Водород, его общая характеристика, нахождение в природе и его свойства
Цели. сформировать знания учащихся о водороде как о атоме и простом веществе, его способах получении, свойствах и применении научить учащихся работать ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Алюминий и его характеристика
Цель урока. Рассмотрение характеристики алюминия по трем формам существования химических элементов: атомов, простых и сложных веществ. Задачи урока. ...Сравнительная характеристика металлов и их соединений
Пирит. Берилл. . Корунд (Al2O3). Рубин. Сапфир. Необычные кристаллы поваренной соли - "искусственные кораллы". Кристаллы соли Соляная шахта. Серебро. ...Токсикологическая химия
Токсикологическая химия. Токсикологическая химия – это наука о химических превращениях токсических веществ и их метаболитов в организме, методах их ...Кислород. Общая характеристика, получение и свойства
Химический элемент Знак элемента – О Относительная атомная масса – 16 Валентность – II. Кислород. Простое вещество Неметалл Молекула – О2 Относительная ...Аллотропия. Аллотропные формы серы
Аллотро́пия (от др.-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же химического элемента в виде двух и более ...Круговорот серы и фосфора
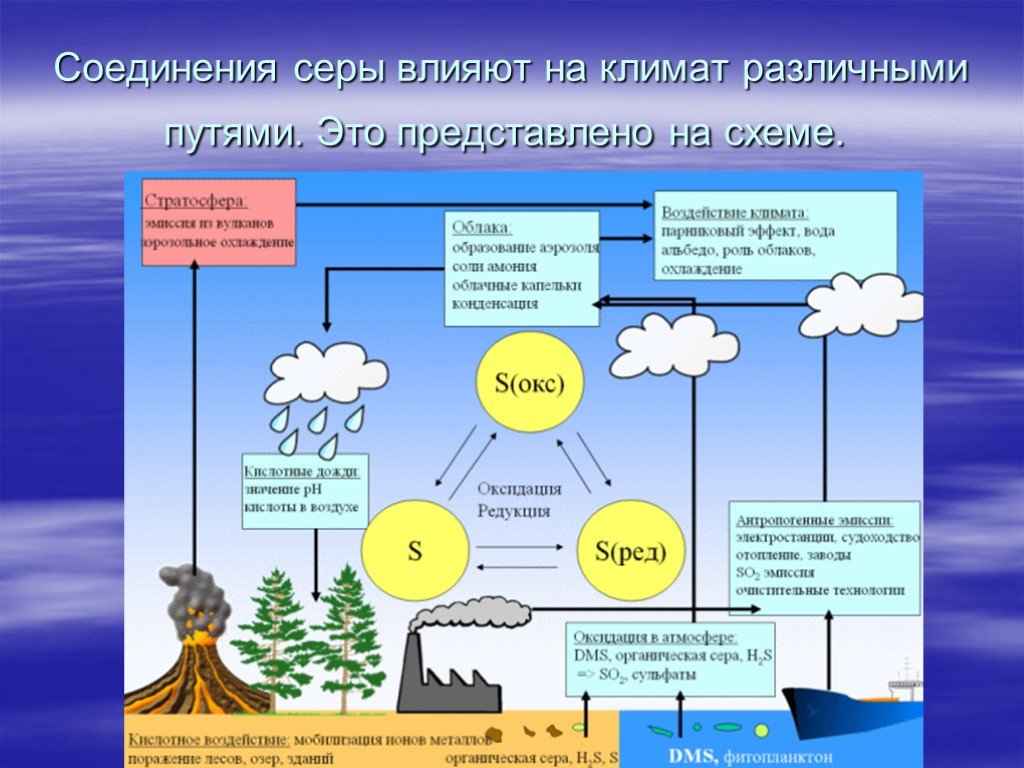
Круговорот серы в природе. Сера играет важную роль в круговороте веществ в биосфере. Соединения серы участвуют в формировании химического состава ...Конспекты
Кислород, его общая характеристика и нахождение в природе. Оксиды
Муниципальное бюджетное общеобразовательное учреждение. «Краснощёковская средняя общеобразовательная школа№1». Краснощековского района. . Алтайского ...Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Дата _____________ Класс ___________________. Тема: Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы. Цели урока:. ...Сравнительная характеристика кальция и магния и их соединений
Урок №41. Тема : Сравнительная характеристика кальция и магния и их соединений. Цель урока:. . познакомиться с важнейшими соединениями Ca и Mg, ...Положение кислорода и серы в периодической системе химических элементов, строение их атомов. Озон – аллотропная модификация кислорода
Дата _____________ Класс ___________________. Тема: Положение кислорода и серы в периодической системе химических элементов, строение их атомов. ...Путешествие в удивительный мир оксидов
Название работы: Урок с использованием презентации. . Автор: Обливанова Светлана Викториновна. . МОУ Сусанинская средняя общеобразовательная ...Оксид серы (VI), серная кислота
МКОУ «СОШ а.Жако». Разработка урока по химии в 9 классе на тему:. Оксид серы (VI. ), серная кислота. Учитель ...Оксид серы (VI). Серная кислота и её соли
Дата_____________ Класс_______________. Тема: Оксид серы (VI). Серная кислота и её соли. Цели урока:. познакомить учащихся со свойствами серной ...Общая характеристика кислорода
Конспект урока по химии в 8 классе. Раздел « Кислород. Оксиды. Горение». Тема урока: «Общая характеристика кислорода». Цель урока: Формировать ...Общая характеристика металлов и их значение для человека
Технология развития критического мышления. Интегрированный урок химии - биологии. на тему: «Общая характеристика металлов и их значение для человека». ...Общая характеристика галогенов
Цели урока:. Образовательные:. Охарактеризовать особенности положения галогенов в Периодической системе Д.И.Менделеева. . Охарактеризовать ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:10 января 2019
Категория:Химия
Содержит:19 слайд(ов)
Поделись с друзьями:
Скачать презентацию