Презентация "Спирты" по химии – проект, доклад
Презентацию на тему "Спирты" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 28 слайд(ов).
Слайды презентации
Список похожих презентаций
Спирты или алканолы
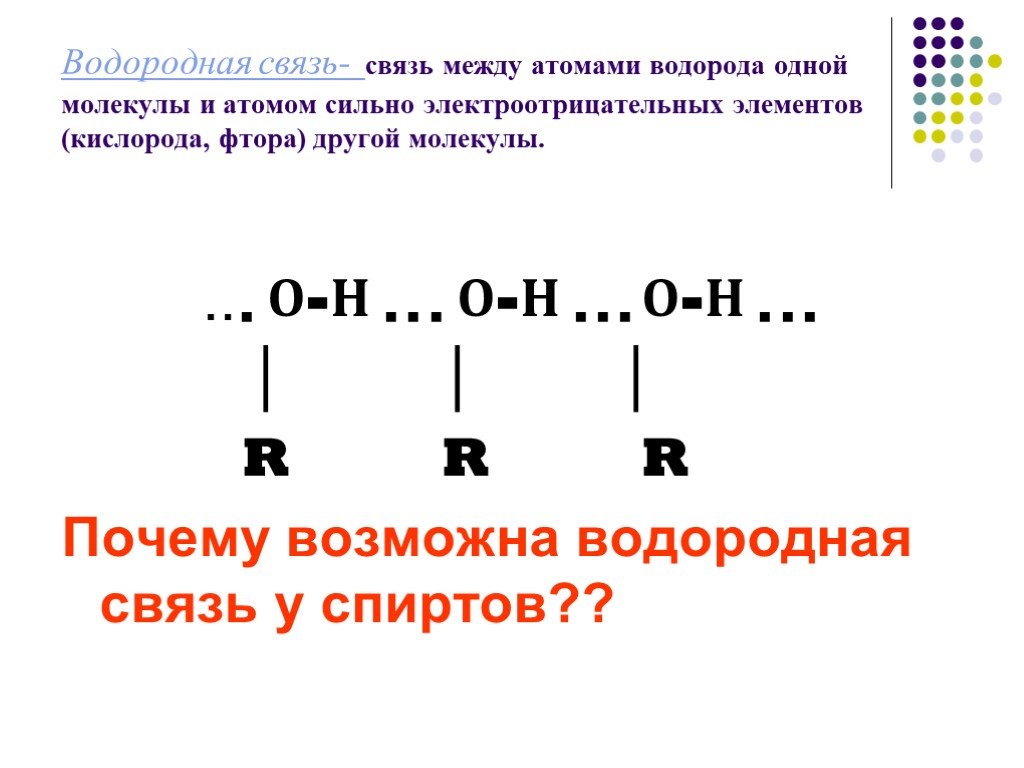
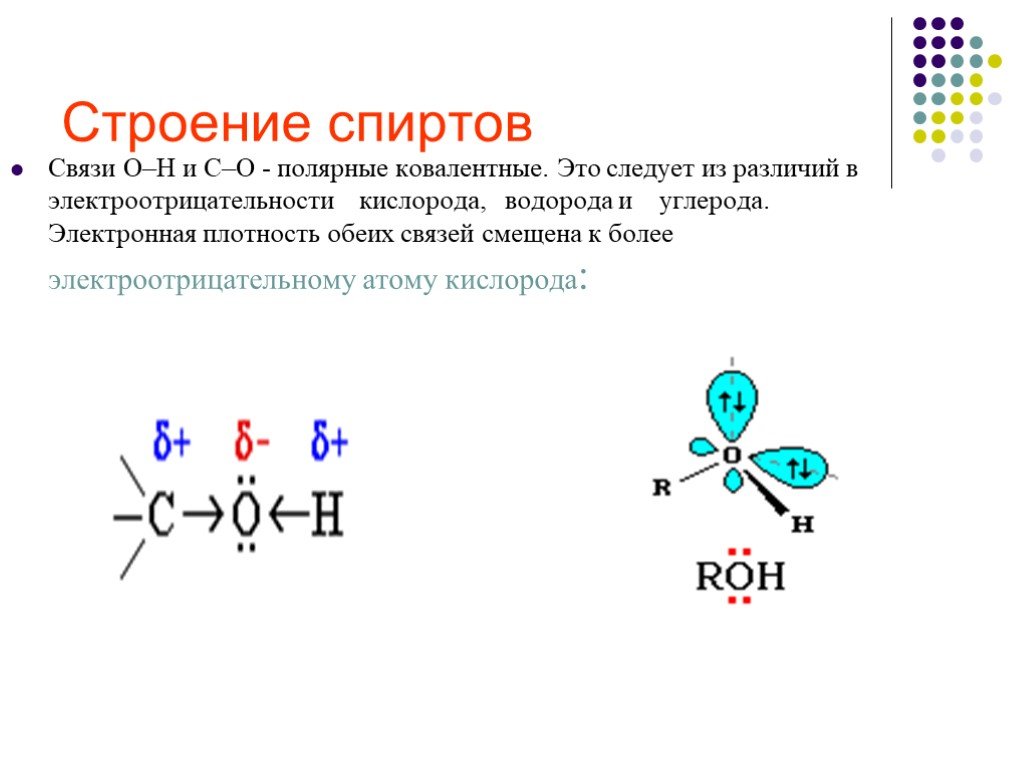
Строение. Спиртами называют органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп – ОН),соединённых с углеводородным ...Спирты и фенолы
Сегодня на уроке:. вы повторите, что такое спирты и фенолы;. вы узнаете о губительном действии этанола на организм человека;. вы выполните упражнения ...Спирты и фенолы
Спирты – органические соединения, содержащие одну или более гидроксильных групп (гидроксил-ОН), непосредственно связанных С насыщенным атомом углерода. ...Спирты 1
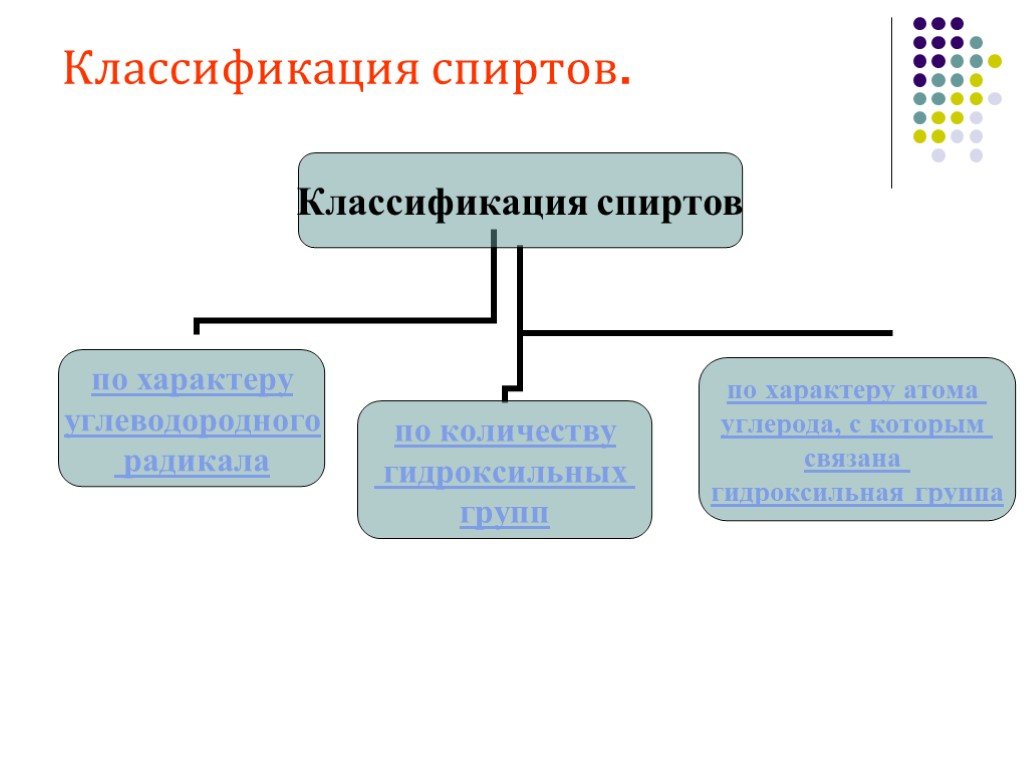
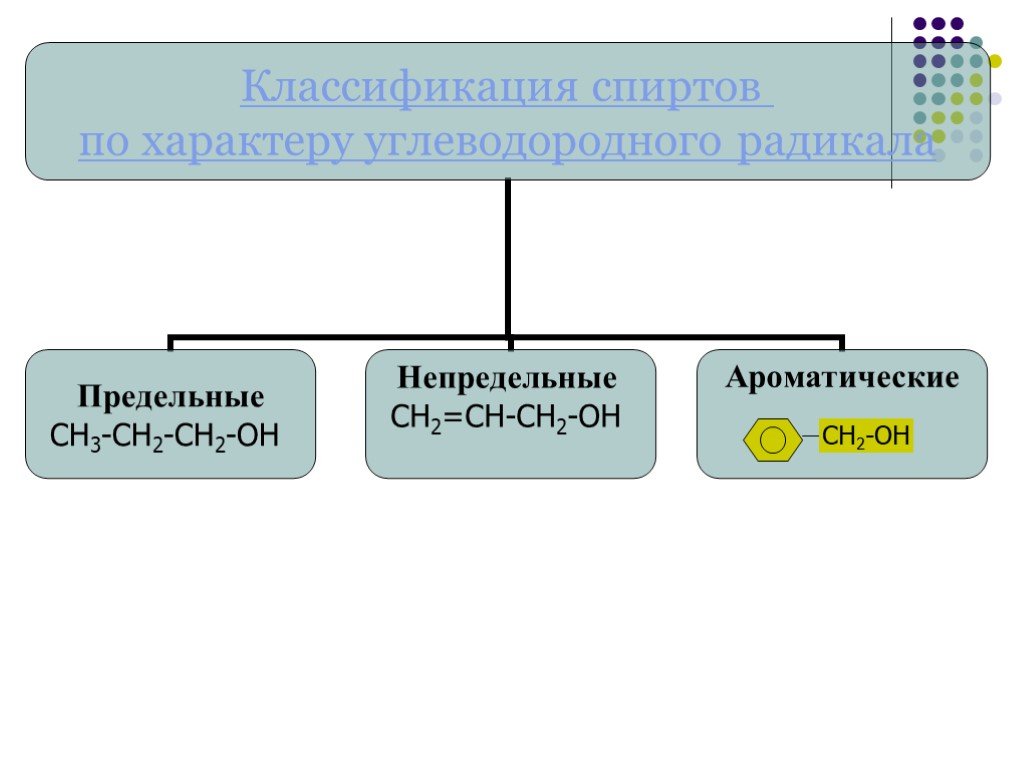
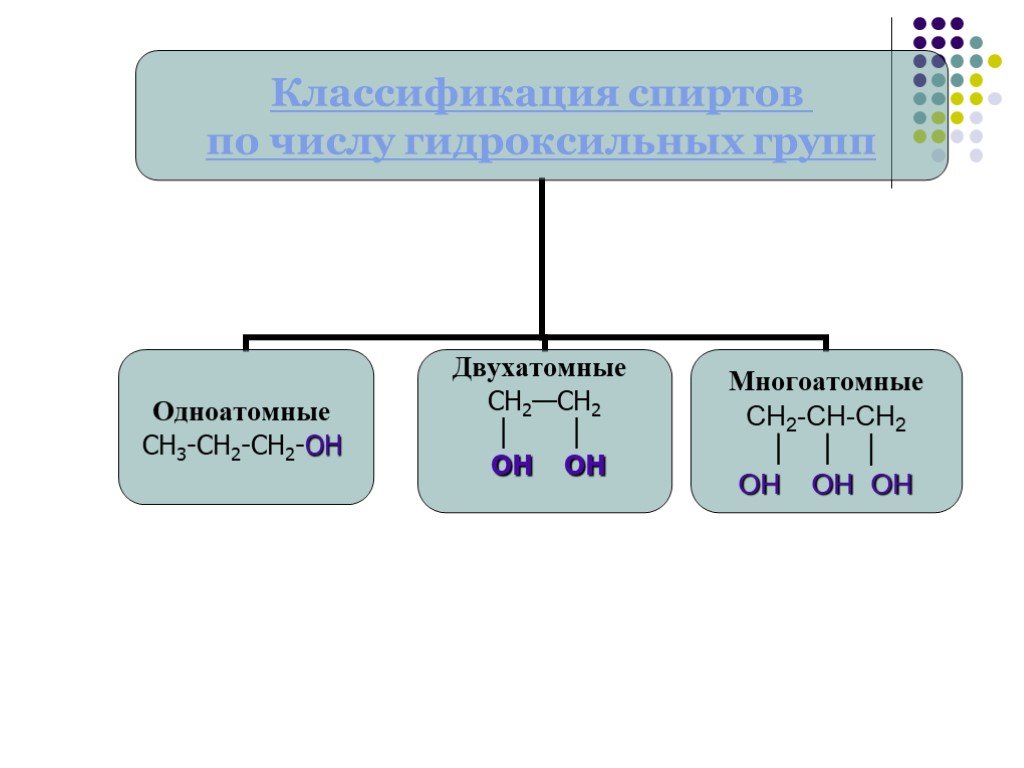
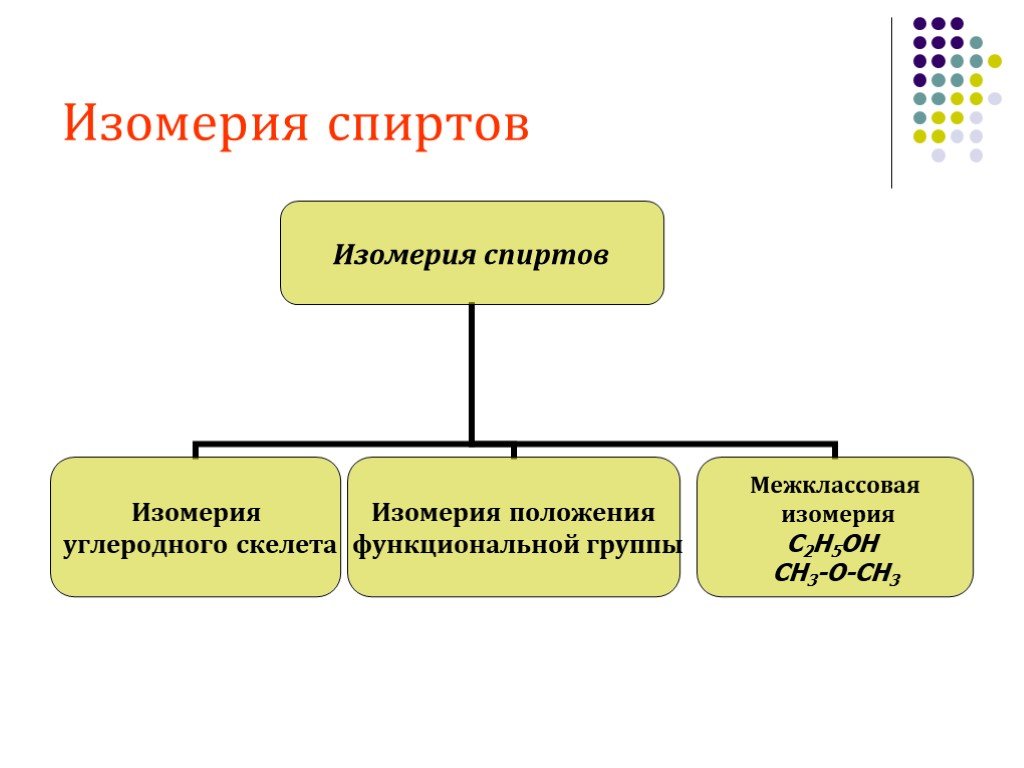
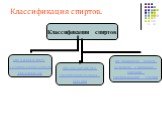
Классификация спиртов. По числу гидроксильных групп спирты делятся на: Одноатомные: СН3ОН-метанол, С2Н5ОН-этанол Двухатомные: НО-СН2-СН2-ОН-этандиол-1,2 ...Спирты 2
ОПРЕДЕЛЕНИЕ. Спиртами- называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп ( групп- OH ), соединённых ...Спирты
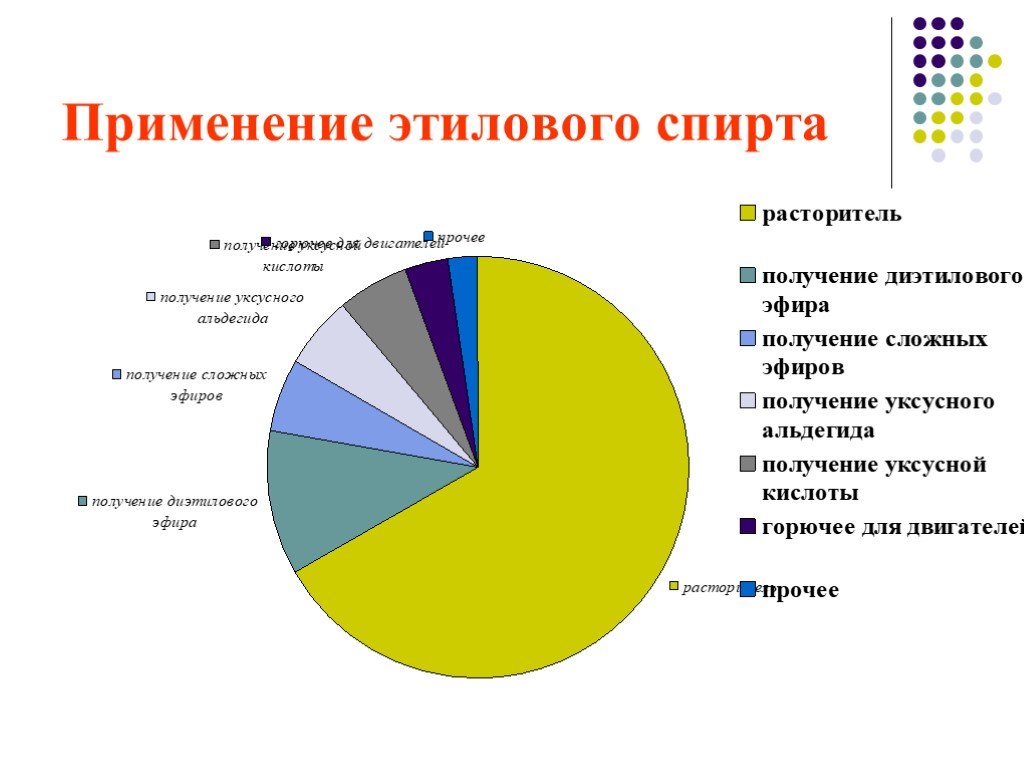
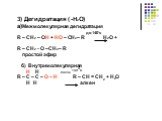
Непредельные спирты. Непредельные спирты, образующие π-связь, называются енолами. Название этого класса соединений образовано из суффиксов -ен и -ол, ...Спирты - в жизни человека
Цели урока:. Образовательная: Сформировать у учащихся представления о строении и свойствах спиртов. Подвести учащихся к осмыслению понятий: «Древесный ...Спирты
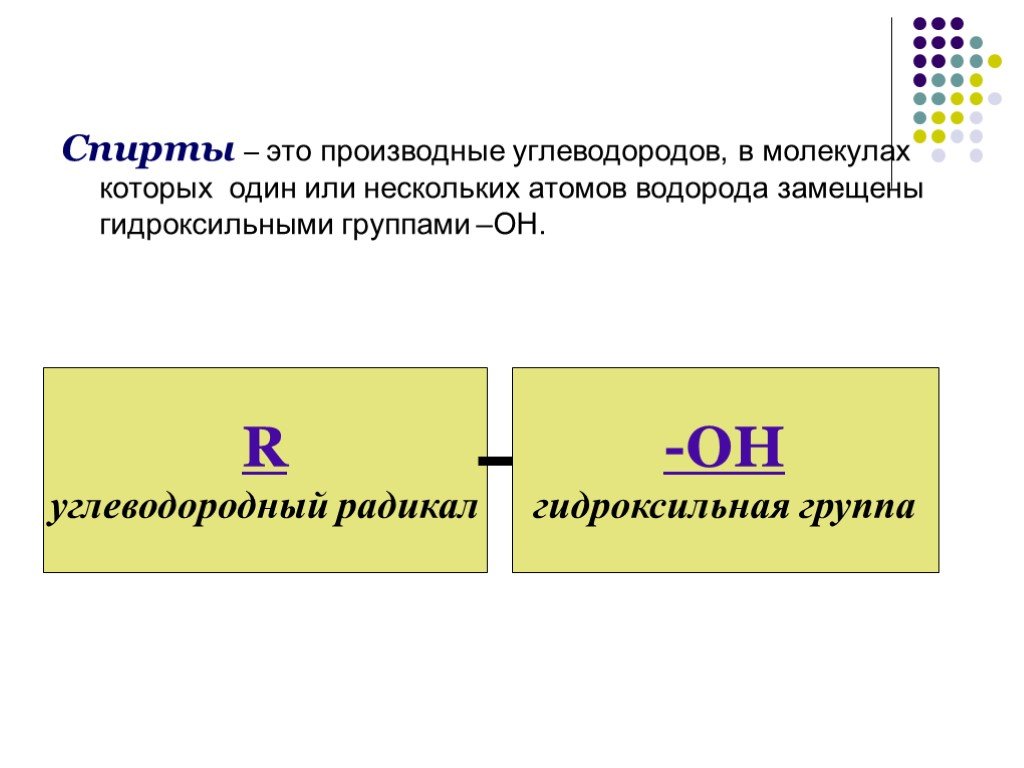
Спирты. Спиртами называются производные углеводородов, в которых один или несколько атомов водорода заменены на гидроксильньк группы. Классификация. ...Спирты
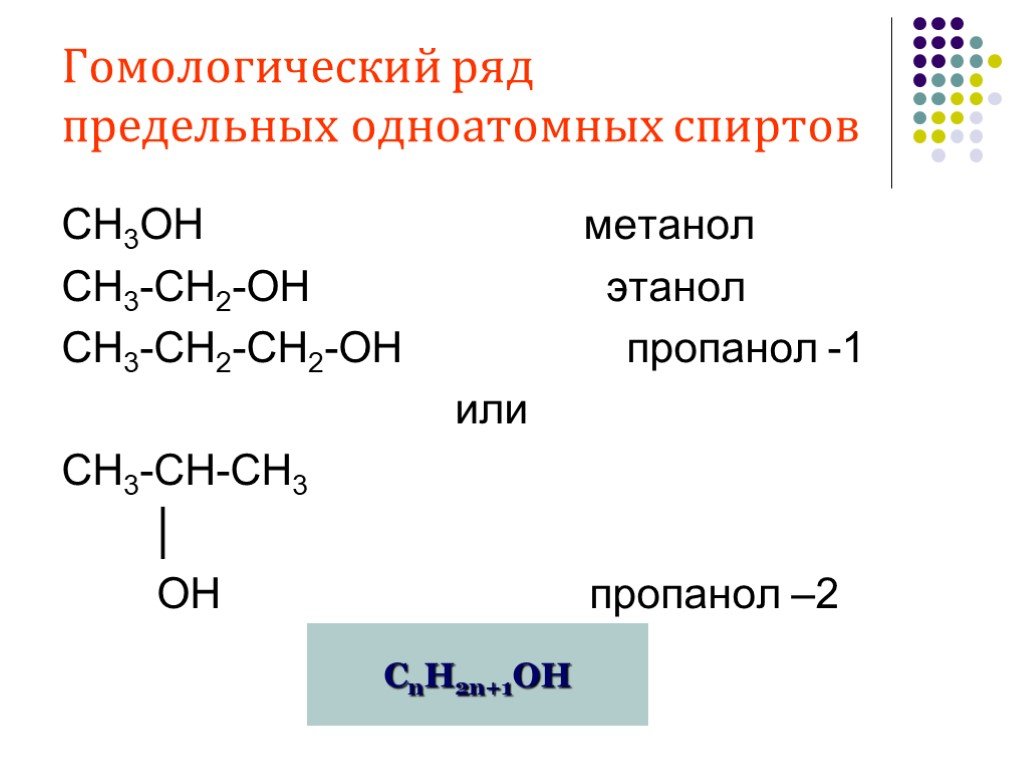
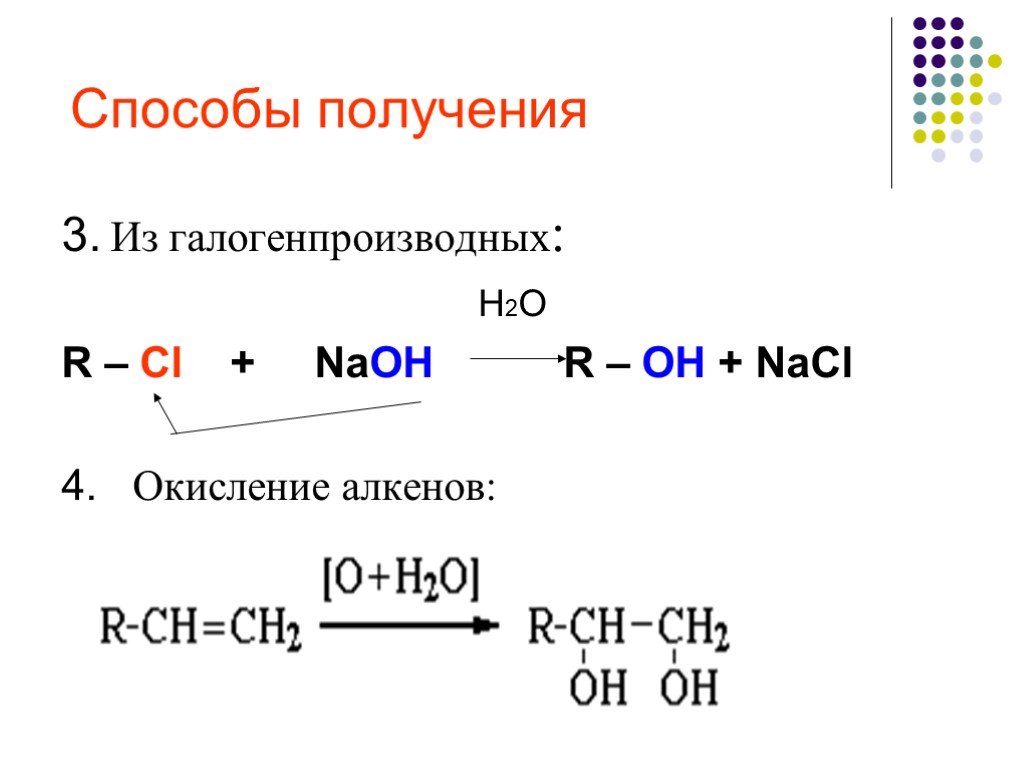
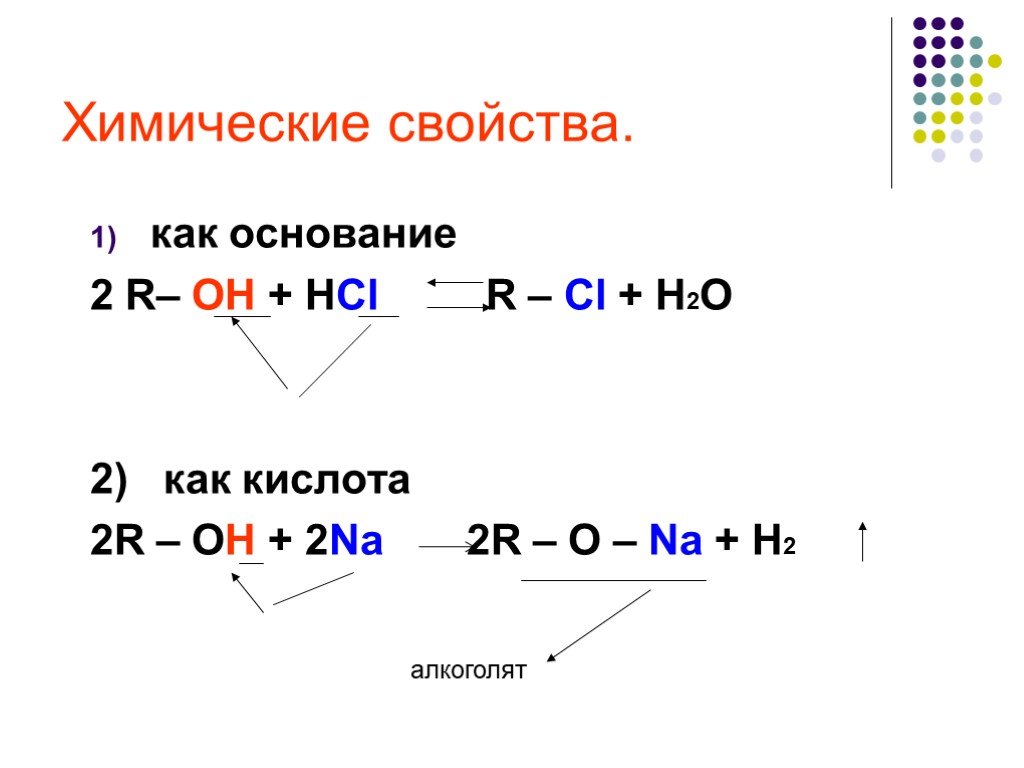
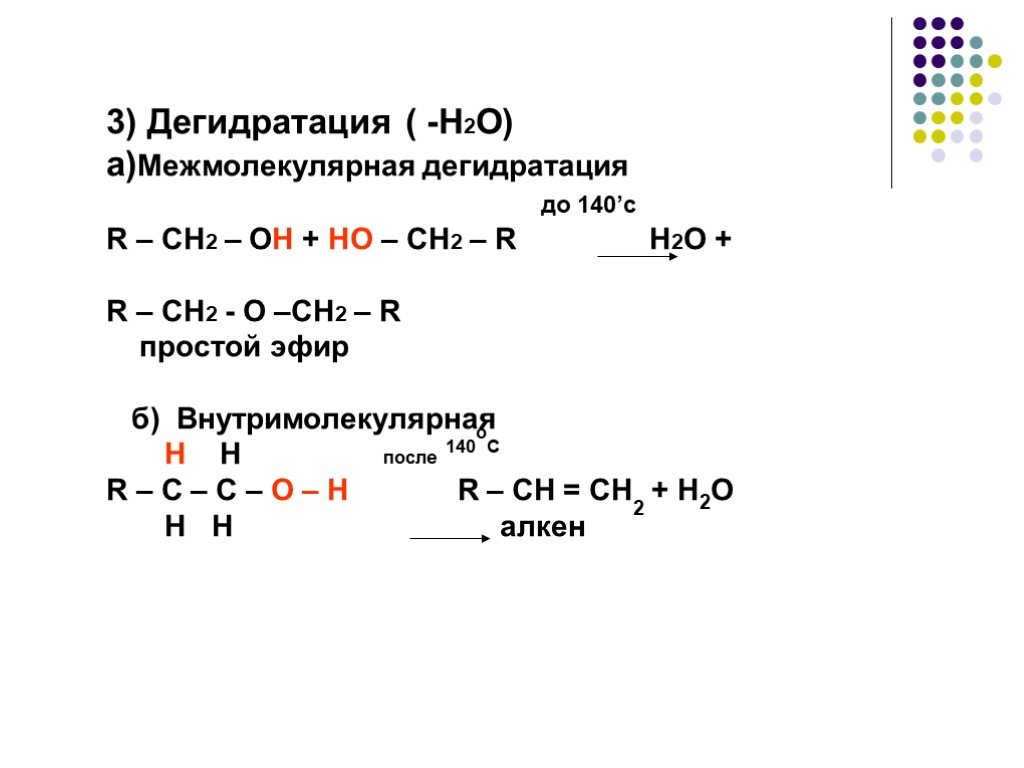
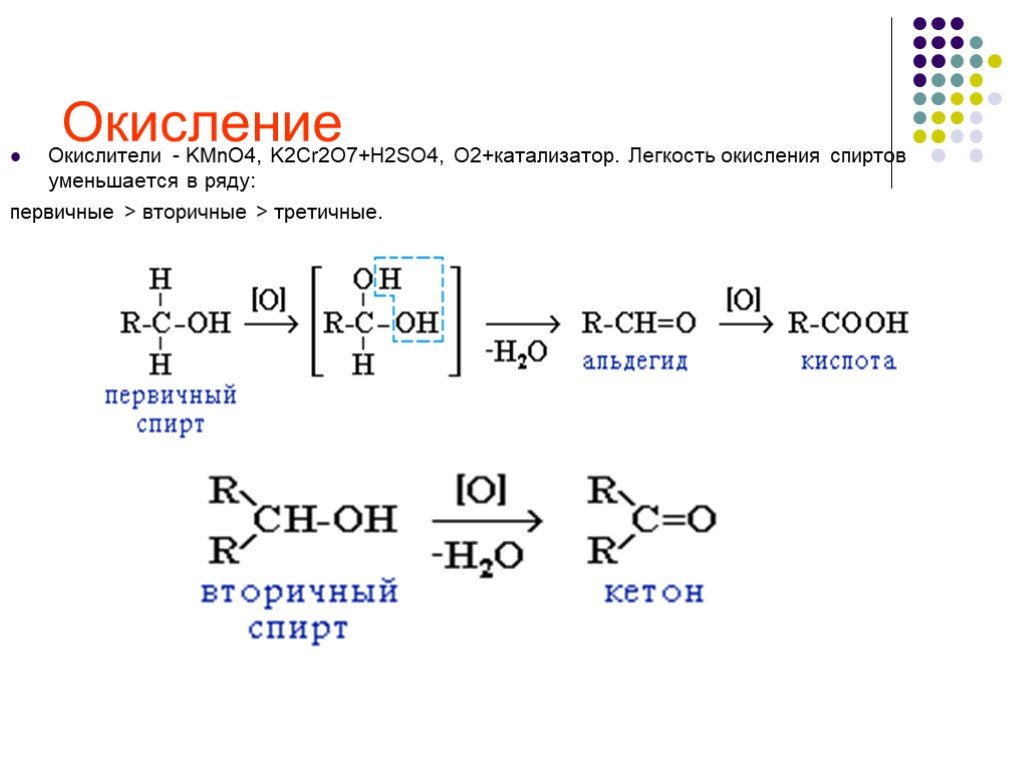
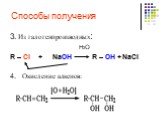
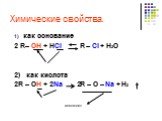
Предельные одноатомные cпирты. Общая формула. C n H 2n + 1 OH или R – OH, где R- углеводородный радикал. Это органические соединения, в молекулах ...Спирты
1. Классификация спиртов. 1) Дайте определение понятию спирты. Спиртами называются органические вещества, молекулы которых содержат одну или несколько ...Спирты
Спиртами называют органические вещества, молекулы которых содержат одну или несколько функциональных гидроксильных групп, соединенных с углеводородным ...Спирты
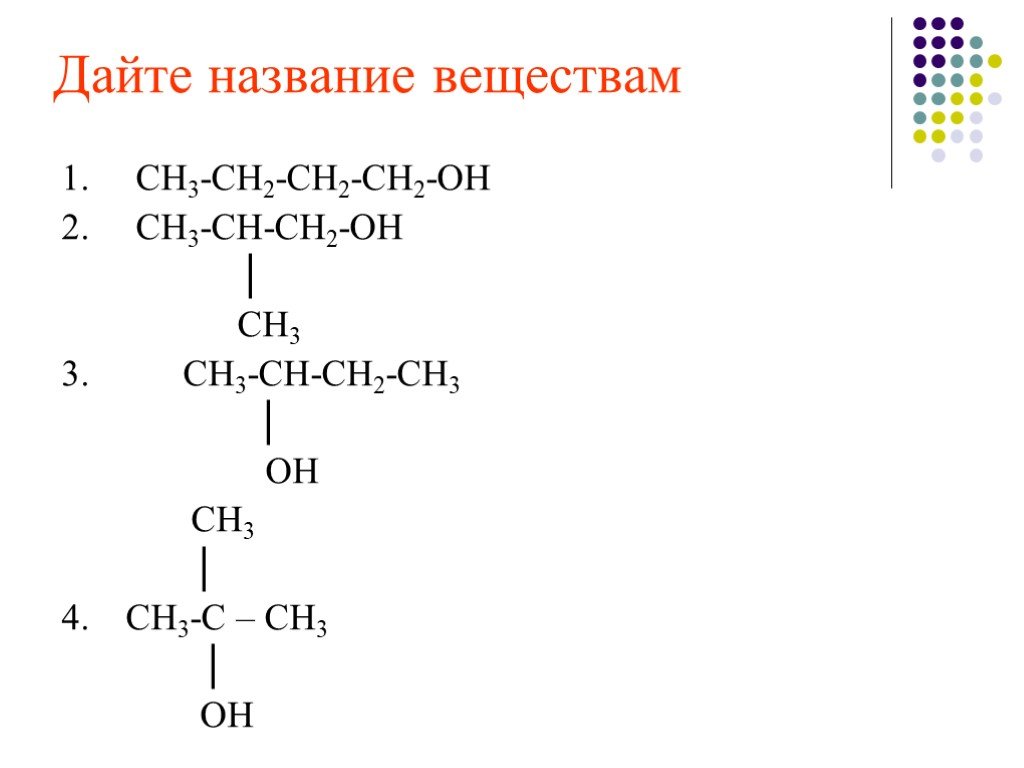
Номенклатура спиртов. По международной номенклатуре ИЮПАК названия дают от названий радикалов, а также из названий углеводородов прибавлением окончания ...Спирты, они же – алкоголи
Классификация спиртов:. 1. По числу гидроксильных групп( атомности ) * одноатомные, например: СН3 – ОН, СН3- СН2- ОН Двухатомные (гликоли ), например: ...Спирты. Предельные одноатомные спирты
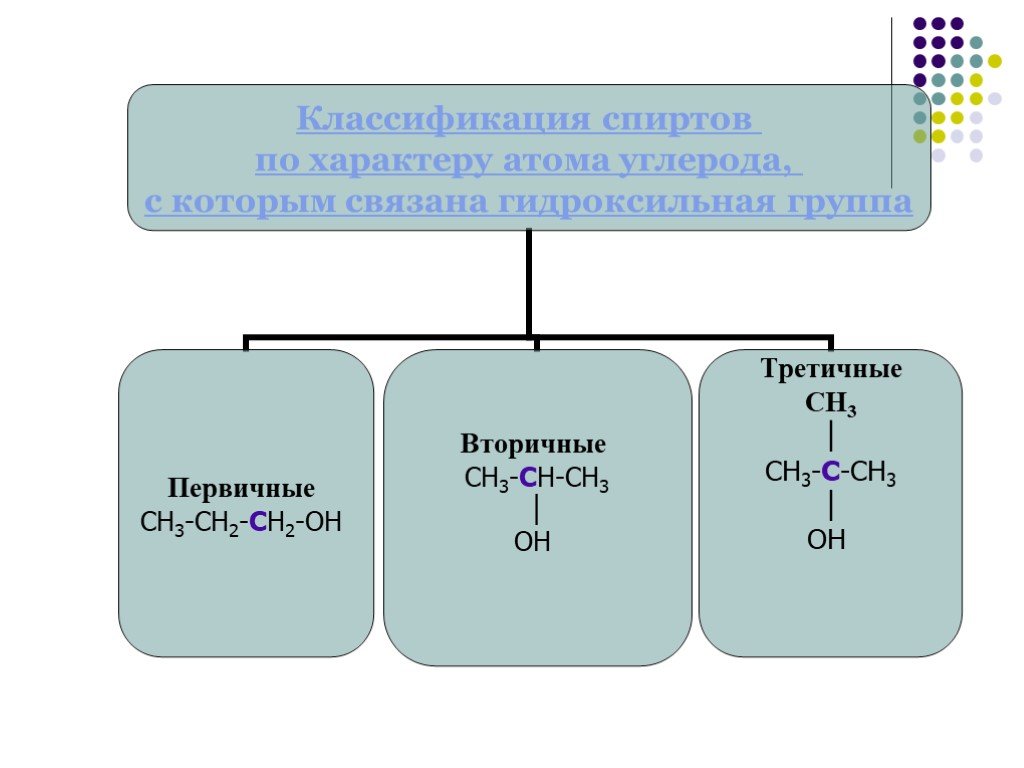
Общая характеристика. Общая формула гомологического ряда предельных одноатомных спиртов — CnH2n+1OH. В зависимости от того, при каком углеродном атоме ...Многоатомные Спирты и их строение
Глицерин (пропантриол-1,2,3) - простейший представитель трёхатомных спиртов. Представляет собой вязкую прозрачную жидкость, очень гигроскопична, смешивается ...Спирты
План урока. Понятие о спиртах. Метанол. Этанол. Глицерин. Д/З : § 35, В. 1 и 3. 1.Понятие о спиртах. Если в молекулах У.В. атом водорода заместить ...Предельные одноатомные спирты
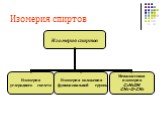
Определение спиртов Классификация спиртов Номенклатура Изомерия Физические свойства Аномалии у спиртов Химические свойства Физиологическое действие ...Многоатомные спирты
Многоатомные спирты - это органические соединения, в молекулах которых содержатся две или более гидроксильных групп, соединенных с углеводородным ...Многоатомные спирты кратко
Многоатомные спирты (полиспирты, полиолы) — органические соединения класса спиртов, содержащие в своём составе более одной гидроксильной группы. Фенолы ...Одноатомные спирты
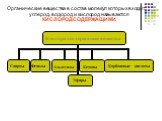
СПИРТЫ И ФЕНОЛЫ. Спиртами называются соединения, содержащие одну или несколько гидроксильных групп (–ОН), связанных с углеводородным радикалом. Вещества, ...Конспекты
Спирты, их строение, номенклатура, физические и химические свойства спиртов
Тема:. «Спирты, их строение, номенклатура, физические и химические свойства спиртов». . Цели. :. Знать строение, номенклатуру, физические и химические ...Спирты, строение, номенклатура и изомерия
Урок. . Тема: Спирты, строение, номенклатура и изомерия. Цель:. . - познакомить с кислородсодержащими органическими веществами. - дать общую ...Спирты Действие спиртов на организм человека
Конспект урока по химии в 10 классе. . Валеева Елена Николаевна,. . учитель химии. первой квалификационной категории. МБОУ «Гимназия №32». ...Спирты, их классификация, номенклатура и изомерия
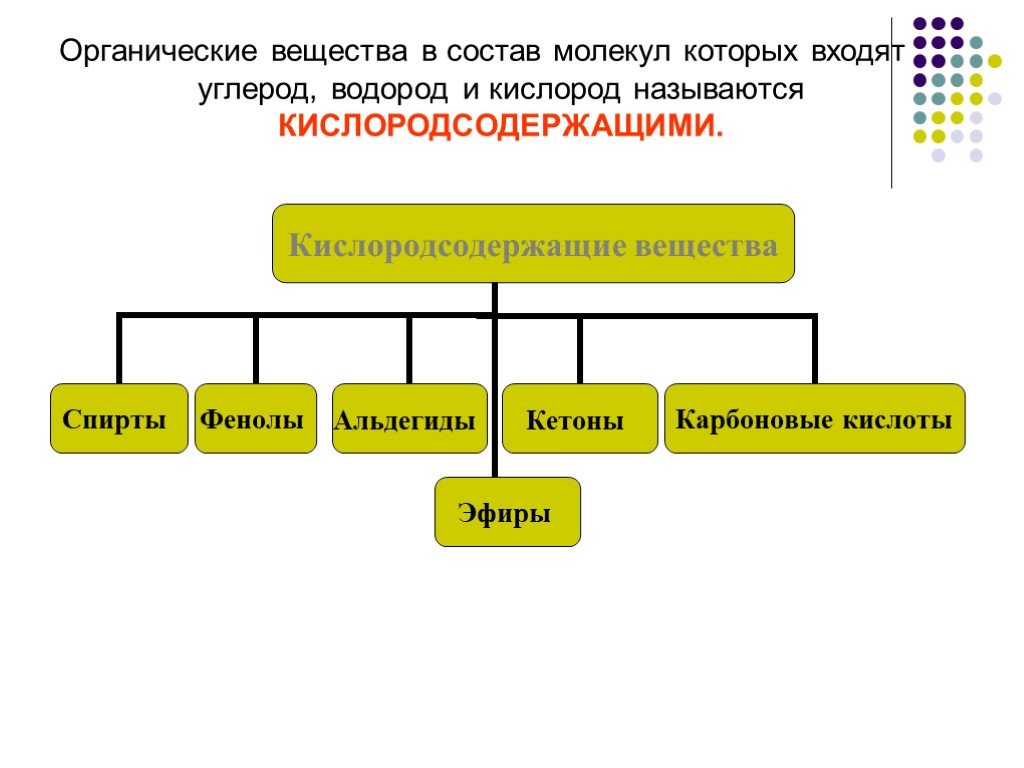
Тема урока: “Спирты, их классификация, номенклатура и изомерия”. . . Цели урока:. - Дать первоначальные понятия о кислородсодержащих соединениях. ...Спирты
План-конспект урока по теме. «Спирты». 10 класс. УМК О.С.Габриелян. Цели урока:. Обучающие:. Ознакомить учащихся с классификацией спиртов, их ...Спирты
План. открытого урока на тему:. «Спирты». Разработала:. Максимова Александра Григорьевна, преподаватель химии и биологии. Филиал ГАОУ СПО ...Спирты
. Урок по теме: Спирты. . Учитель химии. Архипова Н.В. II. квалификационная. . категория. МБОУ « Таштыпская. ...Спирты
Обобщающий урок по теме "Спирты". "Алкоголь - это зло". Цель урока:. доказать, что спиртные напитки отрицательно действуют на здоровье человека, ...Спирты
МОУ «Украинская СОШ». Омская область, Исилькульский район, с. Украинка. Тема урока:. «СПИРТЫ». 9 класс. Учитель химии:. ...Кислородсодержащие органические соединения. Спирты и фенолы
Шайтанова Екатерина Игоревна. Преподаватель химии и биологии. Николаевский-на-Амуре филиал. коренных малочисленных народов Севера. краевого государственного ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:10 января 2019
Категория:Химия
Содержит:28 слайд(ов)
Поделись с друзьями:
Скачать презентацию