Конспект урока «Сравнительная характеристика кальция и магния и их соединений» по химии
Урок №41
Тема : Сравнительная характеристика кальция и магния и их соединений
Цель урока: познакомиться с важнейшими соединениями Ca и Mg, нахождением их в природе, их применением.
Задачи:
Образовательные:
Познакомить учащихся с представителями соединений металлов Ca и Mg.
Продолжить обучение учащихся пользоваться периодической системой.
Совершенствовать умения составления уравнений химических реакций.
Способствовать развитию практических умений при работе на интерактивной доске.
Воспитательные:
Показать значимость химических знаний для современного наукоемкого производства и успешной адаптации будущих специалистов в современном обществе.
Развивающие:
Способствовать продолжению развития устойчивого интереса к химической науке и практике.
Развивать память и внимание учащихся.
Оборудование: ПСХЭ, учебник
Ход урока :
-
Орг момент
-
Актуализация знаний:
Письменно :
Осуществите превращения: Na→Na2O2 →Na2O→NaOH→Na3PO4→NaNO3.. Укажите типы реакции. №3,5 стр 151
Устно : строение атомов натрия и калия
Физические и химические свойства, проверка д\з №6 стр 151
На местах :№7 стр 151
-
Изучение нового материал
Магний.
В природе магний - горы доломита
Нагромождает в горные хребты.
В асбесте, тальке он, и в магнезите,
В голубизне морских глубин.
Он символом земной жизни
На голубой планете стал,
Ведь магний это фотосинтез
И жизнь зеленого листа.
Без магния нет хлорофилла
И жизни как таковой
Он чудодейственная сила
В нем жизни всей круговорот
Химически он энергичен,
И химикам помог не раз
Внеси его хоть в пламя спички
Он вспыхнет и сгорит тотчас.
Сплав с алюминием легчайший
Дает он марки «Электрон»,
В когорту сплавов им крылатых
Как равноценный входит он.
А ты в аптеку загляни-ка
И убедиться сам изволь!
Там магний тоже знаменитость
Ведь он - слабительная соль!
Кальций.
Взметнулись ввысь ажурные громады
Кирпичной кладки стройные ряды,
Вот в облицовке поражает мрамор
Оттенков нежностью своих
Расцвеченный моллюска панцирь,
Коралл, ракушки завиток –
Все это многоликий кальций,
Ему в строительстве почет.
Животным он каркас надежный
В соединениях дает.
И поражает облицовкой
Он нас на станциях метро.
И если кальций ниже нормы
Окажется у нас в крови
Кровотечением опасным
Даже царапина грозит.
В земной коре его немало,
В достатке гипс и известняк.
Слагают горы мел и мрамор,
В морской воде он и в костях.
Сравнительная характеристика кальция и магния
| Магний | |||||||||||
| Строение атома (2 уч-ся у доски) Валентность 2 и СО +2
|
| ||||||||||
| Нахождение в природе Самостоятельная работа с учебником стр 155, выписать важнейшие соединения | |||||||||||
| Физические свойства Кальций – металл серебристо-белого цвета, очень легкий (ρ = 1,55 г./см3), как и щелочные металлы, но несравненно тверже их и имеет гораздо более высокую температуру плавления, равную 851 0С. | Белый металл, легкий. На воздухе быстро покрывается тонкой пленкой оксида, поэтому становится матовым. Температура плавления 651С | ||||||||||
| Химические свойства Подобно щелочным металлам кальций является сильным восстановителем, что схематически можно изобразить так:
| |||||||||||
| Обнаружение соединений Соединения кальция окрашивают пламя в кирпично-красный цвет. Как и щелочные металлы, металлический кальций обычно хранят под слоем керосина. | Соединения магния при добавлении щелочей образуют белый студенистый осадок Mg(OH)2 | ||||||||||
| Получение : Кальций и магний получают в промышленности путем электролиза расплава солей CaCl2=Ca+Cl2 | |||||||||||
| Важнейшие соединения кальция и магния Самостоятельная работа с учебником стр 158 | |||||||||||
-
Закрепление
Выполнение лабораторной работы №6
-
д\з параграф 5.4 стр 155-162, №4 стр 162
Здесь представлен конспект к уроку на тему «Сравнительная характеристика кальция и магния и их соединений», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

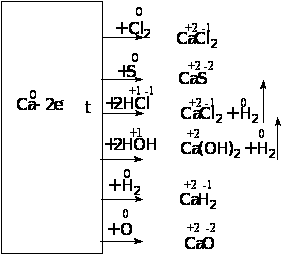 аналогично и для магния
аналогично и для магния