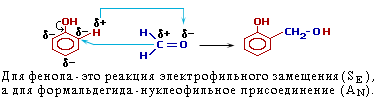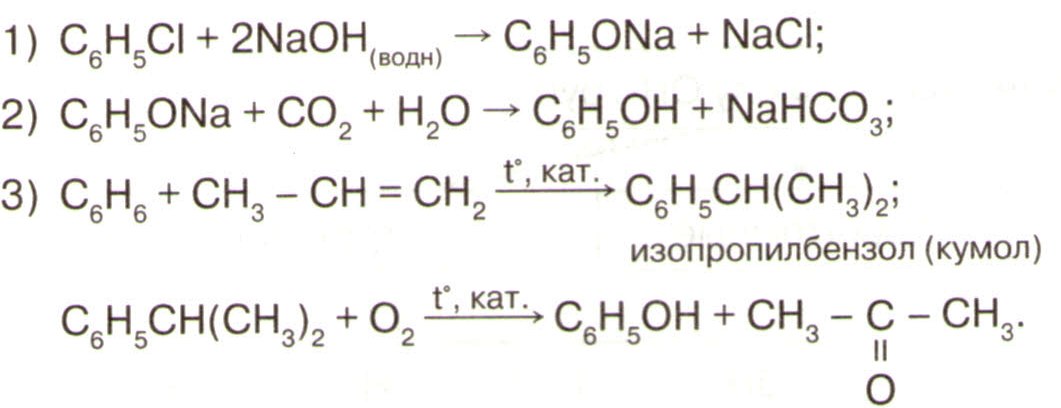Конспект урока «Систематика органических соединений» по химии
| предельные | непредельные | |||||
| Алканы | Циклоалканы | Алкены этиленовые | Диеновые | Алкины ацетиленовые | Ароматические бензол | |
| Общая формула | CnH2n+2 | CnH2n | CnH2n | CnH2n-2 | CnH2n-2 | CnH2n-6 |
| название | ан | цикло | ен | диен | Ин | |
| отличительный признак, строение УВ | − | Замкнутая цепь | = | = = | ≡ |
|
| вид гибридизации | SP3 | SP3 | SP2 | SP2 | SP | SP2 |
| характеристика химической связи | 109028' 0,154нм | 154нм | 0 134нм | 1200 134нм | 1800 120 нм | 1200 140нм |
| изомеры для n=5, названия | По углеводородному скелету | По углеводородному скелету межклассовая изомерия ( с алкенами) | 1.Изомерия по углеводородному скелету. 2. По положению кратной связи. 3. Межклассовая изомерия ( с циклоалканами) 3. Пространственная изомерия ( цис и транс изомеры) | 1.Изомерия по углеводородному скелету. 2. По положению кратной связи. 3. Межклассовая изомерия ( с алкинами) | 1.Изомерия по углеводородному скелету. 2. По положению кратной связи. 3. Межклассовая изомерия ( с диеновыми) | 1.Изомерия по углеводородному скелету. |
| Химические свойства | 1 Н2С CH4 +2О2 → СО2 +2Н2О 2 Н2С
3.Реакции дегидрирования: 2СН4 4. В присутствии катализаторов окисляются
5. разложения СН4→ С+2Н2 6. начиная с бутана изомеризуются СН3 — СН2—СН2 — СН3→ СН2—СН—СН3, │ СН3 | СН2 +О2 СН2 → СО2+Н2О Вступают в реакцию присоединения С4Н8+Н2→ С4Н10 С4Н8+Br2→С4Н8Br2 | 1. горение, С2Н4 + 3О2→2СО2 +2Н2О 2. присоединения: а) Н2 СН2=СН2 + Н2 → СН3–СН3 б) галогенами(Br2, Сl2, I2) СН2=СН2 + Br2 → СН2 Br –СН2 Br в) галогеноводородами СН2=СН2+HBr →СН3-СН2Br г) водой СН2=СН2+H2O→СН3-СН2OH этанол 3. полимеризации 4. окисление с КМпО4 СН2=СН2 + [O] + H2O → CH2–CH2 ( этиленгликоль) l l OH OH 5.Реакция дегидрирования: СН2=СН2 → СН≡СН+Н2 | Горят 2С4Н6+11О2→8СО2+6Н2О 2. присоединения: а) Н2
CH3–СH =CH–CH3
CH3–СH2 −CH2–CH3 б) галогенами Br2,Сl2, I2)
→CH2Br–СHBr−CHBr-CH2Br в)галогеноводородами
CH2Br–СH =CH–CH3
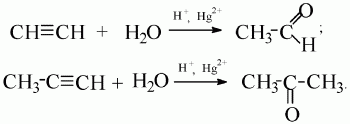
CH2Br–СH Br-CH2-CH3 г) водой 3. полимеризации nCH2=CH−CH=CH2→ (−CH2–СH =CH–CH2−)n | Алкины 1. горение, 2С2Н2+5O2→4СO2 +2Н2О; 2. присоединения: а) Н2 HCCH+H2→ H2C=CH2 H2C=CH2+H2→ H3C-CH3 б) галогенами HCCH+Br2 →HCBr=CHBr HCBr=CHBr +Br2 → HCBr2CBr2H в)галогеноводородами HCCH+HBr→H2C=CHBr H2C=CHBr +HBr → H3C−CBr2 г) водой Ацетилен образует альдегид, его гомологи – кетоны (реакция М.Г. Кучерова): 3. полимеризации 3НCCH →С6H6 НCCH + НCCH → Н2C=CHCCH 4. окисление с КМпО4 3C2H2+8KMnO4+4H2O→8KOH +3HOOC-COOH + 8MnO2 | Ароматические углеводороды Бензол 1. горение 2С6Н6 + 15О2→12СО2 + 6Н2О 2. присоединения: а) Н2 С6Н6+3H2→ С6Н12 б) галогенами С6Н6+3Cl2→ С6Н6Cl6 3. замещения : а) галогенами, С6Н6+Br2→ С6Н5Br б) азотной кислотой С6Н6+HNO3 → С6Н5NO2+H2O 4. окисление с КМпО4 ( для толуола ) С6Н5CH3+H2O+ КМпО4→ С6Н5COOH + 8MnO2+ KOH |
| Получение | В промышленности алканы выделяют из продуктов переработки нефти и попутных нефтяных газов В лаборатории: а) метан получают при нагревании прокаленного ацетата натрия с твердым гидроксидом натрия СН3СООNa+NaОН→СН4↑+Na2СО3 б) этан и другие алканы с более длинной углеродной цепью получают взаимодействием галогенопроизводных алканов с активными металлами 2СН3-СН2-Cl+2Na→ C4H10+2NaCI | | Из алканов: С2Н6 → СН2=СН2 +Н2 Из спиртов: С2Н5ОН →СН2=СН2 +Н2О Из галогенопроизводных алканов: СН2Br−СН2Br+Zn→ CH2=CH2 +ZnBr2 | Дегидрированием и дегидратацией этилового спирта при пропускании паров спирта 450ºС;ZnO,Al2O3 2CH3CH2OH →CH2=CH-CH=CH2+H2 +2H2O kat, t CH3 – CH(CH3) – CH2 – CH3 → CH2 = C(CH3) – CH = CH2+ 2H2 | 2СН4®С2Н2 + 3Н2 СаС2+2Н2О →Са(ОН)2+Н2↑ | С6Н14→С6Н6 + Н2 С6Н12→С6Н6 +3Н2 3С2Н2→С6Н6 |
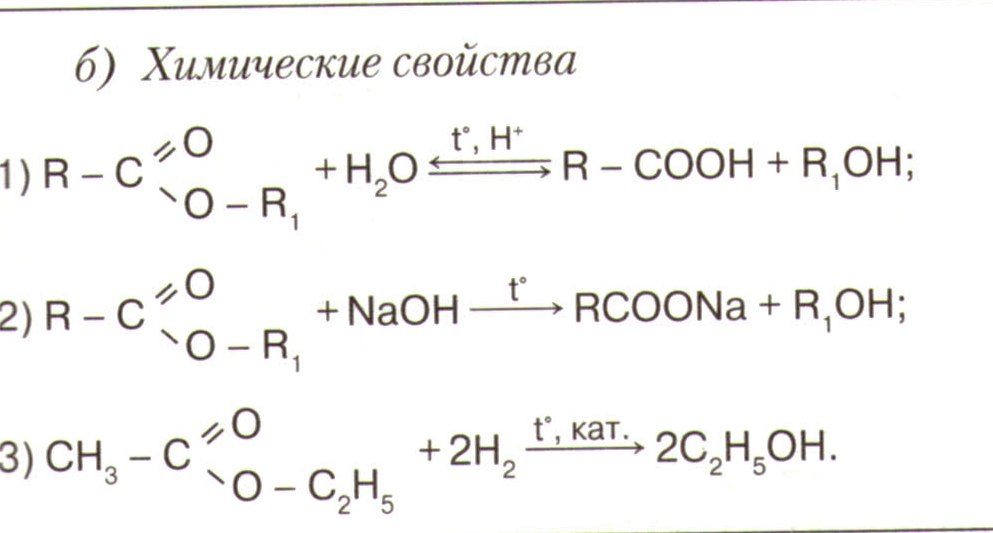
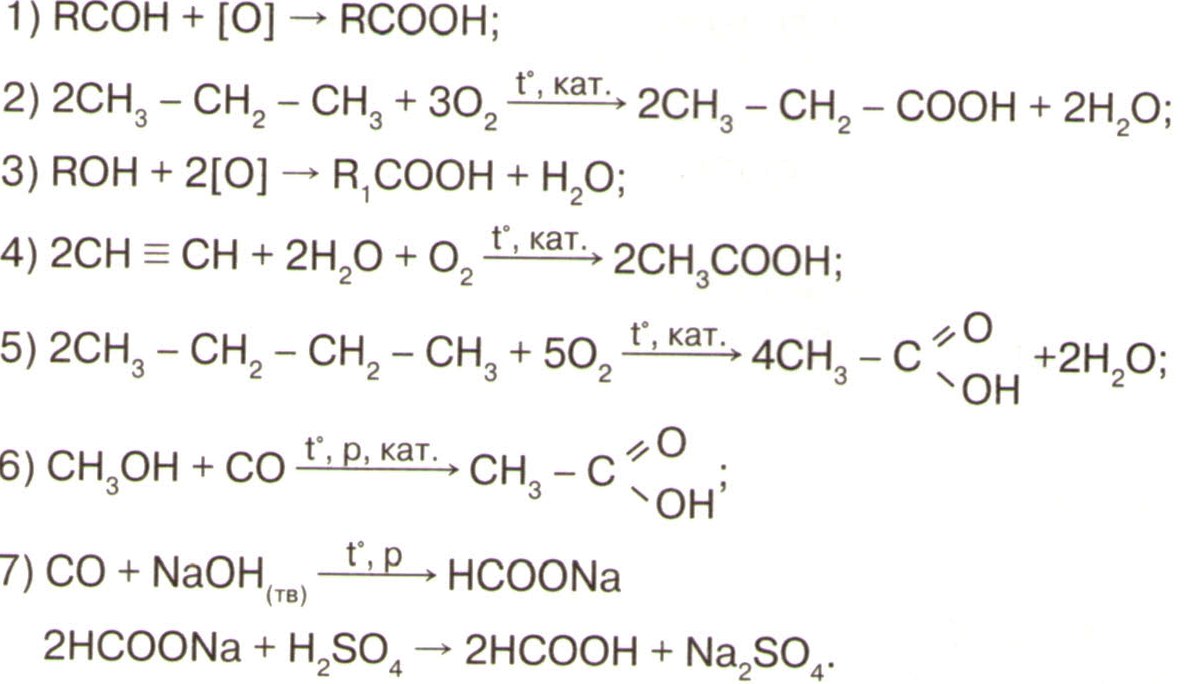
| Спирты | Альдегиды
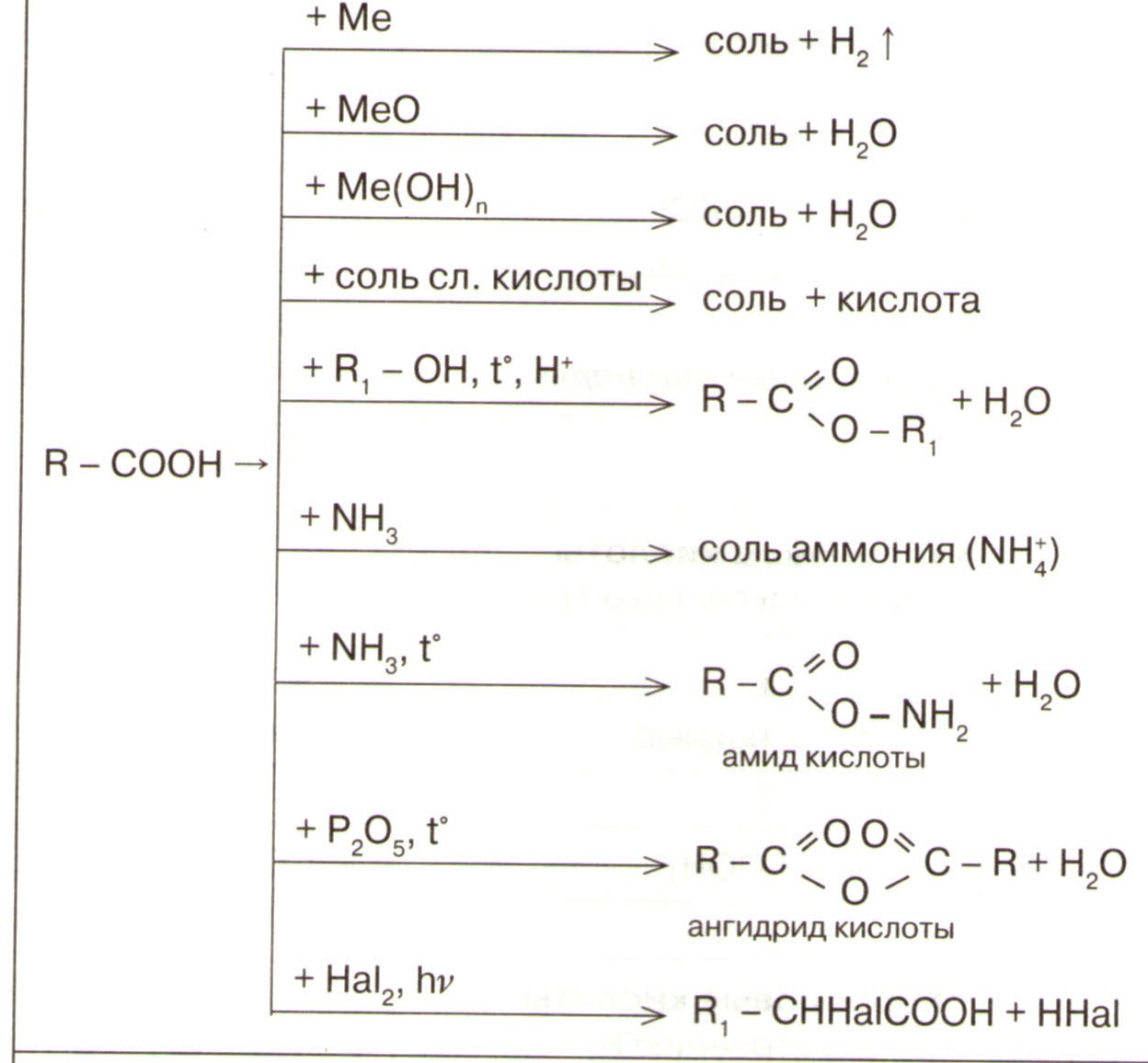
| Карбоновые кислоты
| эфиры |
|||
| Одноатомные | Многоатомные | Фенолы | ||||
| общая формула | CnH2n+1ОН ROH | C OH OH | C6H5ОН |
|
| R-COOR1 СnH2nO2 |
| название | ол | Этиленгликоль глицерин | Фенол | аль | овая | |
| изомеры | По углеводородному скелету межклассовая изомерия простые эфиры | По углеводородному скелету По положению функциональной группы | По углеводородному скелету | По углеводородному скелету изомерия углеродного скелета, начиная с С4 межклассовая изомерия с кетонами, начиная с С3 межклассовая изомерия с непредельными спиртами и простыми эфирами (с С3
| По углеводородному скелету межклассовая изомерия ( эфиры) | По углеводородному скелету межклассовая изомерия (кислоты) |
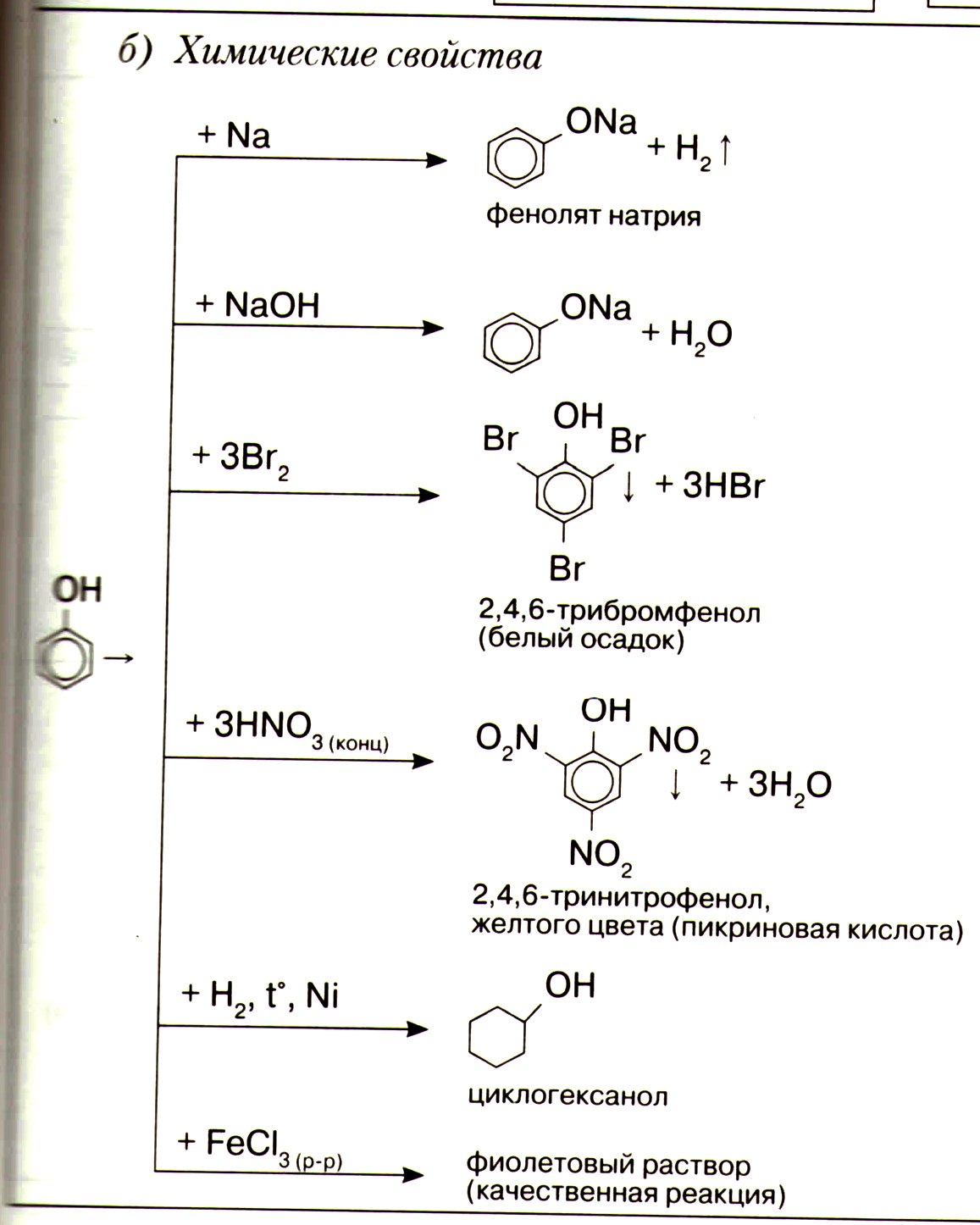
| Химические свойства | Горят С2Н5ОН + 3O2 → 2СO2 + 3Н2О | с CH2−CH2+Cu(OH)2→CH2−CH2+2H2O │ │ │ │ OH OH O-Cu-O C │ │ │ │ OH OH ONa ONa C │ │ │ │ OH OH Cl Cl C CH2−CH2 +2H2O │ │ O O │ │ C=O C=O │ │ CH3 CH3 | | с водородом
| |
|
| с галогеноводородами со щелочными металлами С2Н5ОН +Na→С2Н5ОNa +Н2 с карбоновыми кислотами С2Н5ОН + СН3СООН→Н2О+ СН3СООС2Н5 Спирты реагируют друг с другом с образованием простых эфиров С2Н5ОН + С2Н5ОН→ С2Н 5-О- С2Н5 + Н2О Р. Дегидратации С2Н5ОН→ С2Н4 + Н2О С2Н5ОН + CuO→Cu + СН3СОН + Н2О 2СН3–СН2– ОН →СН2=СН – СН=СН2 +2Н2О+ Н2 | ||||||
| Получение | 1. Гидротация алкенов: СН2 = СН2 +НОН →СН3 – СН2ОН 2. В лаборатории из галогеналканов: CH3Cl+NaOH → CH3OH+ NaCl 3. Гидролиз сложных эфиров. Н2О+ СН3СООС2Н5→ С2Н5ОН + СН3СООН 4. из синтез газа СО + 2Н2® СН3ОН 5.крахмал®С6Н12О6(глюкоза)®2С2Н5ОН + 2СО2 | С2H4+ KMnO4+H2O→ C2H4(OH)2+ KOH + MnO2 CH2−CH2+NaOH→CH2−CH2+2HCl │ │ │ │ Cl Cl OH OH |
| С2Н5ОН +CuO→Cu+СН3СОН+ Н2О C2H2+ Н2О → СН3СОН |
|
|
| 2 | |
| СН2=С-СН2-СН-СН-СН=С –СН3 │ │ │ │ СН3 СН3 С3Н7 С2 Н5 | СН2=С-СН2-СН-СН2-С=СН –С2Н5 │ │ │ СН3 С2Н5 С2Н5 |
1.Формула соединения содержит 75% углерода и 25% водорода:
а) C2H6 б) C8H14 в) C4H10 г) CH4
2.Формула соединения содержит 80% углерода и 20% водорода:
а) C2H6 б) C3H8 в) C4H10 г) CH4
3.Формула соединения содержит 82% углерода и 18% водорода:
а) C2H6 б) C8H14 в) C3H8 г) C6H10
4.Формула соединения содержит 88% углерода и 12% водорода:
а) C2H6 б) C8H14 в) C4H10 г) C2H4
5.Формула соединения содержит 75% углерода и 25% водорода:
а) C3H6 б) C8H14 в) C3H6 г) C4H10
6.Формула соединения содержит 86% углерода и 14% водорода:
а) C2H6 б) C8H14 в) C4H8 г) C4H10
7.Формула соединения содержит 88% углерода и 12% водорода:
а) C5H8 б) C8H14 в) C4H10 г) C2H6
8.Формула соединения содержит 87% углерода и 13% водорода:
а) C2H6 б) C6H10 в) C4H10 г) C8H14
9.Формула соединения содержит 87,5% углерода и 12,5% водорода:
а) C2H6 б) C8H14 в) C7H12 г) C4H10
10.Формула соединения содержит 84% углерода и 16% водорода:
а) C2H6 б) C8H18 в) C4H10 г) C8H14
11.Формула соединения содержит 86% углерода и 14% водорода:
а) C2H6 б) C8H14 в) C4H10 г) C8H16
12.Формула соединения содержит 87% углерода и 13% водорода:
а) C2H6 б) C8H14 в) C4H10 г) CH4
Здесь представлен конспект к уроку на тему «Систематика органических соединений», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.


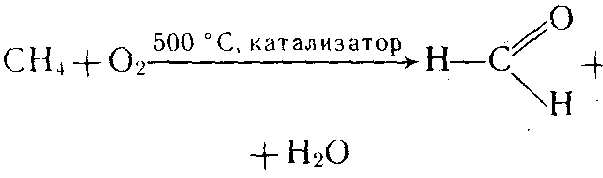

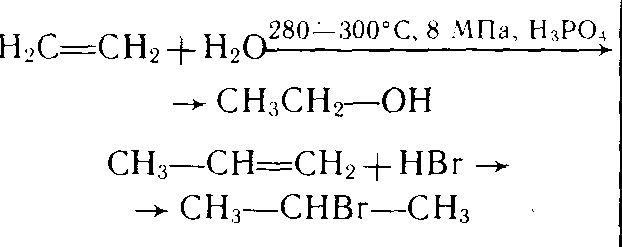


 H2−CH2
H2−CH2