Презентация "Подготовка к ГИА по химии" – проект, доклад
Презентацию на тему "Подготовка к ГИА по химии" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 39 слайд(ов).
Слайды презентации
Список похожих презентаций
ГИА по химии
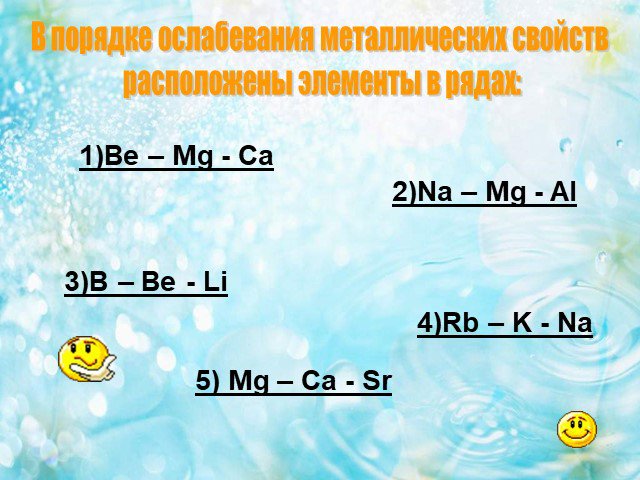
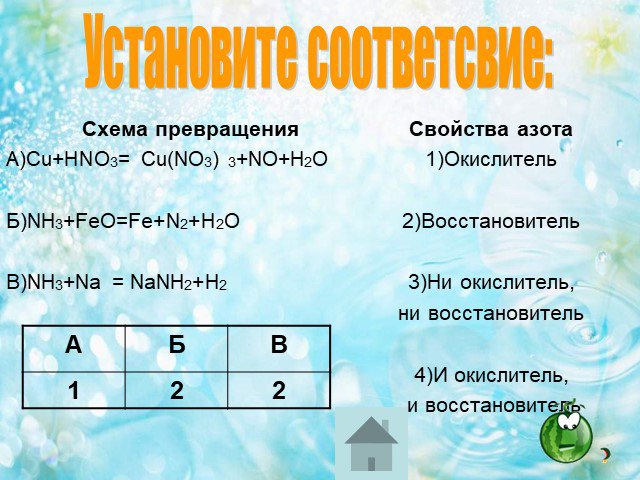
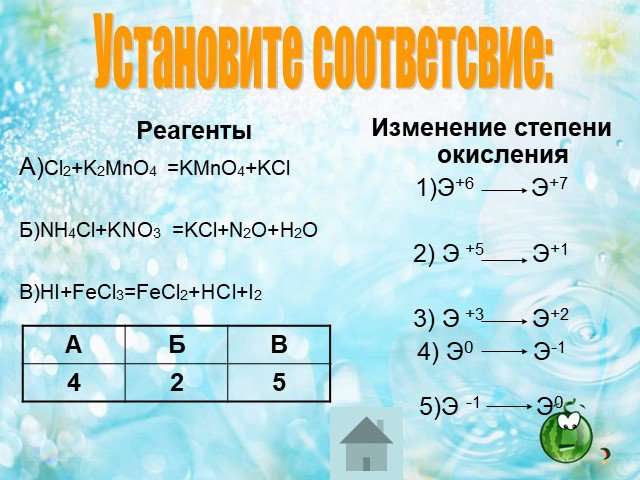
В 1-4. Задания В1 – В4 считаются выполненными верно, если в каждом из них правильно указана последовательность цифр. За полный правильный ответ ставится ...ГИА по химии
Структура работы. Часть 1 содержит 15 заданий с выбором ответа. Их обозначение в работе: А1; А2; А3; А4 … А15. Часть 2 содержит 4 задания с кратким ...Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам курса неорганической химии
Х И М И Ч Е С К А Я В И К Т О Р И Н А «Знаешь ли ты это? 11 класс. ТЕМА: «Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам ...Задания С 3 для подготовки к ГИА -9 по химии
№ 1. При нагревании красного порошка некоторого металла на воздухе порошок стал чёрным. Когда этот порошок растворили в серной кислоте, раствор приобрёл ...Неорганическая химия: подготовка к ГИА
Повторительное обобщение по неорганической химии, подготовка к ГИА. Классы веществ, их химические свойства и генетическая связь между классами Электролитическая ...Анализ ЕГЭ по химии 2011
Уровни выполнения экзаменационной работы. неудовлетворительный – 0–31 / 0–12, удовлетворительный –32–56 / 13–35, хороший – 57–77 / 36–56, отличный ...Алгоритм решения задач по химии
Алгоритм решения задач по химии:. Записать краткое условие задачи; *В случае необходимости произвести предварительный расчет; Перевести величины, ...Активизация обучающихся на уроках химии как показатель развития их мыслительной деятельности.
Приёмы активизации мыслительной деятельности обучающихся:. Приём стимулирующих звеньев Приём реконструкции Приём прогнозирования. Приём стимулирующих ...Азотная кислота по химии
Тема: «Азотная кислота» Цель урока: Рассмотреть свойства азотной кислоты и области ее применения. План урока: 1. Проверка Д/З (письменная работа); ...«Своя игра» по химии
Необходим в составе костей скелета. Меню. Лечебные элементы 20. Дезинфектор ран. Лечебные элементы 40. Избыток ионов этого элемента может вызвать ...«Деятельностно-компетентностный подход к преподаванию химии в средней школе через современные образовательные технологии»
КЛЮЧЕВЫЕ КОМПЕТЕНТНОСТИ. Общепредметные компетенции:. Предметные компетенции:. понятие о химии, как неотъемлемой составляющей естественно-научной ...Анализ результатов ЕГЭ по химии 2010 (окружной семинар учителей химии)
Результаты ЕГЭ 2010. Граница минимального балла -33 тестовых балла (12 первичных баллов). Уровни оценивания: неудовлетворительный – 0–32 / 0–11; удовлетворительный ...Новые подходы к обучению химии в средней школе в свете новых образовательных стандартов
Обучение химии Работа на уроке. Домашняя подготовка. Элективные курсы Факультативы. Химические кружки. Олимпиады. Проектная деятельность школьников. ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
Химическая среда. Сама вода является очень слабым электролитом. При её электролитической диссоциации образуются катионы водорода и гидроксид-ионы ...Методы познания химии
09.09.2018. Метод (от греческого слова «методос» — путь к чему-либо) означает совокупность приемов и операций практического и теоретического освоения ...Изучение отдельных тем базового содержания курса химии в 8 классе, на основе технологии полного усвоения
Проблема. Усвоение всеми учащимися базового содержания образования через обучение в соответствии с индивидуальными особенностями восприятия и усвоения. ...Викторина по химии
1.Газ, который применили во время первой мировой войны в качестве химического оружия. 2. Единственный жидкий металл. 3.Русский учёный - энциклопедист. ...Викторина по химии "Что это?"
РЕБЯТА!!! ЗА МНОЙ!!! К ВИКТОРИНЕ «ЧТО ЭТО?». ОПРЕДЕЛЯЕМ, О КАКИХ ВЕЩЕСТВАХ ИДЕТ РЕЧЬ??? 1 2 4 5 6 7 8 9 10 11 12 ВЫБИРАЙ!! Трудно представить, что ...Викторина «Своя игра» по химии
Вопрос. Отечественный ученый, назвавший человека – «мощной геологической силой, способной изменить лик Земли»? Как называется нарушение природной ...Игра-зачет по химии 8 клас
Приветствие команд. Команда №4 Команда №3 Команда №2 Команда №1. Условия игры. Блиц-турнир (по 3 вопроса) Каждая команда по очереди выбирает вопрос, ...Конспекты
Решение экспериментальных задач по органической химии
Конспект открытого урока . Практическая работа №4 «Решение экспериментальных задач по органической химии». Класс:10. УМК: Рудзитис Г.Е., ФельдманФ.Г. ...Обобщающее повторение по неорганической химии
Обобщающее повторение по неорганической химии за курс 8 класса. Разработан Савич Еленой Николаевной учителем биологии, химии Донецкой СШ с. Донецкое, ...Материалы для индивидуальной работы по химии
Предмет: химия. Учитель: Пестова Татьяна Михайловна. Класс: 8. Материалы для индивидуальной работы по химии. Индивидуальные задания разнообразны ...Развитие интеллекта и творческих способностей учащихся на уроках химии
Перед современной школой стоит задача воспитания грамотного, продуктивно мыслящего человека, адаптированного к условиям жизни в обществе. Проблема ...Развитие познавательной самостоятельности на уроках химии через составление химических задач
Развитие познавательной самостоятельности на уроках химии через составление химических задач. «Не мыслям надо учить, а мыслить…». . И.Кант. ...методическая разработка урока по химии
Муниципальное бюджетное общеобразовательное учреждение. « Средняя общеобразовательная школа села Алексеевка ». Базарно – Карабулакского района Саратовской ...Лабораторные опыты по неорганической химии (свойства кислот, оснований, солей)
III. . . . Технологическая карта урока. ЭТАПЫ УРОКА. ДЕЯТЕЛЬНОСТЬ УЧИТЕЛЯ. . ДЕЯТЕЛЬНОСТЬ УЧЕНИКА. . 1.Организационный. . момент. ...Использование опорных схем на уроках химии
Муниципальное образовательное автономное учреждение средняя общеобразовательная школа с углубленным изучением отдельных предметов №1 г. Белогорск, ...Белки. На перекрестках химии и биологии
Урок в 10 классе «Белки. На перекрестках химии и биологии». Цель урока:. систематизация и углубление знаний учащихся по теме «Белки». Образовательные ...Валентность. Составление формул по валентности
Разработка урока Валентность. Составление формул по валентности. . Тема урока: Валентность. Составление формул по валентности. Цель урока:. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 января 2015
Категория:Химия
Содержит:39 слайд(ов)
Поделись с друзьями:
Скачать презентацию