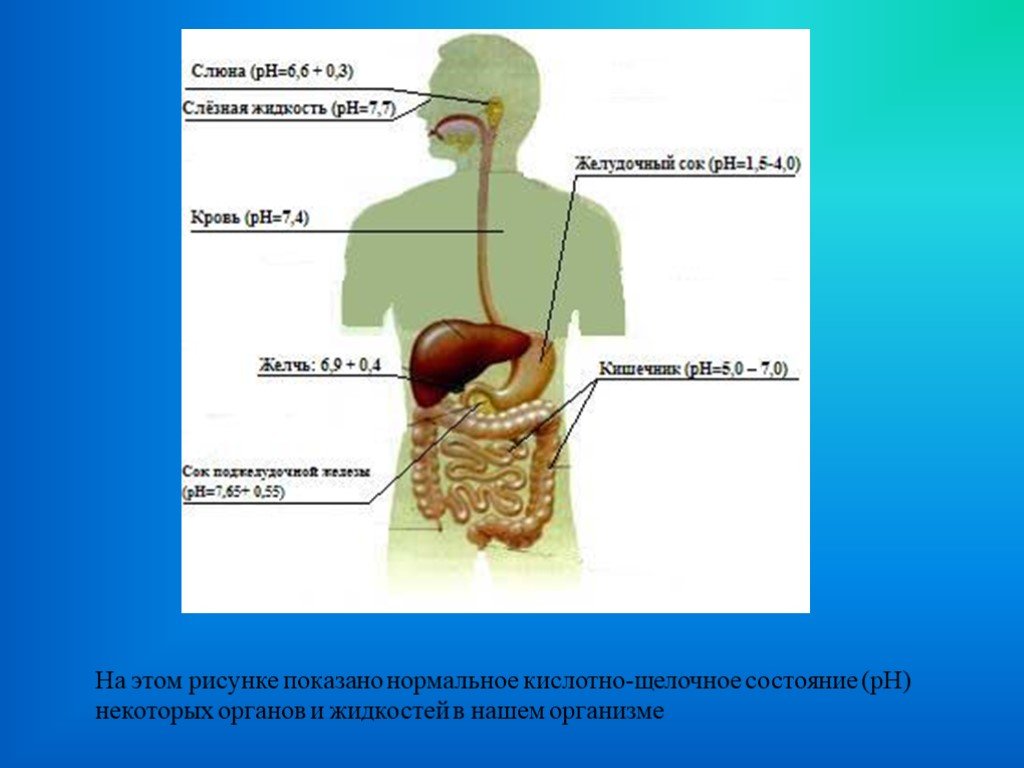
Презентация "рН среды и здоровье человека" по химии – проект, доклад
Презентацию на тему "рН среды и здоровье человека" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 23 слайд(ов).
Слайды презентации
Список похожих презентаций
Этиловый спирт и его влияние на здоровье человека
Этиловый спирт и его влияние на организм человека. Урок-исследование по химии в 10 классе Е.В. Герасименко, учитель химии МОУ СОШ с. Кубанка Переволоцкого ...Яблоки и здоровье человека
Химический состав яблок. Витамины: группы В, РР, С, К, Е, Р. Дубильные вещества. Фитонциды Пектин Каротины. Цель исследования:. Выявление взаимосвязи ...Влияние пищевых добавок на здоровье человека
Есть большая разница между тем, что любит есть человек и что любит организм. Что мы едим? У молодёжи широко распространены привычки неправильного ...Химия и здоровье человека
Улучшить здоровье детей - задача для школы непосильная. Целью работы школьного коллектива может быть только охрана и сохранение здоровья, мотивация ...Йод и здоровье человека
«…нос ее заострился, глаза вылезли из орбит, лицо и шея вздулись, мачеха стала трястись…». А может быть подобное превращение в жизни ? Более чем в ...Химические элементы металлы и здоровье человека
Ионы этого металла входят в состав вещества, употребляемого в пищу и называемого «белой смертью». Существенными источниками этого элемента являются ...Влияние эфирного масла и конкрета из шалфея мускатного на организм человека
Введение. Эфирные масла - это пахучие вещества, которые вырабатываются эфиромасличными растениями и обусловливают их запах и практическую ценность. ...Галогены и здоровье человека
Цель презентации. используя знания из области биологии, физиологии, медицины, исторические факты, показать важную роль галогенов для нормальной жизнедеятельности ...Роль химии в жизни человека
«Широко простирает химия руки свои в дела человеческие» М. В. Ломоносов. Повсюду, куда бы ни обратил свой взор, нас окружают предметы и изделия, изготовленные ...Роль железа в жизни человека
Мы с вами живём в железный век. Поэтому мне хотелось узнать, когда появилось железо, в виде каких соединений встречается, какую роль играет для живых ...Радиация и её воздействие на человека
Содержание. 1.Введение 2.Источники облучения 3.Источники излучения, созданные руками человека 4.Последствия радиационных излучений и ядерных взрывов ...Химия и жизнь человека
Содержание. Химия и пища Химические средства гигиены и косметики Химические вещества в быту Химия и производство Химия и сельское хозяйство Химия ...Химическое загрязнение среды
На всех стадиях своего развития человек был тесно связан с окружающим миром. Но с тех пор как появилось высокоиндустриальное общество, опасное вмешательство ...Химические элементы в организме человека
Роль химических элементов в организме человека. «Надо учиться не для того, чтобы стать ученым, а только для того, чтобы научиться жить лучше» Л.Н.Толстой. ...Значение соли для человека
Цель проекта:. Определить значение соли для организма человека. При опросе «Часто ли вы употребляете соль?»: 72% опрашуемых ответили «Часто» 16% опрашуемых ...Гидролиз органических веществ, содержащихся в продуктах питания человека
Цели и задачи проекта:. Показать практическую значимость знаний, полученных при изучении органической химии и биологии в 10 классе; Систематизировать ...Галогены в организме человека
Цель презентации. используя знания из области биологии, физиологии, медицины, исторические факты, показать важную роль галогенов для нормальной жизнедеятельности ...Вредное воздействие нитратов на организм человека
Содержание. Введение Цель проекта Задачи проекта Основные источники Качество овощей и условия их выращивания Вредное воздействие нитратов на организм ...Вода в природе и жизни человека
Цель урока: обобщить, проанализировать и расширить знания о воде, ее роли в живой и неживой природе, в жизни человека, о необходимости бережного отношения ...Вода в жизни человека
Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое! Нельзя сказать, что ты необходима ...Конспекты
Здоровье человека-показатель качества окружающей среды
Урок окружающей среды. по теме. :. «Здоровье человека-показатель качества окружающей среды». проведен в 7-б классе 03.10.2013 г., в ГБОУ СОШ№71 ...Этиловый спирт и его влияние на здоровье человека
. . . . Интегрированный урок в 10 классе. (химия, биология). Учитель химии и биологии. МОУ ...Важнейшие классы бинарных соединений – оксиды их роль в природе и жизни человека
Государственное казённое образовательное учреждение Ростовской области. общеобразовательная школа-интернат основного общего образования. п. Шолоховского ...Химические элементы и здоровье человека
. Отдел образования администрации. . Тальменского района Алтайского края. Муниципальное общеобразовательное учреждение. Тальменская средняя ...Важнейшие классы бинарных соединений – оксиды, их роль в природе и жизни человека
Урок химии в 8 классе по теме:. «Важнейшие классы бинарных соединений – оксиды, их роль в природе и жизни человека». Цели урока:. Предметные. ...Металлы в окружающей среде и здоровье человека
Тема урока:. «Металлы в окружающей среде и здоровье человека». (урок-конференция). 9 класс. Цели урока:. 1. Сформировать у учащихся представления ...Спирты Действие спиртов на организм человека
Конспект урока по химии в 10 классе. . Валеева Елена Николаевна,. . учитель химии. первой квалификационной категории. МБОУ «Гимназия №32». ...Состав мыла и его моющие действия. Понятие о СМС. Охрана окружающей среды от загрязнения ПАВ
Тема: Состав мыла и его моющие действия. Понятие о СМС. Охрана окружающей среды от загрязнения ПАВ. Цель: Ознакомить с составом и свойствами мыла. ...Роль химии в жизни человека
Ткаченко Алла Евгеньевна. . . КОНСПЕКТ УРОКА ХИМИИ. . . ТЕМА « ВВЕДЕНИЕ В ХИМИЮ. РОЛЬ ХИМИИ В ЖИЗНИ ЧЕЛОВЕКА ...Развитие нефтяной промышленности в РК и проблемы охраны окружающей среды
Краснокиевская средняя школа Тайыншинский район. Северо-Казахстанская область. Учитель химии Гринёва Оксана Викторовна. Тема урока:. Развитие ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:8 ноября 2018
Категория:Химия
Содержит:23 слайд(ов)
Поделись с друзьями:
Скачать презентацию