Презентация "Подготовка к ЕГЭ. Полезно знать" по химии – проект, доклад
Презентацию на тему "Подготовка к ЕГЭ. Полезно знать" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 23 слайд(ов).
Слайды презентации
Список похожих презентаций
Подготовка к ЕГЭ: Кислородсодержащие органические соединения. Карбоновые кислоты
Органические карбоновые кислоты характеризуются наличием карбоксильной группы –СООН. По числу групп различают: одно- СН3-СООН – уксусная или этановая ...Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам курса неорганической химии
Х И М И Ч Е С К А Я В И К Т О Р И Н А «Знаешь ли ты это? 11 класс. ТЕМА: «Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам ...Подготовка к ЕГЭ "Строение атома"
Число электронов во внешнем электронном слое атома, ядро которого содержит 8 протонов, равно. 1) 8 2) 2 3) 6 4) 4. Число электронов в ионе железа ...Электролиз: что полезно знать
Автор работы: ученик 10 класса ГБОУ СОШ № 1465 Попов Сергей г. Москва. Руководитель : Учитель химии- Попова Светлана Анатольевна. Электролиз - это ...Подготовка к контрольной работе №1.
Подготовка к контрольной работе №1. 8 класс. 1. Из перечня формул выпишите оксиды, кислоты, соли и основания. Дайте им названия. CaO, Ca(OH)2, MgO, ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
Содержание химии очень обширно и часто предстает копилкой огромного числа формул, уравнений, фактов и законов, запомнить которые не просто трудно, ...Углеводороды в вопросах ЕГЭ
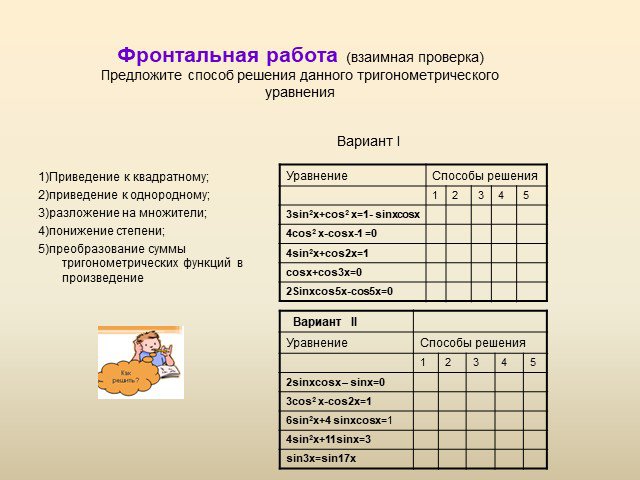
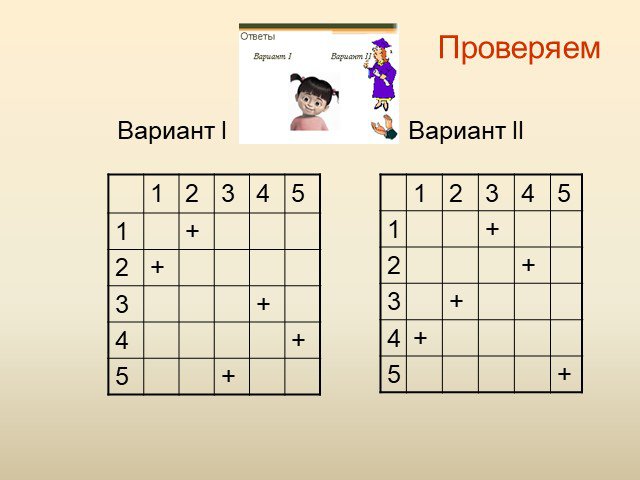
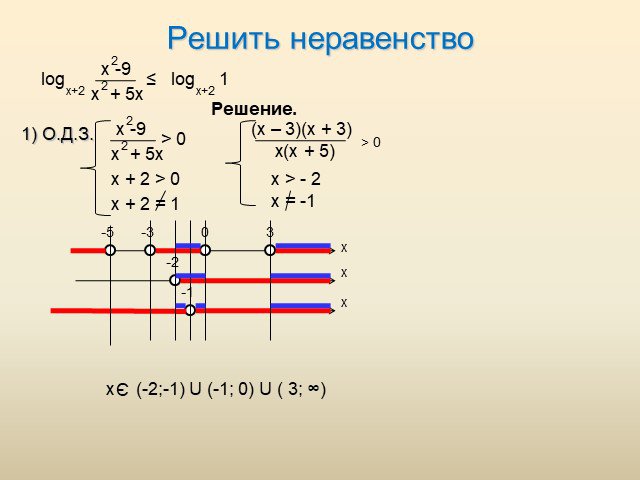
Силу ума придают упражнения, а не покой. Учащиеся должны. Знать классы углеводородов и их общие формулы Уметь составлять формулы углеводородов Уметь ...Текстовые задачи в ЕГЭ
№1 В 2литровый водный раствор с 60% содержанием кислоты добавили 4 л чистой воды. Определите процентное содержание кислоты в новом растворе. №1 Решение: ...Сложные вопросы ЕГЭ по химии
«Чтобы избегать ошибок, надо набираться опыта; чтобы набираться опыта, надо делать ошибки». С1. Используя метод электронного баланса, составьте уравнение ...ЕГЭ ПО ХИМИИ
Структура части С КИМов по химии в 2006 году. С1. Окислительно-восстановительные реакции С2. Составление возможных уравнений реакций С3. Цепочки превращений ...ЕГЭ по химии
Количество участников и итоги 2011 г. В СПб Зарегистрировано - 3703 Явились - 2671 (72,1%) Неудовлетворительно – 156 чел. (5,84%) Средний балл – 54,43 ...Готовимся к ЕГЭ по химии
Перечень учебных пособий, разработанных с участием ФИПИ по химии. ГИА-2010. Экзамен в новой форме. Химия. 9 класс/ ФИПИ авторы составители: А.А. Каверина, ...Анализ результатов ЕГЭ по химии 2010 (окружной семинар учителей химии)
Результаты ЕГЭ 2010. Граница минимального балла -33 тестовых балла (12 первичных баллов). Уровни оценивания: неудовлетворительный – 0–32 / 0–11; удовлетворительный ...Анализ ЕГЭ по химии 2011
Уровни выполнения экзаменационной работы. неудовлетворительный – 0–31 / 0–12, удовлетворительный –32–56 / 13–35, хороший – 57–77 / 36–56, отличный ...Подготовка к олимпиадам по химии
ЦЕЛИ ТУРНИРА:. ВЫЯВИТЬ НАИБОЛЕЕ ПОДГОТОВЛЕННЫХ УЧАЩИХСЯ, ИМЕЮЩИХ ОСОБЫЕ СПОСОБНОСТИ И СКЛОННОСТИ К ПРЕДМЕТУ ХИМИЯ. ПОДДЕРЖАТЬ И РАЗВИТЬ ПОЗНАВАТЕЛЬНЫЕ ...Решение заданий С1 вариантов ЕГЭ
Расставьте коэффициенты методом электронного баланса. K2Cr2O7 + HCl (k) = Cl2 + ….. + KCl + H2O Cr+6 +3 e = Cr+3 2Cl-1 -2e = Cl20 K2Cr2O7 + 14 HCl ...Консультация экспертов ЕГЭ по химии 2012 год
С1. Cr2(SO4)3 + Br2 + NaOH = = Na2CrO4 + NaBr + Na2SO4+ H2O. 2 Cr+3 – 3e- → Cr+6 ок-е 3 Br2 + 2e- → 2Br -1 в-е. 3 6 16 8. C2-2012. Демо-2012. Соль, ...Современное представление о строении атома. Готовимся к ЕГЭ и ОГЭ!
Химия – наука о веществах, их свойствах и превращениях. Неорганическая химия. Органическая химия. По признакам. Вещество – это форма существования ...Методические рекомендации по подготовке к ЕГЭ по химии
Кодификатор. Программа элективного курса «окислительно-восстановительные реакции». H2O2 H2SO4. «окислительно-восстановительные реакции в органической ...Типичные ошибки при выполнении заданий ЕГЭ по химии
Статистические данные ЕГЭ показывают, что каждый год у выпускников возникают определенные трудности, связанные со слабым знанием одних и тех же тем. ...Конспекты
ЕГЭ на 100 баллов
Майорова Анастасия Леонидовна,. . учитель химии. МБНОУ лицей № 22 города Белово,. Кемеровская область. ЕГЭ на 100 баллов. Программа ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Неизвестен
Содержит:23 слайд(ов)
Поделись с друзьями:
Скачать презентацию





























![Решить неравенство: (х-1) (х+8). 5-х ≥ 0 Нули: ; -8 5. Есть промежуток, которому принадлежит число 0 На этом промежутке установим знак. При х = 0 имеем: ( -1) ( +8) - х ≥ 0 < э х (- ; -8] 8 ∩ [1 ; 5) Ответ: Решить неравенство: (х-1) (х+8). 5-х ≥ 0 Нули: ; -8 5. Есть промежуток, которому принадлежит число 0 На этом промежутке установим знак. При х = 0 имеем: ( -1) ( +8) - х ≥ 0 < э х (- ; -8] 8 ∩ [1 ; 5) Ответ:](https://prezentacii.org/upload/cloud/14/09/4705/images/thumbs/screen10.jpg)







![- (0,5) x +3x-2 2x +2x-1 1) О.Д.З. 5 - 1 = 0, х = 0 2) На О.Д.З. имеем: 2 - 2 5 - 5 2x +6x-4 1-2х-2х (2 – 1)( (5 – 1)(х – 0) 2x + 6x - 4 - (1-2х-2х )) 1+ 2х + 2х 4х + 8х -5 х 4( x - )( x +2,5) x ( - ∞ ; ] U ( 0; ] 5 - 1 -2,5 - (0,5) x +3x-2 2x +2x-1 1) О.Д.З. 5 - 1 = 0, х = 0 2) На О.Д.З. имеем: 2 - 2 5 - 5 2x +6x-4 1-2х-2х (2 – 1)( (5 – 1)(х – 0) 2x + 6x - 4 - (1-2х-2х )) 1+ 2х + 2х 4х + 8х -5 х 4( x - )( x +2,5) x ( - ∞ ; ] U ( 0; ] 5 - 1 -2,5](https://prezentacii.org/upload/cloud/14/09/4705/images/thumbs/screen22.jpg)