Презентация "Консультация экспертов ЕГЭ по химии 2012 год" – проект, доклад
Презентацию на тему "Консультация экспертов ЕГЭ по химии 2012 год" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 14 слайд(ов).
Слайды презентации
Список похожих презентаций
Анализ результатов ЕГЭ по химии 2010 (окружной семинар учителей химии)
Результаты ЕГЭ 2010. Граница минимального балла -33 тестовых балла (12 первичных баллов). Уровни оценивания: неудовлетворительный – 0–32 / 0–11; удовлетворительный ...ЕГЭ по химии
Количество участников и итоги 2011 г. В СПб Зарегистрировано - 3703 Явились - 2671 (72,1%) Неудовлетворительно – 156 чел. (5,84%) Средний балл – 54,43 ...Анализ ЕГЭ по химии 2011
Уровни выполнения экзаменационной работы. неудовлетворительный – 0–31 / 0–12, удовлетворительный –32–56 / 13–35, хороший – 57–77 / 36–56, отличный ...ЕГЭ ПО ХИМИИ
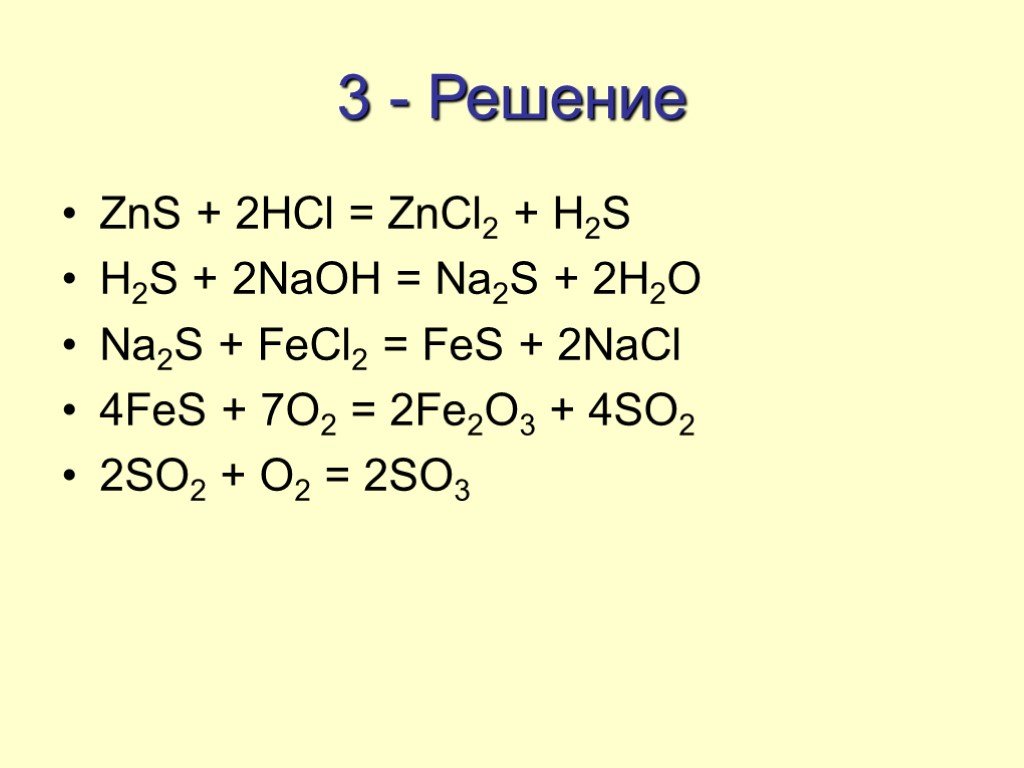
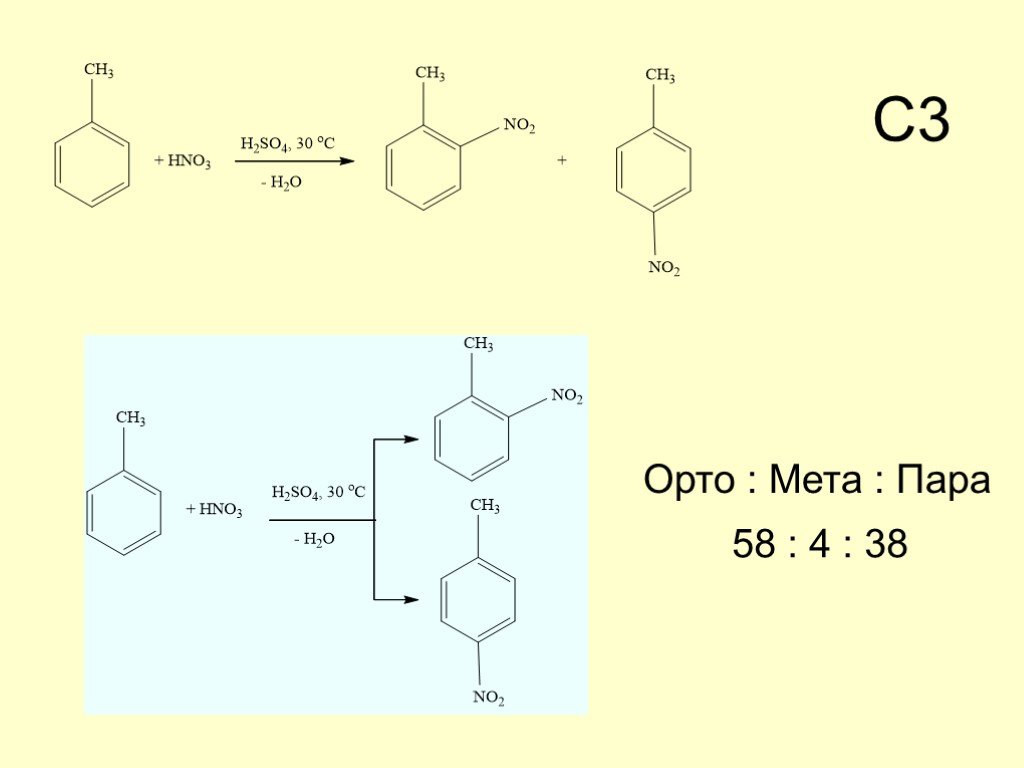
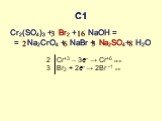
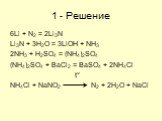
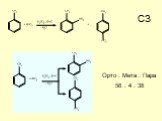
Структура части С КИМов по химии в 2006 году. С1. Окислительно-восстановительные реакции С2. Составление возможных уравнений реакций С3. Цепочки превращений ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
Содержание химии очень обширно и часто предстает копилкой огромного числа формул, уравнений, фактов и законов, запомнить которые не просто трудно, ...Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам курса неорганической химии
Х И М И Ч Е С К А Я В И К Т О Р И Н А «Знаешь ли ты это? 11 класс. ТЕМА: «Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам ...Методические рекомендации по подготовке к ЕГЭ по химии
Кодификатор. Программа элективного курса «окислительно-восстановительные реакции». H2O2 H2SO4. «окислительно-восстановительные реакции в органической ...Готовимся к ЕГЭ по химии
Перечень учебных пособий, разработанных с участием ФИПИ по химии. ГИА-2010. Экзамен в новой форме. Химия. 9 класс/ ФИПИ авторы составители: А.А. Каверина, ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
Химическая среда. Сама вода является очень слабым электролитом. При её электролитической диссоциации образуются катионы водорода и гидроксид-ионы ...Алгоритм решения задач по химии
Алгоритм решения задач по химии:. Записать краткое условие задачи; *В случае необходимости произвести предварительный расчет; Перевести величины, ...Активизация обучающихся на уроках химии как показатель развития их мыслительной деятельности.
Приёмы активизации мыслительной деятельности обучающихся:. Приём стимулирующих звеньев Приём реконструкции Приём прогнозирования. Приём стимулирующих ...Азотная кислота по химии
Тема: «Азотная кислота» Цель урока: Рассмотреть свойства азотной кислоты и области ее применения. План урока: 1. Проверка Д/З (письменная работа); ...«Своя игра» по химии
Необходим в составе костей скелета. Меню. Лечебные элементы 20. Дезинфектор ран. Лечебные элементы 40. Избыток ионов этого элемента может вызвать ...«Деятельностно-компетентностный подход к преподаванию химии в средней школе через современные образовательные технологии»
КЛЮЧЕВЫЕ КОМПЕТЕНТНОСТИ. Общепредметные компетенции:. Предметные компетенции:. понятие о химии, как неотъемлемой составляющей естественно-научной ...Обобщающий урок-тест по химии "Металлы"
Вопрос №1. Какой металл занимает первое место в земной коре среди металлов: 1) железо 2) медь 3) алюминий 4) цинк. Вопрос №2. Какой из металлов при ...Методы познания химии
09.09.2018. Метод (от греческого слова «методос» — путь к чему-либо) означает совокупность приемов и операций практического и теоретического освоения ...Изучение отдельных тем базового содержания курса химии в 8 классе, на основе технологии полного усвоения
Проблема. Усвоение всеми учащимися базового содержания образования через обучение в соответствии с индивидуальными особенностями восприятия и усвоения. ...Викторина по химии "Что это?"
РЕБЯТА!!! ЗА МНОЙ!!! К ВИКТОРИНЕ «ЧТО ЭТО?». ОПРЕДЕЛЯЕМ, О КАКИХ ВЕЩЕСТВАХ ИДЕТ РЕЧЬ??? 1 2 4 5 6 7 8 9 10 11 12 ВЫБИРАЙ!! Трудно представить, что ...Викторина по химии
1.Газ, который применили во время первой мировой войны в качестве химического оружия. 2. Единственный жидкий металл. 3.Русский учёный - энциклопедист. ...Игра-зачет по химии 8 клас
Приветствие команд. Команда №4 Команда №3 Команда №2 Команда №1. Условия игры. Блиц-турнир (по 3 вопроса) Каждая команда по очереди выбирает вопрос, ...Конспекты
методическая разработка урока по химии
Муниципальное бюджетное общеобразовательное учреждение. « Средняя общеобразовательная школа села Алексеевка ». Базарно – Карабулакского района Саратовской ...Обобщающее повторение по неорганической химии
Обобщающее повторение по неорганической химии за курс 8 класса. Разработан Савич Еленой Николаевной учителем биологии, химии Донецкой СШ с. Донецкое, ...Материалы для индивидуальной работы по химии
Предмет: химия. Учитель: Пестова Татьяна Михайловна. Класс: 8. Материалы для индивидуальной работы по химии. Индивидуальные задания разнообразны ...Развитие познавательной самостоятельности на уроках химии через составление химических задач
Развитие познавательной самостоятельности на уроках химии через составление химических задач. «Не мыслям надо учить, а мыслить…». . И.Кант. ...Лабораторные опыты по неорганической химии (свойства кислот, оснований, солей)
III. . . . Технологическая карта урока. ЭТАПЫ УРОКА. ДЕЯТЕЛЬНОСТЬ УЧИТЕЛЯ. . ДЕЯТЕЛЬНОСТЬ УЧЕНИКА. . 1.Организационный. . момент. ...Решение экспериментальных задач по органической химии
Конспект открытого урока . Практическая работа №4 «Решение экспериментальных задач по органической химии». Класс:10. УМК: Рудзитис Г.Е., ФельдманФ.Г. ...Использование опорных схем на уроках химии
Муниципальное образовательное автономное учреждение средняя общеобразовательная школа с углубленным изучением отдельных предметов №1 г. Белогорск, ...Развитие интеллекта и творческих способностей учащихся на уроках химии
Перед современной школой стоит задача воспитания грамотного, продуктивно мыслящего человека, адаптированного к условиям жизни в обществе. Проблема ...Белки. На перекрестках химии и биологии
Урок в 10 классе «Белки. На перекрестках химии и биологии». Цель урока:. систематизация и углубление знаний учащихся по теме «Белки». Образовательные ...Валентность. Составление формул по валентности
Разработка урока Валентность. Составление формул по валентности. . Тема урока: Валентность. Составление формул по валентности. Цель урока:. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:17 июня 2018
Категория:Химия
Содержит:14 слайд(ов)
Поделись с друзьями:
Скачать презентацию