Презентация "ЕГЭ ПО ХИМИИ" – проект, доклад
Презентацию на тему "ЕГЭ ПО ХИМИИ" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 20 слайд(ов).
Слайды презентации
Список похожих презентаций
Консультация экспертов ЕГЭ по химии 2012 год
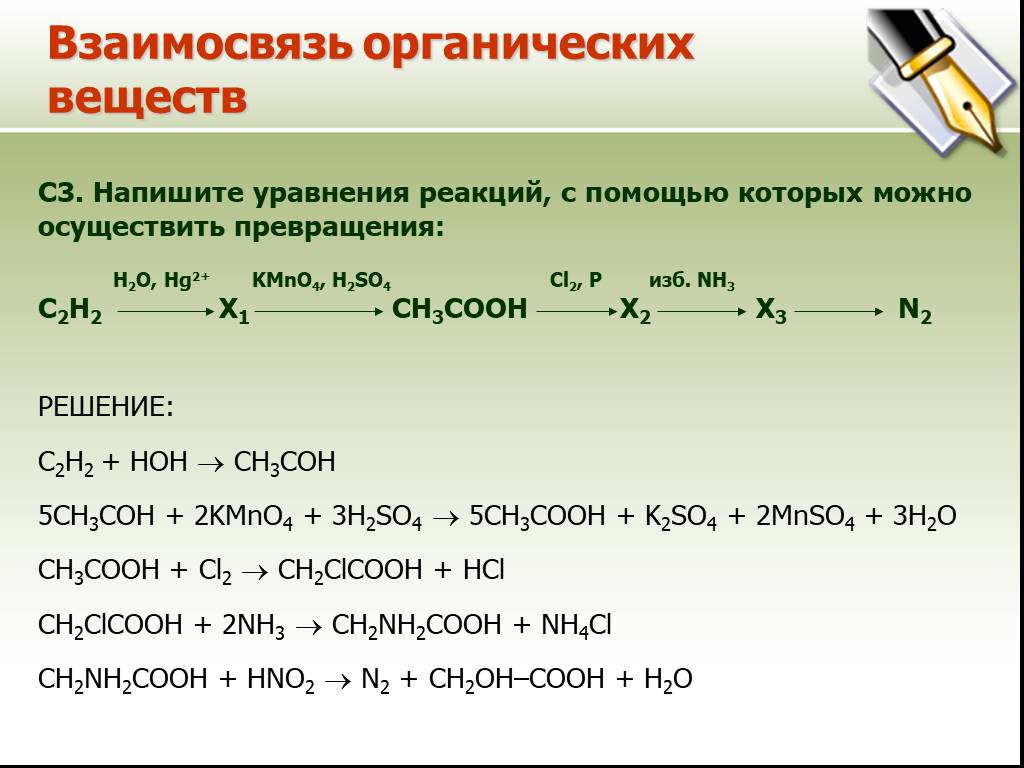
С1. Cr2(SO4)3 + Br2 + NaOH = = Na2CrO4 + NaBr + Na2SO4+ H2O. 2 Cr+3 – 3e- → Cr+6 ок-е 3 Br2 + 2e- → 2Br -1 в-е. 3 6 16 8. C2-2012. Демо-2012. Соль, ...ЕГЭ по химии
Количество участников и итоги 2011 г. В СПб Зарегистрировано - 3703 Явились - 2671 (72,1%) Неудовлетворительно – 156 чел. (5,84%) Средний балл – 54,43 ...Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам курса неорганической химии
Х И М И Ч Е С К А Я В И К Т О Р И Н А «Знаешь ли ты это? 11 класс. ТЕМА: «Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам ...Готовимся к ЕГЭ по химии
Перечень учебных пособий, разработанных с участием ФИПИ по химии. ГИА-2010. Экзамен в новой форме. Химия. 9 класс/ ФИПИ авторы составители: А.А. Каверина, ...Анализ результатов ЕГЭ по химии 2010 (окружной семинар учителей химии)
Результаты ЕГЭ 2010. Граница минимального балла -33 тестовых балла (12 первичных баллов). Уровни оценивания: неудовлетворительный – 0–32 / 0–11; удовлетворительный ...Анализ ЕГЭ по химии 2011
Уровни выполнения экзаменационной работы. неудовлетворительный – 0–31 / 0–12, удовлетворительный –32–56 / 13–35, хороший – 57–77 / 36–56, отличный ...Методические рекомендации по подготовке к ЕГЭ по химии
Кодификатор. Программа элективного курса «окислительно-восстановительные реакции». H2O2 H2SO4. «окислительно-восстановительные реакции в органической ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
Содержание химии очень обширно и часто предстает копилкой огромного числа формул, уравнений, фактов и законов, запомнить которые не просто трудно, ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
Химическая среда. Сама вода является очень слабым электролитом. При её электролитической диссоциации образуются катионы водорода и гидроксид-ионы ...Ломоносов и химия
В 2011 году исполнится 300 лет со дня рождения великого русского ученого, основателя Московского государственного университета Михаила Васильевича ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...Коллоидная химия
3 Пособия. Лекции, конспекты практических занятий. Фридрихсберг Д.А. Курс коллоидной химии. Л., «Химия». 1984. 368 с. Сумм Б.Д. Коллоидная химия. ...Коррозия металла химия
Цель презентации. В этой презентации мы рассмотрим процесс коррозии металлов как окислительно-восстановительную реакцию. Изучим : что такое коррозия; ...Зелёная химия
Человечество, через два столетия развития современной химии и через сто лет промышленного ее применения, пришло к той незримой черте, когда очевидны ...Интересная химия
Введение:. Химия – удивительная наука. С одной стороны, она очень конкретная и имеет дело с бесчисленными полезными и вредными веществами вокруг нас ...женщины и химия
Книга Марсе послідовним викладом предмета в доступній формі відкрила хімію для широкого кола читачів, а у деяких зумовила їх життєвий шлях. Хто ж ...Всё на свете химия!
А что же такое химия? Наука о веществах и превращениях друг в друга. Химия в быту. Химия в быту, сравнительно молодая наука, является нашим незаменимым ...Викторина "Занимательная химия"
Какой химический элемент III группы Периодической системы носит название соснового леса? Какой химический элемент, исследованием которого Д. И. Менделеев ...Бытовая химия
Цель исследования, изучить влияние препаратов бытовой химии на здоровье человека. Задачи исследования: 1. Изучить опасности современной бытовой химии; ...«Жиры» химия
жиры. Оглавление. Определение и общая формула Физические свойства Химические свойства Классификация жиров Животные жиры Растительные жиры Роль жиров ...Конспекты
РЕШЕНИЕ ЗАДАЧ ПО ХИМИИ
ПРОГРАММА. ЭЛЕКТИВНОГО КУРСА. ПО ХИМИИ. . ДЛЯ УЧАЩИХСЯ 9 – 11 КЛАССОВ. « РЕШЕНИЕ ЗАДАЧ ПО ХИМИИ». Составитель :. учитель ...ОСНОВНЫЕ ПОНЯТИИ ХИМИИ ВЫСОКО-МОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ
Конспект урока НА ТЕМУ: ОСНОВНЫЕ ПОНЯТИИ ХИМИИ ВЫСОКО-МОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ. Высокомолекулярные соединения (ВМС, или полимеры). получили свое ...ОПОРНЫЕ СИГНАЛЫ НА УРОКАХ ХИМИИ КАК СРЕДСТВО ПОВЫШЕНИЯ КАЧЕСТВА ОБУЧЕНИЯ
ОПОРНЫЕ СИГНАЛЫ НА УРОКАХ ХИМИИ КАК СРЕДСТВО ПОВЫШЕНИЯ КАЧЕСТВА ОБУЧЕНИЯ. Варова Татьяна Александровна. МБОУ СОШ с. Вознесенское. учитель ...ПУТЕШЕСТВИЕ в СТРАНУ ХИМИИ
ОТКРЫТЫЙ УРОК В 8-М КЛАССЕ ПО ТЕМЕ: "ПУТЕШЕСТВИЕ в СТРАНУ ХИМИИ" Цели: провести в занимательной форме общественный смотр знаний учащихся VIII класса, ...ОРГАНИЧЕСКАЯ ХИМИЯ. ПРЕДМЕТ ХИМИИ. ИСТОРИЯ РАЗВИТИЯ ОРГАНИЧЕСКОЙ ХИМИИ
Муниципальное Бюджетное Общеобразовательное Учреждение. Средняя Общеобразовательная Школа №14. им.Героя Советского Союза Белого С.Е. х.Бейсужек ...ЕГЭ на 100 баллов
Майорова Анастасия Леонидовна,. . учитель химии. МБНОУ лицей № 22 города Белово,. Кемеровская область. ЕГЭ на 100 баллов. Программа ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:6 марта 2019
Категория:Химия
Содержит:20 слайд(ов)
Поделись с друзьями:
Скачать презентацию



























![С2. Даны водные растворы: гексагидроксоалюмината калия K3[Al(OH)6], хлорида алюминия, сероводорода и гидроксида рубидия. Напишите уравнения четырёх возможных реакций между этими веществами. РЕШЕНИЕ: K3[Al(OH)6] + 3H2S = 3K2S + 2Al(OH)3 + 6H2O H2S + 2RbOH = Rb2S + 2H2O или Н2S + RbOH = RbHS + H2O AlC С2. Даны водные растворы: гексагидроксоалюмината калия K3[Al(OH)6], хлорида алюминия, сероводорода и гидроксида рубидия. Напишите уравнения четырёх возможных реакций между этими веществами. РЕШЕНИЕ: K3[Al(OH)6] + 3H2S = 3K2S + 2Al(OH)3 + 6H2O H2S + 2RbOH = Rb2S + 2H2O или Н2S + RbOH = RbHS + H2O AlC](https://prezentacii.org/upload/cloud/19/03/131337/images/thumbs/screen8.jpg)
![С2. Даны водные растворы: гексагидроксохромата натрия Na3[Cr(OH)6], хлорида железа (III), сернистого газа и перекиси водорода. Напишите уравнения четырёх возможных реакций между этими веществами. РЕШЕНИЕ: SO2 + H2O2 = H2SO4 2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2HCl 2Na3[Cr(OH)6] +3H2O2 = 2Na2CrO4 С2. Даны водные растворы: гексагидроксохромата натрия Na3[Cr(OH)6], хлорида железа (III), сернистого газа и перекиси водорода. Напишите уравнения четырёх возможных реакций между этими веществами. РЕШЕНИЕ: SO2 + H2O2 = H2SO4 2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2HCl 2Na3[Cr(OH)6] +3H2O2 = 2Na2CrO4](https://prezentacii.org/upload/cloud/19/03/131337/images/thumbs/screen9.jpg)
![C2. Даны водные растворы: гексагидроксоалюмината калия K3[Al(OH)6], хлорида хрома (III), карбоната калия и угольной кислоты. Напишите уравнения четырёх возможных реакций между этими веществами. РЕШЕНИЕ: K2CO3 + H2CO3 = 2KHCO3 2CrCl3 + 3K2CO3 + 3H2O = 2Cr(OH)3 + 3CO2 + 6KCl K3[Al(OH)6] + CrCl3 = Cr(O C2. Даны водные растворы: гексагидроксоалюмината калия K3[Al(OH)6], хлорида хрома (III), карбоната калия и угольной кислоты. Напишите уравнения четырёх возможных реакций между этими веществами. РЕШЕНИЕ: K2CO3 + H2CO3 = 2KHCO3 2CrCl3 + 3K2CO3 + 3H2O = 2Cr(OH)3 + 3CO2 + 6KCl K3[Al(OH)6] + CrCl3 = Cr(O](https://prezentacii.org/upload/cloud/19/03/131337/images/thumbs/screen10.jpg)