Презентация "Решение заданий С1 вариантов ЕГЭ" по химии – проект, доклад
Презентацию на тему "Решение заданий С1 вариантов ЕГЭ" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 8 слайд(ов).
Слайды презентации
Список похожих презентаций
Решение заданий ОГЭ по химии (1 - 15)
Задание 1. На данном рисунке изображена модель атома 1) хлора 2) азота 3)магния 4) фтора Ответ 4. Строение атома: ядро, электронная оболочка, электроны ...Типичные ошибки при выполнении заданий ЕГЭ по химии
Статистические данные ЕГЭ показывают, что каждый год у выпускников возникают определенные трудности, связанные со слабым знанием одних и тех же тем. ...Углеводороды в вопросах ЕГЭ
Силу ума придают упражнения, а не покой. Учащиеся должны. Знать классы углеводородов и их общие формулы Уметь составлять формулы углеводородов Уметь ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
Содержание химии очень обширно и часто предстает копилкой огромного числа формул, уравнений, фактов и законов, запомнить которые не просто трудно, ...Решение расчетных задач на сплавы, смеси и растворы различными методами.
Актуальность темы:. В курсе химии в результате сокращения часов, на решение задач отводится недостаточное количество времени, происходит неполноценное ...Анализ результатов ЕГЭ по химии 2010 (окружной семинар учителей химии)
Результаты ЕГЭ 2010. Граница минимального балла -33 тестовых балла (12 первичных баллов). Уровни оценивания: неудовлетворительный – 0–32 / 0–11; удовлетворительный ...Решение задач по уравнениям химических реакций
Основные физические величины. 8 класс. 1. Нахождение количества одного вещества по количеству другого вещества: ν1 → ν2. Дано: ν (O2) = 4 моль Найти: ...Решение задач с использованием массовой доли выхода продукта
В реальных химических реакциях масса продукта всегда оказывается меньше расчетной. ПОЧЕМУ? Многие химические реакции обратимы и не доходят до конца. ...Консультация экспертов ЕГЭ по химии 2012 год
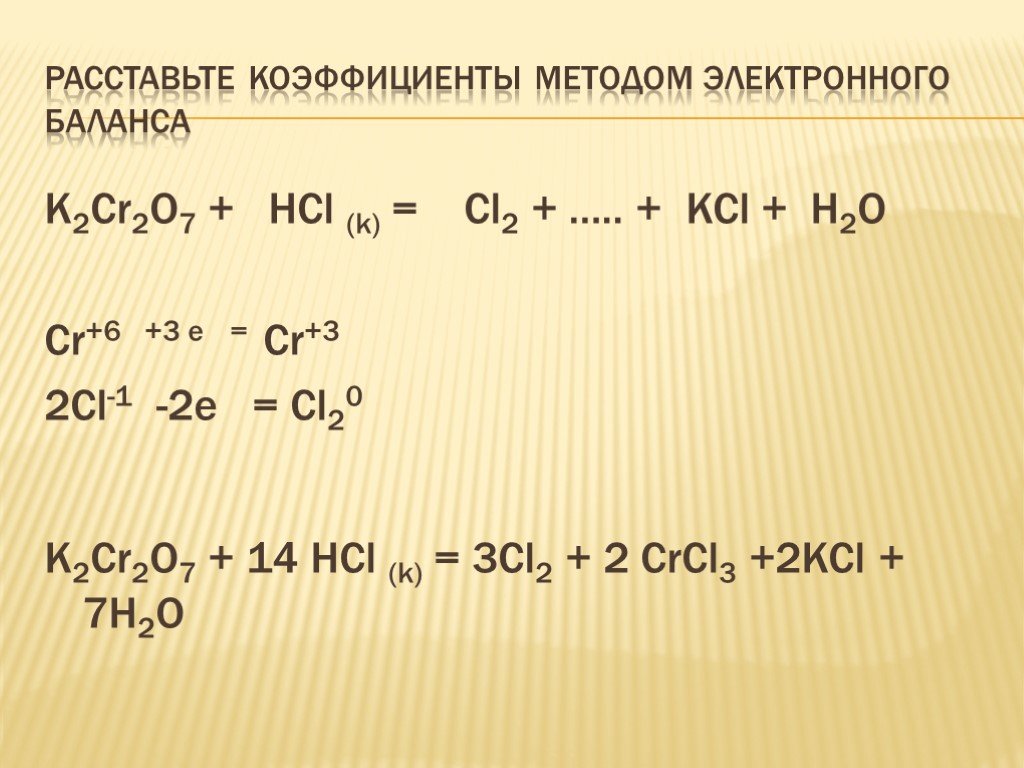
С1. Cr2(SO4)3 + Br2 + NaOH = = Na2CrO4 + NaBr + Na2SO4+ H2O. 2 Cr+3 – 3e- → Cr+6 ок-е 3 Br2 + 2e- → 2Br -1 в-е. 3 6 16 8. C2-2012. Демо-2012. Соль, ...Решение задач на смеси, сплавы, растворы
1%−это сотая часть рассматриваемой величины (52% от х кг − это 0,52х кг); Если в смеси растворов объемом V (массой m) нас интересует компонент объемом ...Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам курса неорганической химии
Х И М И Ч Е С К А Я В И К Т О Р И Н А «Знаешь ли ты это? 11 класс. ТЕМА: «Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам ...Использование интерактивных обучающих заданий на уроках химии
электронные издания. Видеофрагмент «Разложение дихромата аммония». Вопросы к демонстрации. Что вы наблюдаете? Какое вещество вступает в реакцию? Какие ...ЕГЭ ПО ХИМИИ
Структура части С КИМов по химии в 2006 году. С1. Окислительно-восстановительные реакции С2. Составление возможных уравнений реакций С3. Цепочки превращений ...ЕГЭ по химии
Количество участников и итоги 2011 г. В СПб Зарегистрировано - 3703 Явились - 2671 (72,1%) Неудовлетворительно – 156 чел. (5,84%) Средний балл – 54,43 ...Готовимся к ЕГЭ по химии
Перечень учебных пособий, разработанных с участием ФИПИ по химии. ГИА-2010. Экзамен в новой форме. Химия. 9 класс/ ФИПИ авторы составители: А.А. Каверина, ...Решение задач на смеси
5 г хлорида магния получено при обработке 6,5 г смеси оксида и бромида магния соляной кислотой. Определить состав смеси. ДАНО: m(MgO+MgBr2)= m(MgCl2)= ...Методические рекомендации по подготовке к ЕГЭ по химии
Кодификатор. Программа элективного курса «окислительно-восстановительные реакции». H2O2 H2SO4. «окислительно-восстановительные реакции в органической ...Решение задач на смеси, растворы и сплавы
Задача № 1. Задача № 2. Имеются сплавы золота и серебра. В одном эти металлы находятся в отношении 2: 3, а в другом в отношении 3: 7. Сколько нужно ...Подготовка к ЕГЭ "Строение атома"
Число электронов во внешнем электронном слое атома, ядро которого содержит 8 протонов, равно. 1) 8 2) 2 3) 6 4) 4. Число электронов в ионе железа ...Решение задач по теме: «Электролиз»
А. В процессе электролиза расплава хлорида алюминия проводимого в течение 245 мин. при силе тока 15 А, получили алюминий. Сколько граммов железа можно ...Конспекты
Решение экспериментальных задач по теме «Металлы и их соединения
Дата_____________ Класс_______________. Тема:. Практическая работа №6 «Решение экспериментальных задач по теме «Металлы и их соединения»». . ...Решение экспериментальных задач на распознавание катионов и анионов
Название работы:. Урок-практикум в 8-м классе на тему «Решение экспериментальных задач на распознавание катионов и анионов». Тема урока. Урок-практикум ...Решение экспериментальных задач по органической химии
Конспект открытого урока . Практическая работа №4 «Решение экспериментальных задач по органической химии». Класс:10. УМК: Рудзитис Г.Е., ФельдманФ.Г. ...Решение расчетных задач на вывод химической формулы органического вещества
Муниципальное бюджетное общеобразовательное учреждение. «Средняя общеобразовательная школа №55» г. Брянска. Урок по теме:. «Решение ...Решение расчетных задач с валеологическим содержанием
Тема урока:. «Решение расчетных задач с валеологическим содержанием» (2 урока). Цели урока:. продолжить знакомство учащихся со способами решения ...Решение задач с экологическим содержанием
УРОК. № 40. ТЕМА УРОКА:. . Решение задач с экологическим содержанием. ЦЕЛЬ УРОКА:. . . Научить учащихся решать задачи по химическим формулам ...Решение задач. Определение массовой доли растворенного вещества
Химия 9 класс. . . Тема. Решение задач. Определение массовой доли растворенного вещества. Цель. Научиться решать задачи с помощью алгоритмов; ...Решение задач по воде
Дата:. 14.03.14 г. Класс: 8 «А». Учитель:. Рощина Н.В. Роспись зам директора по УВР. __________________. Тема занятия № 4. Решение задач ...Решение задач по уравнениям химических реакций
Северо-Казахстанская область, Уалихановский район, Бидайыкская средняя школа. Учитель: Иманова Асель Нурмухамедовна. Предмет: химия. Класс: ...Решение задач на применение закона ЭДС индукции и определение энергии магнитного поля тока
Урок №39 9 класс. Тема: Решение задач на применение закона ЭДС индукции и определение энергии магнитного поля тока. Цель урока: проверить знания ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:25 января 2019
Категория:Химия
Содержит:8 слайд(ов)
Поделись с друзьями:
Скачать презентацию