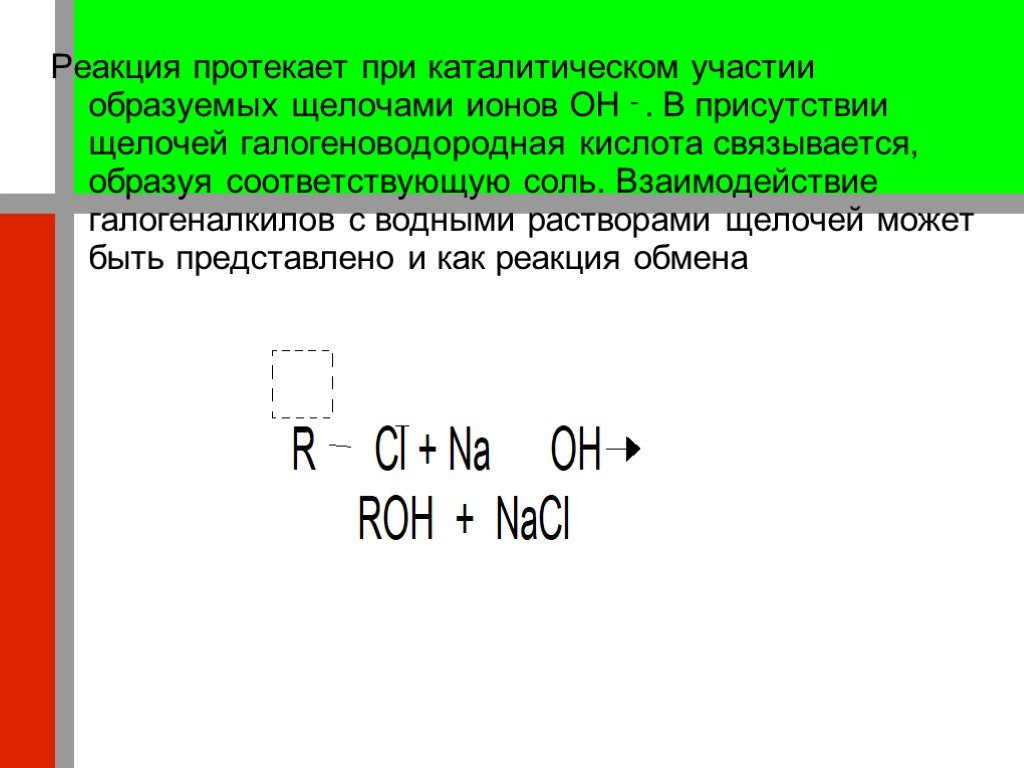
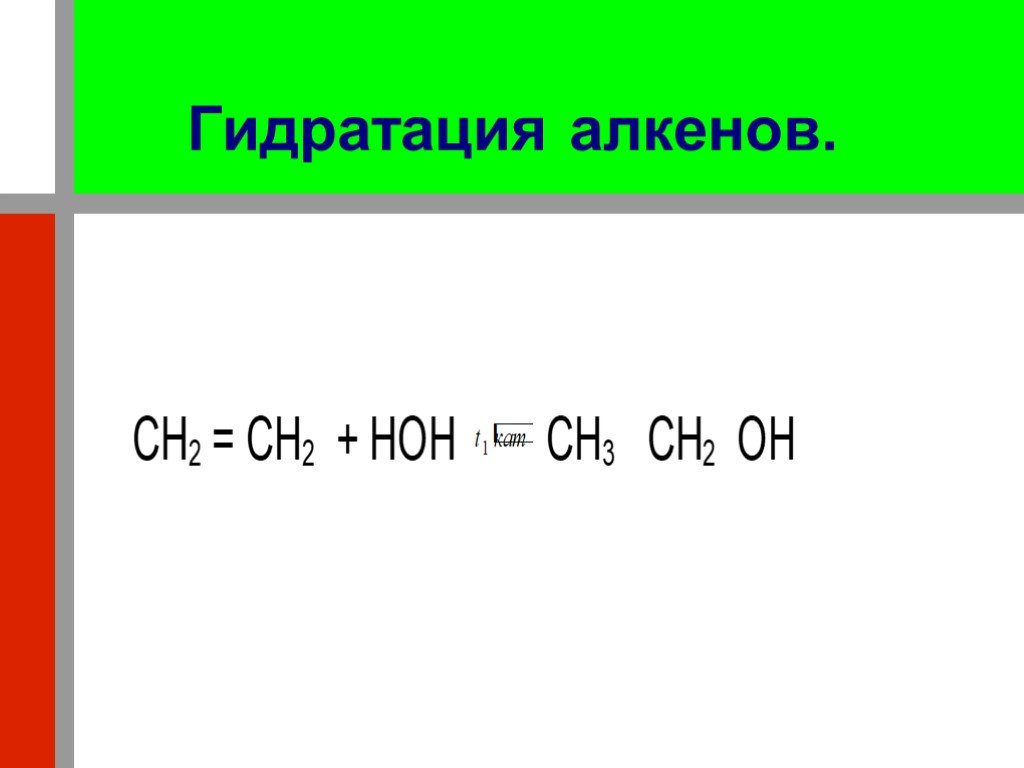
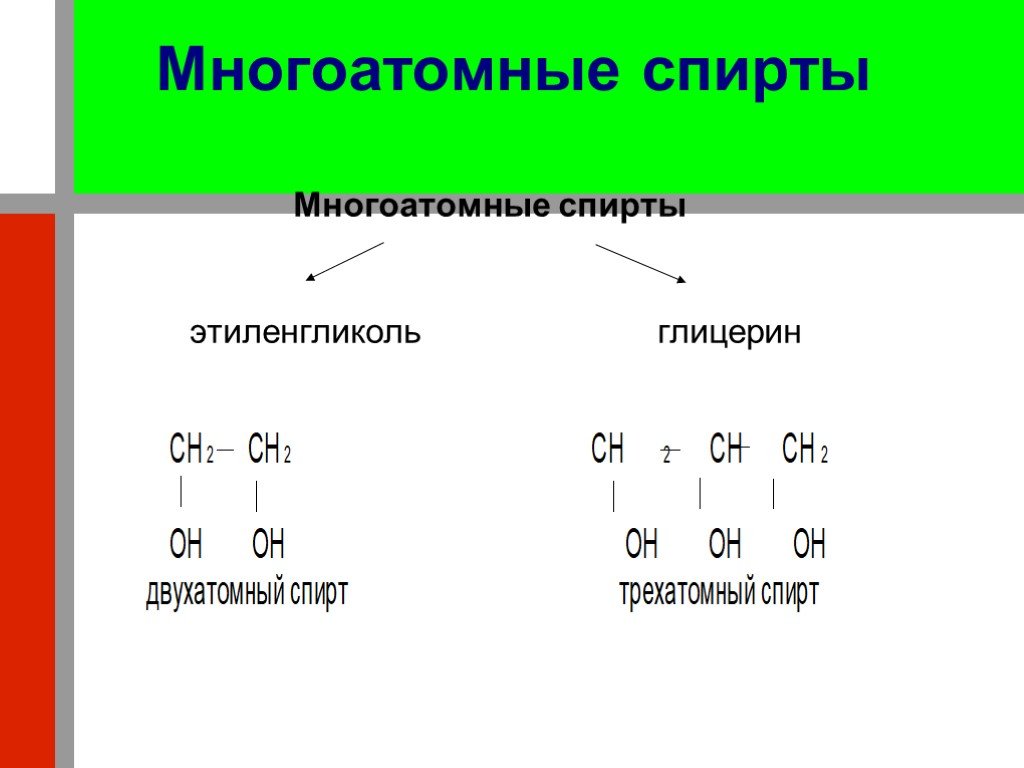
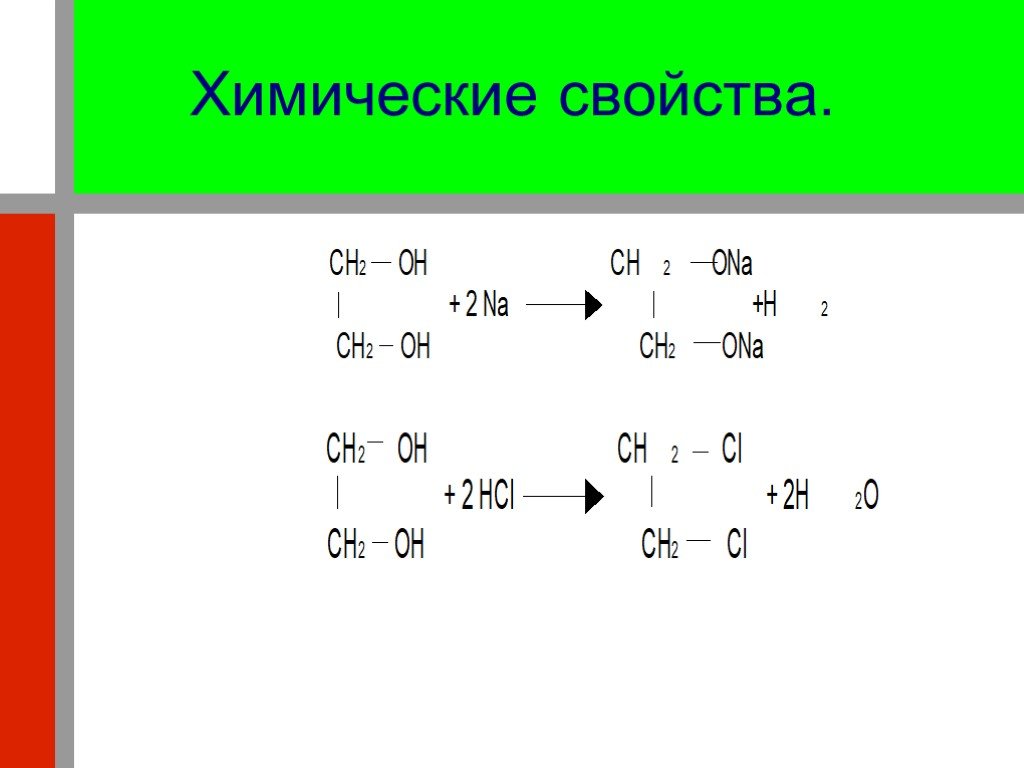
Презентация "Кислородсодержащие органические соединения" по химии – проект, доклад
Презентацию на тему "Кислородсодержащие органические соединения" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 30 слайд(ов).
Слайды презентации
Список похожих презентаций
Подготовка к ЕГЭ: Кислородсодержащие органические соединения. Карбоновые кислоты
Органические карбоновые кислоты характеризуются наличием карбоксильной группы –СООН. По числу групп различают: одно- СН3-СООН – уксусная или этановая ...Химический состав клетки. Неорганические соединения
Что же до первоначал, то они еще больше имеют Средств для того, чтоб из них возникали различные вещи, Нет ни одной из вещей, доступных для нашего ...Неорганические соединения
Цель: Повторить и обобщить знания, умения и навыки по данной теме. Фронтальный опрос. Что такое степень окисления? Какие соединения называются бинарными? ...Органические соединения железа
Почему наш век можно назвать железным веком? Элементы и атомы, В менделеевский взятые круг, Сделали химию самой богатой И самой творческой из наук. ...Керамики - неорганические соединения
Еще Глейтером в 1981 году был введен термин «нанокристаллические» материалы, позже стали использоваться такие термины как «наноструктурные», «нанофазные», ...Неорганические соединения - формулы и реакции
Цели урока. В игровой форме обобщить и закрепить знания о химических свойствах основных классов неорганических соединений и их взаимопревращениях. ...Металлоорганические соединения непереходных металлов
Лекция 2 Характерные типы и энергетика связей металл-углерод Основные синтетические подходы к металлоорганическим соединениям. Характерные типы связей ...Жиры – биологически важные органические соединения
Содержание. Нахождение жиров в природе. История изучения жиров. Строение и разнообразие жиров. Физические свойства жиров. Химические свойства жиров. ...Кремний и его соединения
Нахождение в природе. SiO2 кремнезём (песок). Al2O3∙ 2SiO2∙2H2O каолинит (глина). По распространенности занимает второе место после кислорода (26%). ...Химия. Азотсодержащие соединения
Амины – органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы: RNH2, R2NH, ...Комплексные соединения
Соединения,имеющие в своем составе комплексные ионы, относят к комплексным соединениям. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ. N H Cl + - [ * NH4Cl. КОМПЛЕКСООБРАЗОВАТЕЛЬ. ...Углерод, соединения углерода
Цель занятия: обобщение, систематизация и углубление знаний по теме «Углерод и его соединения». Вопросник:. Элементы, содержащиеся в живых организмах. ...Фосфор и его соединения
Цель: исследовать влияние фосфора на рост и развитие растений. Задачи исследования: 1. Изучить влияние фосфора на рост и развитие растений; 2. Рассмотреть ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Сера и ее соединения
Сера и ее соединения. Цель работы: Изучение физических и химических свойства серы и ее соединений. Выявление отрицательного воздействия на окружающую ...Галогены и их соединения
СОДЕРЖАНИЕ. 1. Общая характеристика галогенов 2. Фтор 3. Хлор 4. Бром 5. Йод 6. Соединения галогенов. Общая характеристика галогенов. Hal неметаллы ...Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
SiO2 , H2O , CO2 , AI2O3 , Fe2O3 , CO. Всесильная стихия природы-вода во все времена, во все периоды истории покоряла ум и воображение людей. Человек ...Галогены и их соединения
Опыт и наблюдение- таковы величайшие источники мудрости, доступ к которым открыт для каждого человека. (Чаннинг.). Вопросы:. Что такое «вытеснительный ...Галогены и их соединения
Цели урока:. Рассмотреть свойства и применение важнейших соединений галогенов. Изучить качественные реакции на галогенид-ионы. Рассмотреть свойства ...Все о железе и его соединения
Урок-проект в 9 классе подготовила Яскевич В.А. учитель химии МОУ «Кадетская школа «Патриот» г.Энгельса 2010 г. План изучения вещества. Железо как ...Конспекты
Кислородсодержащие органические соединения
Е.А.Кудравец, учитель химии. МОУ гимназии № 32. . Дидактическая разработка урока. . Тема:. «Кислородосодержащие органические соединения». ...Кислородсодержащие органические соединения. Предельные одноатомные спирты
Государственное общеобразовательное учреждение -. средняя общеобразовательная школа. при Посольстве России в Турции. Конспект урока по химии ...Кислородсодержащие органические соединения. Спирты
Тема:. Кислородсодержащие органические соединения. Спирты. Цель:. изучение нового класса органических веществ «Спирты», формирование знаний о ...Кислородсодержащие органические соединения. Спирты и фенолы
Шайтанова Екатерина Игоревна. Преподаватель химии и биологии. Николаевский-на-Амуре филиал. коренных малочисленных народов Севера. краевого государственного ...Кислородсодержащие органические соединения
Модульное изучение темы «. Кислородсодержащие органические соединения. ».10 класс. Цель:. создание условий для выявления учащимися взаимосвязи между ...Кислородсодержащие органические соединения и их природные источники
ПЛАН-КОНСПЕКТ УРОКА. «Химические свойства спиртов». . ФИО (полностью). . Хочуева Фатима Заурбековна. . . . Место работы. . ...Химический состав клеток. Неорганические соединения клетки
Урок на тему. «Химический состав клеток. Неорганические соединения клетки». Цели урока:. Расширение и углубление знаний учащихся о роли металлов ...Азотсодержащие органические соединения и их нахождение в живой природе
Рекомендации по изучению темы. «Азотсодержащие органические соединения и их нахождение в живой природе». . . 1. . Амины. . Понятие об ...Азотосодержащие органические соединения
4. . . Урок разработала Серебрянская Нелля Александровна,. учитель химии МОУ «Образцовская СОШ». Фроловского муниципального района. Волгоградской ...Кислородосодержащие органические соединения
Конспект урока химии 10 класс по теме. . Кислородосодержащие органические соединения. Файрушина Зифа Рустямовна. Учитель химии МБОУ СОШ с. Калтыманово, ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:10 сентября 2018
Категория:Химия
Содержит:30 слайд(ов)
Поделись с друзьями:
Скачать презентацию