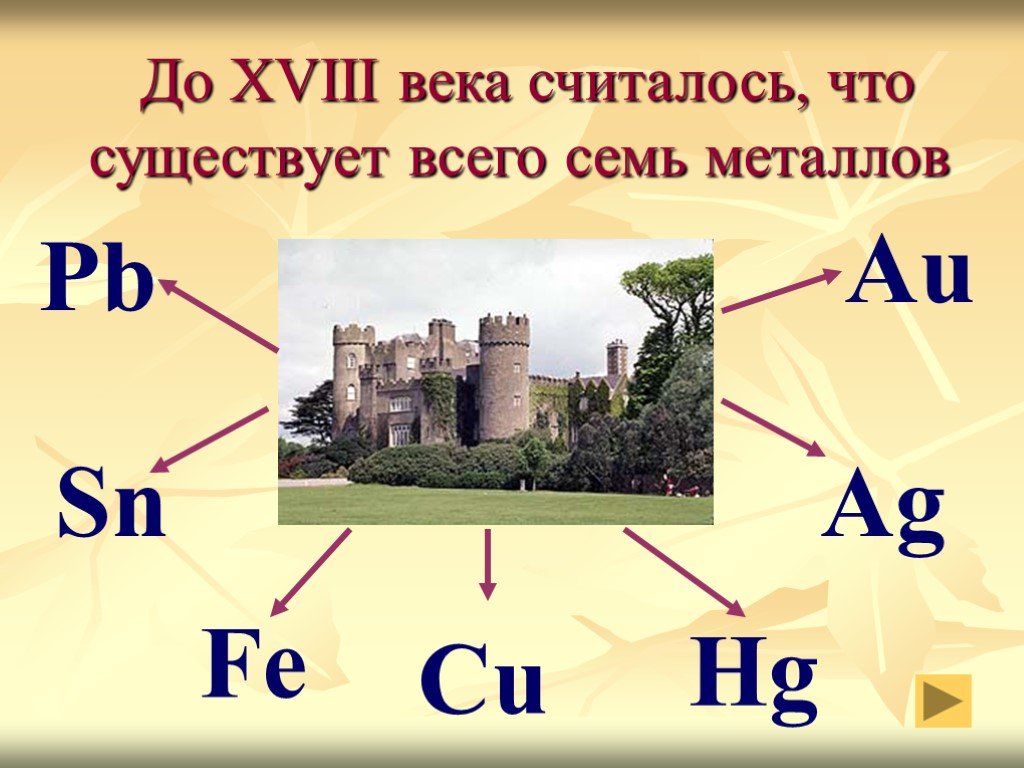
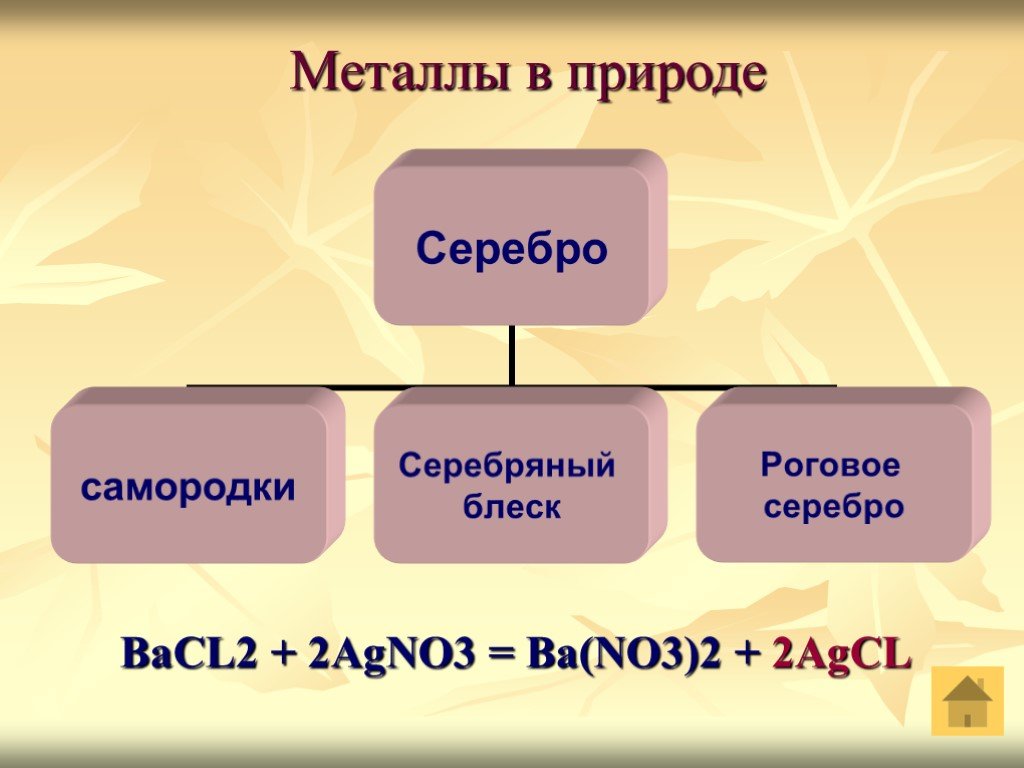
Презентация "Благородные металлы на службе у человека" () по химии – проект, доклад
Презентацию на тему "Благородные металлы на службе у человека" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 32 слайд(ов).
Слайды презентации
Список похожих презентаций
Влияние эфирного масла и конкрета из шалфея мускатного на организм человека
Введение. Эфирные масла - это пахучие вещества, которые вырабатываются эфиромасличными растениями и обусловливают их запах и практическую ценность. ...Изучение возможности интоксикации ионами алюминия организма человека через питьевую воду
Причины избытка алюминия в организме. острые отравления солями алюминия на производстве; избыточное поступление в условиях повышенного содержания ...Значение химии в жизни современного человека
Цель и задачи работы. Цель: Раскрыть степень влияния химии на повседневную жизнь современного человека. Задачи: Раскрыть тему; Изложить проблему; ...Значение химии в жизни человека
Значение химии. Агропромышленность Машино – и ракетостроение Текстиль Архитектура Фармацевтика Предметы быта Пищевая промышленность Металлургия. Химия ...Влияние тяжёлых металлов на человека
Методика исследования. При взаимодействии ионов тяжелых металлов с иодидом калия образуются осадки разной окраски: Pb + 2 + 2 I - = PbI 2 ↓ (желтый) ...Значение химии в жизни человека
Значение химии в жизни человека трудно переоценить. Приведём фундаментальные области, в которых химия оказывает своё созидательное воздействие на ...Влияние пищевых добавок на здоровье человека
Есть большая разница между тем, что любит есть человек и что любит организм. Что мы едим? У молодёжи широко распространены привычки неправильного ...Вредное воздействие нитратов на организм человека
Содержание. Введение Цель проекта Задачи проекта Основные источники Качество овощей и условия их выращивания Вредное воздействие нитратов на организм ...Значение соли для человека
Цель проекта:. Определить значение соли для организма человека. При опросе «Часто ли вы употребляете соль?»: 72% опрашуемых ответили «Часто» 16% опрашуемых ...Безопасность на уроке химии
Пробовать вещества на вкус, есть и пить в химическом кабинете. Осторожно направляйте к себе газ рукой. ЗАПРЕЩАЕТСЯ. . . . . ЗАПРЕЩАЮЩИЕ ЗНАКИ. Запрещается ...Галогены и здоровье человека
Цель презентации. используя знания из области биологии, физиологии, медицины, исторические факты, показать важную роль галогенов для нормальной жизнедеятельности ...Гипертекст как средство развития познавательной активности учащихся на уроках химии
Анонимное тестирование учащихся 8-11 классов. Выполняете ли вы домашнее задание? Читаете ли вы параграф, заданный на дом? Вы пользуетесь компьютером ...Благородные газы
№1 №3. №4 №5 №6. №7 №8. Ответы. . №2. . . . . . . Источник информации. Источники иллюстраций. Л.Е. Сомин. Увлекательная химия. Пособие для учителей. ...Всё на свете химия!
А что же такое химия? Наука о веществах и превращениях друг в друга. Химия в быту. Химия в быту, сравнительно молодая наука, является нашим незаменимым ...Влияние культуры знаний на отношение к курению
Табак приносит вред телу, разрушает разум, отупляет целые нации. Оноре де Бальзак. Никотин – яд, который вредно влияет на сосуды человеческого организма, ...ИКТ на уроках химии
Автор - преподаватель химии Ярвеской русской гимназии Сурнина Марина Владимировна. Стаж работы в школе 7 лет Имеется международный сертификат пользователя ...Влияние железа на организм
Железо не только основа всего мира, самый главный металл окружающей нас природы, оно – основа культуры и промышленности, оно – орудие войны и мирного ...Влияние культуры знаний на отношение к курению
Объект исследования:. Учащиеся 10-11 классов МОУСОШ № 5(112 учеников). Предмет исследования:. Условия и факторы, определяющие отношение учащихся к ...Влияние внешних условий на рост кристаллов различных солей
Объект исследования:. насыщенные растворы медного купороса CuSO4∙5Н2О; алюмокалиевых квасцов KCl(SO4)2*12H2O. Задачи исследования:. приготовление ...Влияет - ли рН воды на рост бобовых
Актуальность выбора темы: Для роста растений необходимы определенные условия. Им нужен грунт, свет, вода и воздух. С помощью нашей работы мы хотели ...Конспекты
Важнейшие классы бинарных соединений – оксиды их роль в природе и жизни человека
Государственное казённое образовательное учреждение Ростовской области. общеобразовательная школа-интернат основного общего образования. п. Шолоховского ...Важнейшие классы бинарных соединений – оксиды, их роль в природе и жизни человека
Урок химии в 8 классе по теме:. «Важнейшие классы бинарных соединений – оксиды, их роль в природе и жизни человека». Цели урока:. Предметные. ...Биохимическое исследование влияния этанола на организм человека: причины и последствия
МОУ «Средняя общеобразовательная школа №3». г.о. Саранск. Биохимическое исследование влияния этанола на организм человека: причины и последствия. ...Значение металлов в жизни человека
Тема:. Значение металлов в жизни человека. Цель урока:. Формирование знаний о значении металлов в жизни человека. Задачи:. обучающие:. знать ...Металлы – простые вещества с использованием ИКТ на уроке
Конспект урока химии (по программе О.С. Габриеляна) в 8 классе на тему «Металлы – простые вещества с использованием ИКТ на уроке». Автор: Карачева ...Значение воды в жизни человека
Методическая разработка. открытого урока по химии. на тему: «Значение воды в жизни человека». в 9 классе. Учитель: Попович Лидия ...Металлы в организме человека
. Муниципальное общеобразовательное учреждение. средняя общеобразовательная школа № 1 г. Советский. Металлы в организме человека. Интегрированное ...Металлы в окружающей среде и здоровье человека
Тема урока:. «Металлы в окружающей среде и здоровье человека». (урок-конференция). 9 класс. Цели урока:. 1. Сформировать у учащихся представления ...Действие этилового спирта на организм человека
План-конспект. открытого урока - презентации. в 10 классе по теме:. «Действие этилового спирта. на организм человека. .». Районной семинар - ...Общая характеристика металлов и их значение для человека
Технология развития критического мышления. Интегрированный урок химии - биологии. на тему: «Общая характеристика металлов и их значение для человека». ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:5 апреля 2018
Категория:Химия
Содержит:32 слайд(ов)
Поделись с друзьями:
Скачать презентацию