Презентация "Значение Периодического закона Д.И.Менделеева" по химии – проект, доклад
Презентацию на тему "Значение Периодического закона Д.И.Менделеева" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 12 слайд(ов).
Слайды презентации
Список похожих презентаций
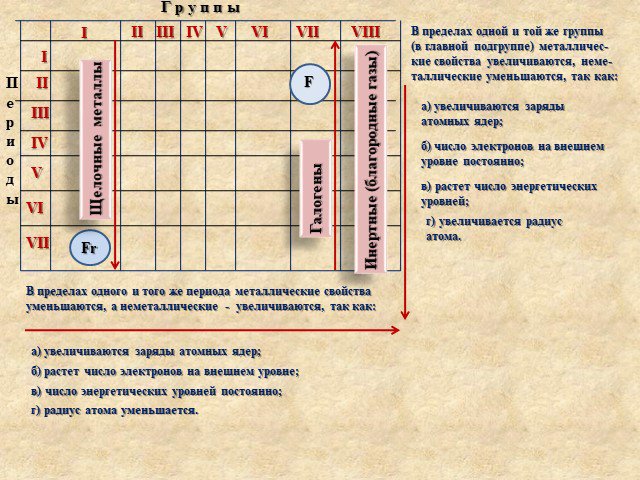
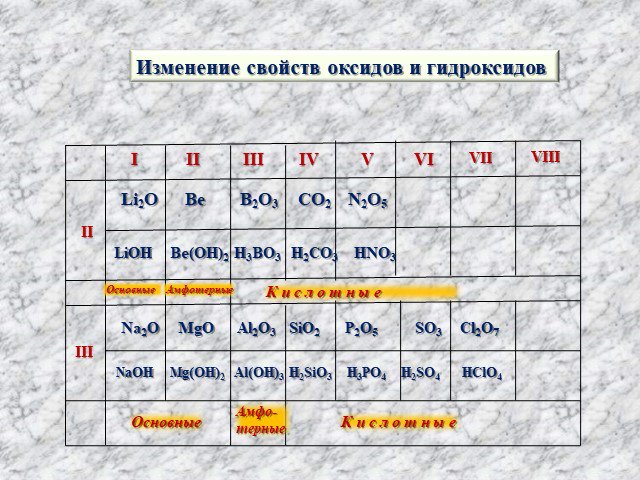
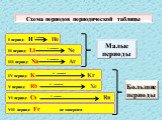
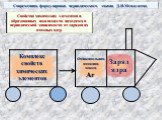
Значение периодического закона
Цель урока: Усвоить один из общих законов природы – фундамент современной химии; Охарактеризовать научное и практическое значение закона; Изучить ...Значение периодического закона Д.И Менделеева
Исправление атомных масс химических элементов. Д. И. Менделеев изменил атомные массы и валентность у десяти элементов и «подправил» их еще у десяти ...История открытия и экспериментального подтверждения периодического закона
Введение. Данная работа направлена на изучение и углубление знаний о величайшем открытии XIX в. – Периодическом законе химических элементов Д. И. ...Создание периодического закона
Цели урока:. Методическая цель: «Развитие познавательной деятельности и познавательной активности на уроке химии, путем применения наглядных средств ...История открытия периодического закона и его экспериментальное подтверждение
Цель нашей работы:. попытаться предсказать будущее. периодической системы на основе. имеющихся фактов. Объект исследования:. периодический закон и ...Значение фосфора
Фосфор – относительно редкий элемент. По данным академика А.Е.Ферсмана, его процентное содержание элемента в земле равен всего 0,12%. В таблице распространенности ...Значение цинка
Значение цинка для растений:. Является компонентом фермента карбоангидразы, тем самым отвечает за реакцию «темновой» фазы фотосинтеза и на процесс ...Значение химии в жизни человека
Значение химии. Агропромышленность Машино – и ракетостроение Текстиль Архитектура Фармацевтика Предметы быта Пищевая промышленность Металлургия. Химия ...Друзья и соратники Д.И.Менделеева в сфере науки и культуры
Введение. До некоторого момента я знала Д.И. Менделеева как великого химика – создателя Периодического Закона и Периодической системы. Но когда поближе ...Строение атома. Периодический закон Д.И.Менделеева в свете теории строения атома
Родители атома. Демокрит (460 до н. э. — 370 до н. э.). Джозеф Джон Томсон (1856–1940 г). Эрнест Резерфорд (1871–1937г). Джеймс Чедвик (1891–1974г). ...Работы Д.И.Менделеева в области агрохимии
Сила народная будет определяться умелым сочетанием индустрии с сельским хозяйством. Д.И.Менделеев. Многочисленные работы Д.И.Менделеева, посвященные ...Периодический закон Д.И.Менделеева
Открытию периодического закона предшествовало накопление знаний о веществах и свойствах. По мере открытия новых химических элементов, изучения состава ...Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева. Дмитрий Иванович Менделеев (1834-1907) – русский ученый-энциклопедист, талантливый химик, открывший периодический ...Значение теории химического строенияА.М.Бутлерова
1.Доказала, что с помощью химических методов ( синтеза, разложения и других реакций) можно установить порядок соединения атомов в молекулах ( этим ...Значение соли для человека
Цель проекта:. Определить значение соли для организма человека. При опросе «Часто ли вы употребляете соль?»: 72% опрашуемых ответили «Часто» 16% опрашуемых ...Жизнь Д.И.Менделеева
Иван Павлович Менделеев, отец учёного. Мария Дмитриевна Менделеева, мать учёного. Вид Тобольска. Тобольская гимназия, в которой учился Д.И.Менделеев. ...Жизнь и деятельность Д.И.Менделеева
Тобольск – родина Д.И.Менделеева. Дмитрий Васильевич Корнильев, дед Д.И.Менделеева. Ольга Ивановна Басаргина (урожденная Менделеева. Николай Васильевич ...Значение органической химии
Значение органической химии чрезвычайно велико. Оно обусловлено той исключительной ролью , какую играют в жизни человека органические вещества. Белки, ...Неорганические соединения. Периодическая таблица Д.И.Менделеева
Урок-конкурс по теме: «Неорганические соединения. Периодическая таблица Д.И.Менделеева». Цель: Закрепить полученные знания по основным классам неорганической ...Значение химии
У 1897 Джозеф Джон Томсон (1856 - 1940) відкрив електрон, заряд якого з високою точністю виміряв в 1909 Роберт Міллікен (1868 - 1953). У 1911 Ернст ...Конспекты
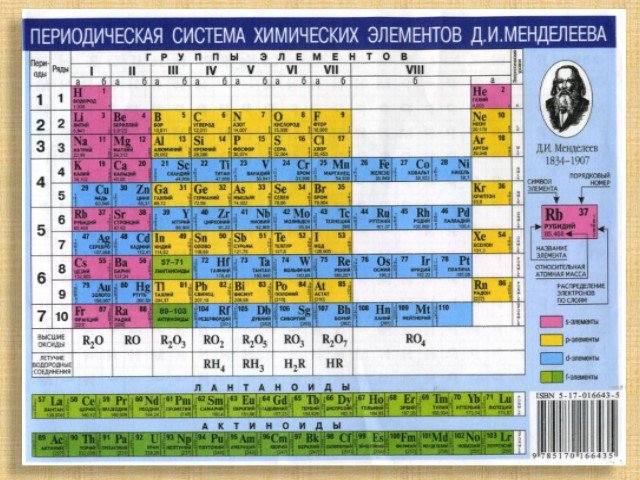
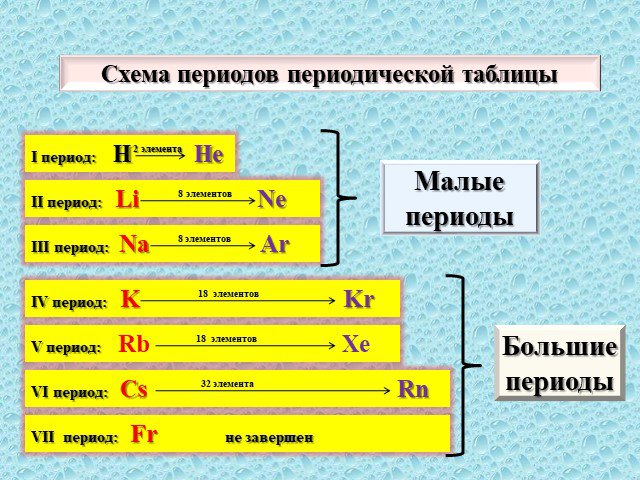
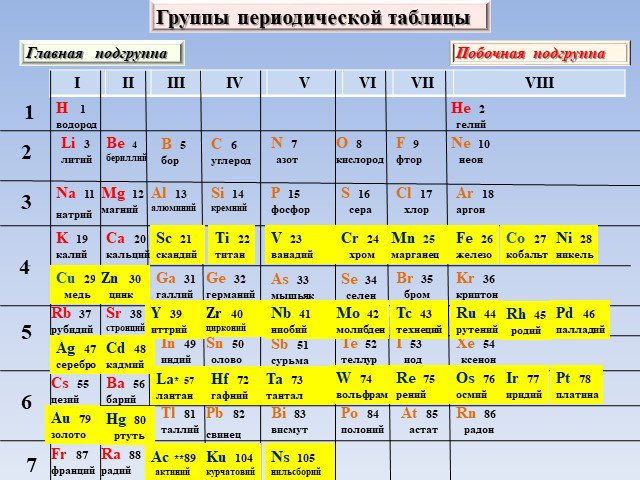
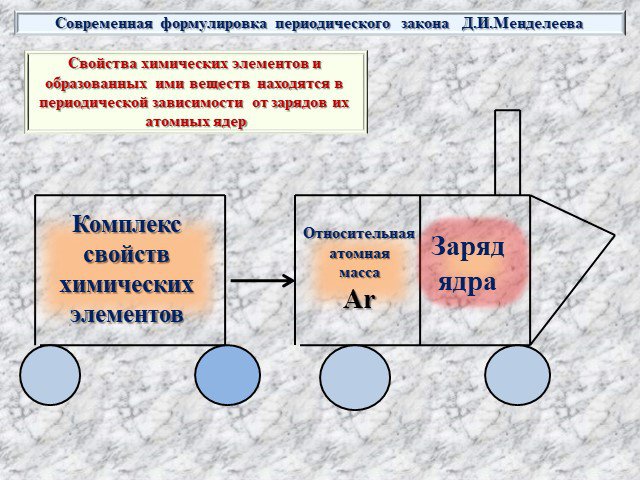
Современная формулировка периодического закона и современное состояние периодической системы химических элементов Д. И. Менделеева
Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Тема. . Современная формулировка периодического закона и современное ...Решение задач на применение закона ЭДС индукции и определение энергии магнитного поля тока
Урок №39 9 класс. Тема: Решение задач на применение закона ЭДС индукции и определение энергии магнитного поля тока. Цель урока: проверить знания ...Периодический закон и периодическая система химических элементов Д.И.Менделеева
Разработка урока химии. в 8 классе. по теме. . «Периодический закон и. . периодическая система химических элементов. . Д.И.Менделеева». ...Периодический закон и периодическая система химических элементов Д.И.Менделеева
Кокалажарская средняя школа. Урок обобщения и систематизации знаний по теме. «Периодический закон и периодическая система химических ...Периодическая система химических элементов Д.И.Менделеева и строение атома
Тема:. Повторение и обобщение знаний по теме: «Периодическая система химических элементов Д.И.Менделеева и строение атома». Цель:. . повторить ...Периодический закон и периодическая система Д.И.Менделеева
Урок химии. в 9 классе по теме:. «Периодический закон и периодическая система Д.И.Менделеева». Выполнила: учитель ...Металлы главных подгрупп периодической системы элементов Д.И.Менделеева
Модуль 1. Тема: «Металлы главных подгрупп периодической системы элементов Д.И.Менделеева». номер. учебного. элемента. (УЭ). Учебный материал ...Значение окислительно-восстановительных реакций
Дата: 28.11.2014. Урок №. Тема: Значение окислительно-восстановительных реакций. Цели: расширить и закрепить знания о степени окисления, окислителях ...Значение металлов в жизни человека
Тема:. Значение металлов в жизни человека. Цель урока:. Формирование знаний о значении металлов в жизни человека. Задачи:. обучающие:. знать ...Значение воды в жизни человека
Методическая разработка. открытого урока по химии. на тему: «Значение воды в жизни человека». в 9 классе. Учитель: Попович Лидия ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Учитель химии Ефремова С.А.
Содержит:12 слайд(ов)
Поделись с друзьями:
Скачать презентацию