Презентация "Соли" по химии – проект, доклад
Презентацию на тему "Соли" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 17 слайд(ов).
Слайды презентации
Список похожих презентаций
Соли как производные кислот и оснований
Вопросы. 4. Что такое кислоты? 1. Какие классы веществ вы знаете? 2. Что такое оксиды? 3. Что такое основания? 5. Что такое основные оксиды, (кислотные ...Соли аммония
Проблемный вопрос:. Почему соли аммония нашли такое широкое применение в народном хозяйстве? Задачи:. изучить состав, получение и методы распознавания ...Соли в медицине
Роль минеральных веществ в питании. Входящие в состав человеческого организма минеральные вещества представляют собой не только строительный материал. ...Соли аммония
КАТИОН АМОНИЯ. Катион аммония NH4 играет роль катиона метала и образует с кислотными остатками соли: NH4NO3 – нитрат аммония, или аммиачная селитра. ...Соли аммония
«Просто знать – еще не все, знания нужно уметь использовать» И.В.Гете. Ион аммония образован только неметаллами. Так же, как и ионы металлов, он образует ...Основные классы неорганических соединений Соли
Классификация неорганических веществ 1.Определение 2.Классификация СОЛЕЙ; 3.НОМЕНКЛАТУРА. 4.Получение СОЛЕЙ; 5.Химические свойства СОЛЕЙ. Содержание:. ...Соли азотной кислоты
Номенклатура солей. Нитраты : Ba(NO₃)₂ , AgNO₃ , Zn(NO₃)₂ , NaNO₃ Селитры : NaNO₃ , KNO₃ , Ca(NO₃)₂ , NH₄NO₃. Строение и физические свойства нитратов. ...Соли
Понятие:. Соли -сложные вещества, состоящие из атома металла и кислотного остатка. Классификация:. О соли. (Мёртвое море). Соль для ванн. Розовую ...Соли 1
Г и п о т е з а. СОЛИ - СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ ?!... ОБЪЕКТ: растворы солей ПРЕДМЕТ: химические свойства солей в свете ТЭД ЦЕЛЬ: экспериментальным путем ...Соли
Составим соли азотной кислоты:. формула азотной кислоты HNO3 кислотный остаток NO3- - нитрат Составим формулы солей: NaNO3 - По таблице растворимости ...Соли
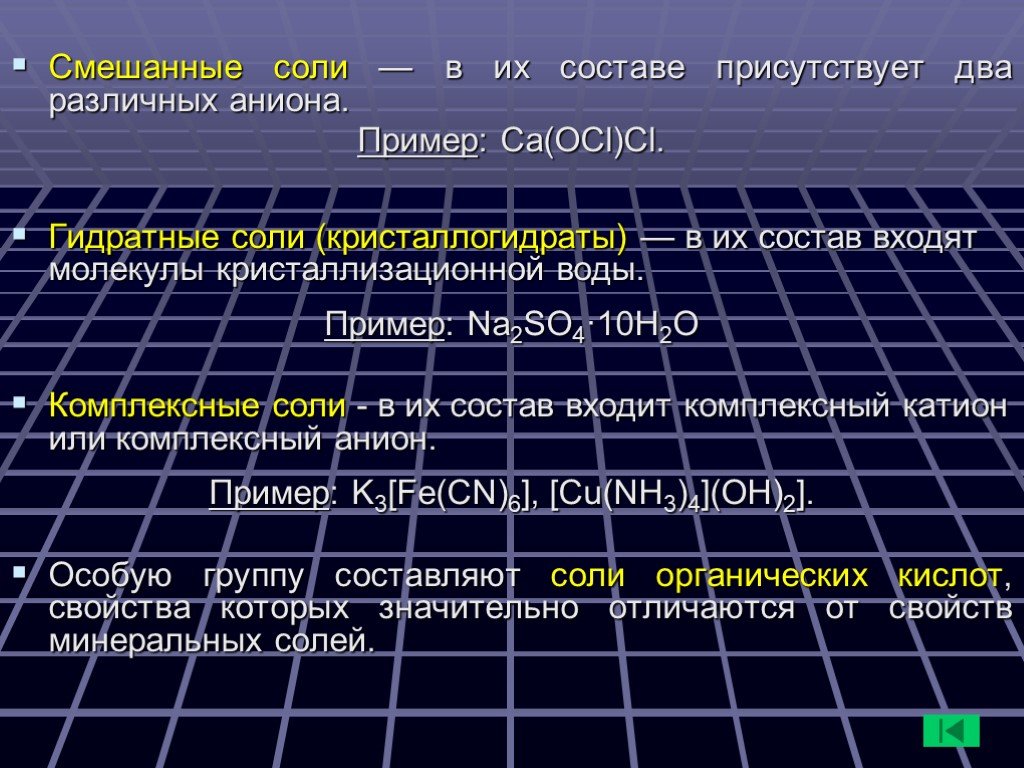
Классификация солей. Средние соли – продукты полного замещения атомов водорода в кислоте химическим элементом металлом (состоят из катионов металла ...Соли
СОЛИ. Урок химиии в 8 классе по теме :. Нам друг для друга нужно так немного: щепотку нежности да горсточку тепла. Цель урока:. Повторить основные ...Соли
Понятие:. Соли -сложные вещества, состоящие из атома металла и кислотного остатка (иногда содержат водород). Соли могут рассматриваться как продукты ...Соли
Проверка домашнего задания. Оксиды –. это ……… вещества, состоящие из ………. элементов, один из которых ……….. со степенью окисления ……… . это сложные ...Соли угольной кислоты
Соли угольной кислоты-карбонаты и гидрокарбонаты. Na2CO3 –карбонат натрия NaHCO3 -гидрокарбонат натрия CaCO3 -карбонат кальция Ca(HCO3)2 –гидрокарбонат ...Соли 2
соли - твердые вещества. различной окраски. Соли – это сложные вещества, состоящие из атомов металла и кислотных остатков. Соли – это сложные вещества, ...Соли, их классификация и свойства
Цели урока:. 1)Познакомить учащихся с понятием соли, изучить основные классификации солей; 2)Изучить основные химические свойства солей; 3)Продолжить ...Классификация сложных неорганических веществ. Соли
Сложные вещества неорганические органические оксиды кислоты основания соли. ЦЕЛИ УРОКА:. дать определение солям, рассмотреть состав солей, классифицировать ...Угольная кислота и её соли
Выберите из предложенных утверждений только те, которые справедливы для: 1вариант – алмаза, 2 вариант - графита. Прозрачный, бесцветный Очень твердый ...Изучение реакции среды в зависимости от типа гидролиза соли
Лабораторная работа Изучение реакции среды в зависимости от типа гидролиза соли. Цели: понять сущность гидролиза. научиться определять реакцию и тип ...Конспекты
Соли аммония
Муниципальное бюджетное общеобразовательное учреждение. «Базковская средняя общеобразовательная школа». Конспект урока по химии. ...Соли аммония
Тема урока:. Соли аммония. Элементы содержания. : соли аммония. Уметь:. составлять уравнения реакций с участием солей аммония, распознавать опытным ...Соли, их классификация и химические свойства в свете теории электролитической диссоциации
Муниципальное общеобразовательное учреждение. . средняя общеобразовательная школа №2. г. Алексеевки Белгородской области. Конспект ...Соли
Химия 8 класс. Урок 28. Тема урока: Соли. Цели:. сформировать представление о классе сложных веществ - солях и их составе; познакомить с классификацией ...Соли в свете теории электролитической диссоциации, их свойства
Предмет – химия. Класс – 8. Тема урока: «Соли в свете теории электролитической диссоциации, их свойства». Тип урока: урок изучения нового ...Соли угольной кислоты
Соли угольной кислоты. МБОУ СОШ №44 г. Владимир. Учитель химии Уварова Марина Леонидовна. Урок химии в 9 классе. Задачи урока:. образовательные:. ...Соли
Соли. . Соли – сложные вещества, состоящие из атомов металла и кислотного остатка, продукт полного. . Это определение характерно для средних ...Соли аммония. Оксиды азота (II) и (IV)
Урок 20. Соли аммония. Оксиды азота (II) и (IV). Цели урока:. 1. Охарактеризовать соли аммония и оксиды азота (II) и (IV) по следующей схеме: ...Соли
Технологическая карта урока «Соли» (химия 8 класс). 1. Ф.И.О. учителя: Хорошева Галина Марьяновна. 2. Класс: _______8_________. Дата: ______________. ...Соли
Урок с ИКТ по теме «Соли». Химия 8 класс. Учебник: Габриелян О.С. Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа. М. 2012г. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 декабря 2018
Категория:Химия
Содержит:17 слайд(ов)
Поделись с друзьями:
Скачать презентацию





















![Смешанные соли — в их составе присутствует два различных аниона. Пример: Ca(OCl)Cl. Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример: Na2SO4·10H2O Комплексные соли - в их состав входит комплексный катион или комплексный анион. Пример: K3[Fe(CN)6], [Cu(N Смешанные соли — в их составе присутствует два различных аниона. Пример: Ca(OCl)Cl. Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример: Na2SO4·10H2O Комплексные соли - в их состав входит комплексный катион или комплексный анион. Пример: K3[Fe(CN)6], [Cu(N](https://prezentacii.org/upload/cloud/18/12/110996/images/thumbs/screen5.jpg)