Презентация "Соли" по химии – проект, доклад
Презентацию на тему "Соли" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 20 слайд(ов).
Слайды презентации
Список похожих презентаций
Соли как производные кислот и оснований
Вопросы. 4. Что такое кислоты? 1. Какие классы веществ вы знаете? 2. Что такое оксиды? 3. Что такое основания? 5. Что такое основные оксиды, (кислотные ...Соли аммония
Проблемный вопрос:. Почему соли аммония нашли такое широкое применение в народном хозяйстве? Задачи:. изучить состав, получение и методы распознавания ...Соли в медицине
Роль минеральных веществ в питании. Входящие в состав человеческого организма минеральные вещества представляют собой не только строительный материал. ...Соли аммония
КАТИОН АМОНИЯ. Катион аммония NH4 играет роль катиона метала и образует с кислотными остатками соли: NH4NO3 – нитрат аммония, или аммиачная селитра. ...Соли аммония
«Просто знать – еще не все, знания нужно уметь использовать» И.В.Гете. Ион аммония образован только неметаллами. Так же, как и ионы металлов, он образует ...Основные классы неорганических соединений Соли
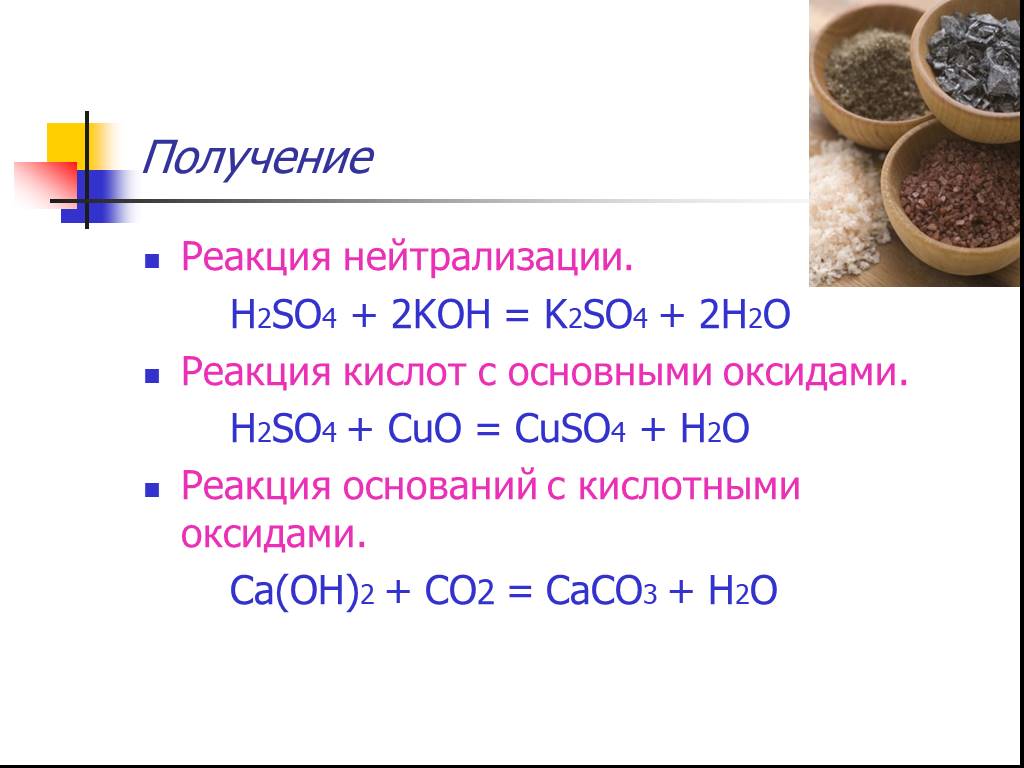
Классификация неорганических веществ 1.Определение 2.Классификация СОЛЕЙ; 3.НОМЕНКЛАТУРА. 4.Получение СОЛЕЙ; 5.Химические свойства СОЛЕЙ. Содержание:. ...Соли азотной кислоты
Номенклатура солей. Нитраты : Ba(NO₃)₂ , AgNO₃ , Zn(NO₃)₂ , NaNO₃ Селитры : NaNO₃ , KNO₃ , Ca(NO₃)₂ , NH₄NO₃. Строение и физические свойства нитратов. ...Соли
Понятие:. Соли -сложные вещества, состоящие из атома металла и кислотного остатка. Классификация:. О соли. (Мёртвое море). Соль для ванн. Розовую ...Соли 1
Г и п о т е з а. СОЛИ - СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ ?!... ОБЪЕКТ: растворы солей ПРЕДМЕТ: химические свойства солей в свете ТЭД ЦЕЛЬ: экспериментальным путем ...Соли
Оглавление. Определение Типы солей Номенклатура Добыча Применение Соль и здоровье Использование Вопросы для самопроверки Домашнее задание Источники ...Соли
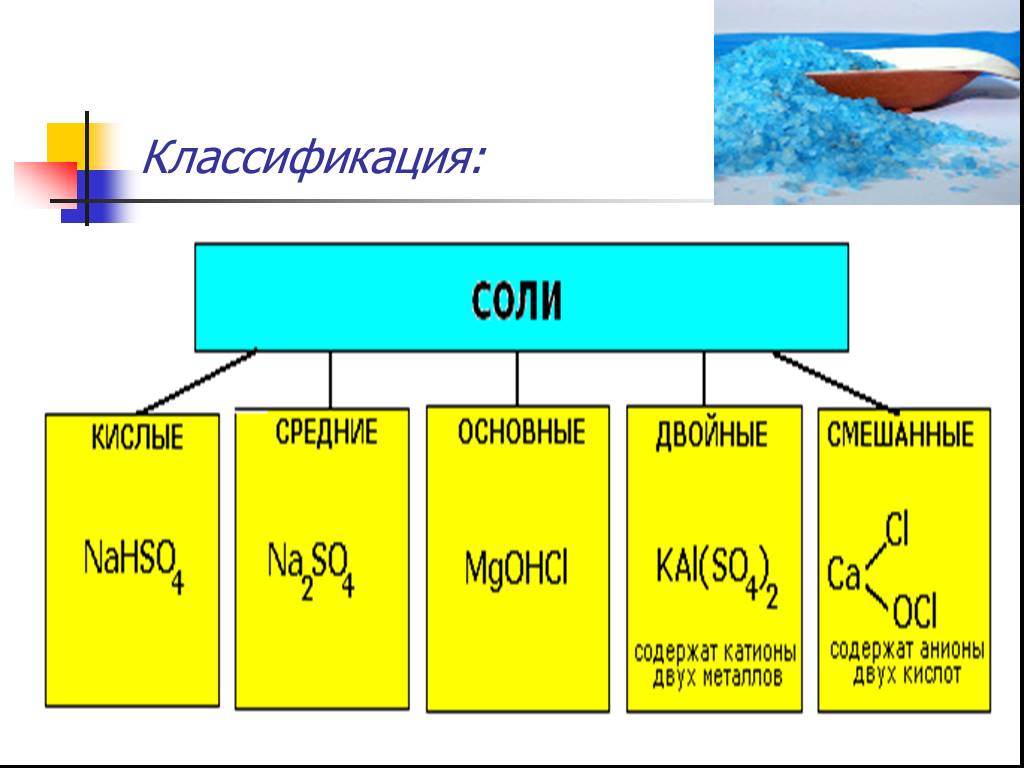
Классификация солей. Средние соли – продукты полного замещения атомов водорода в кислоте химическим элементом металлом (состоят из катионов металла ...Соли
Составим соли азотной кислоты:. формула азотной кислоты HNO3 кислотный остаток NO3- - нитрат Составим формулы солей: NaNO3 - По таблице растворимости ...Соли
СОЛИ. Урок химиии в 8 классе по теме :. Нам друг для друга нужно так немного: щепотку нежности да горсточку тепла. Цель урока:. Повторить основные ...Соли
Проверка домашнего задания. Оксиды –. это ……… вещества, состоящие из ………. элементов, один из которых ……….. со степенью окисления ……… . это сложные ...Соли угольной кислоты
Соли угольной кислоты-карбонаты и гидрокарбонаты. Na2CO3 –карбонат натрия NaHCO3 -гидрокарбонат натрия CaCO3 -карбонат кальция Ca(HCO3)2 –гидрокарбонат ...Соли 2
соли - твердые вещества. различной окраски. Соли – это сложные вещества, состоящие из атомов металла и кислотных остатков. Соли – это сложные вещества, ...Соли, их классификация и свойства
Цели урока:. 1)Познакомить учащихся с понятием соли, изучить основные классификации солей; 2)Изучить основные химические свойства солей; 3)Продолжить ...Классификация сложных неорганических веществ. Соли
Сложные вещества неорганические органические оксиды кислоты основания соли. ЦЕЛИ УРОКА:. дать определение солям, рассмотреть состав солей, классифицировать ...Угольная кислота и её соли
Выберите из предложенных утверждений только те, которые справедливы для: 1вариант – алмаза, 2 вариант - графита. Прозрачный, бесцветный Очень твердый ...Изучение реакции среды в зависимости от типа гидролиза соли
Лабораторная работа Изучение реакции среды в зависимости от типа гидролиза соли. Цели: понять сущность гидролиза. научиться определять реакцию и тип ...Конспекты
Соли аммония
Муниципальное бюджетное общеобразовательное учреждение. «Базковская средняя общеобразовательная школа». Конспект урока по химии. ...Соли аммония
Тема урока:. Соли аммония. Элементы содержания. : соли аммония. Уметь:. составлять уравнения реакций с участием солей аммония, распознавать опытным ...Соли, их классификация и химические свойства в свете теории электролитической диссоциации
Муниципальное общеобразовательное учреждение. . средняя общеобразовательная школа №2. г. Алексеевки Белгородской области. Конспект ...Соли
Химия 8 класс. Урок 28. Тема урока: Соли. Цели:. сформировать представление о классе сложных веществ - солях и их составе; познакомить с классификацией ...Соли в свете теории электролитической диссоциации, их свойства
Предмет – химия. Класс – 8. Тема урока: «Соли в свете теории электролитической диссоциации, их свойства». Тип урока: урок изучения нового ...Соли угольной кислоты
Соли угольной кислоты. МБОУ СОШ №44 г. Владимир. Учитель химии Уварова Марина Леонидовна. Урок химии в 9 классе. Задачи урока:. образовательные:. ...Соли
Соли. . Соли – сложные вещества, состоящие из атомов металла и кислотного остатка, продукт полного. . Это определение характерно для средних ...Соли аммония. Оксиды азота (II) и (IV)
Урок 20. Соли аммония. Оксиды азота (II) и (IV). Цели урока:. 1. Охарактеризовать соли аммония и оксиды азота (II) и (IV) по следующей схеме: ...Соли
Технологическая карта урока «Соли» (химия 8 класс). 1. Ф.И.О. учителя: Хорошева Галина Марьяновна. 2. Класс: _______8_________. Дата: ______________. ...Соли
Урок с ИКТ по теме «Соли». Химия 8 класс. Учебник: Габриелян О.С. Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа. М. 2012г. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:16 февраля 2019
Категория:Химия
Содержит:20 слайд(ов)
Поделись с друзьями:
Скачать презентацию

























![Комплексные соли — в их состав входит комплексный катион или комплексный анион ( K3[Fe(CN)6] ). Комплексные соли — в их состав входит комплексный катион или комплексный анион ( K3[Fe(CN)6] ).](https://prezentacii.org/upload/cloud/19/02/124513/images/thumbs/screen8.jpg)