Презентация "Соли, их классификация и свойства" по химии – проект, доклад
Презентацию на тему "Соли, их классификация и свойства" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 17 слайд(ов).
Слайды презентации
Список похожих презентаций
Классификация сложных неорганических веществ. Соли
Сложные вещества неорганические органические оксиды кислоты основания соли. ЦЕЛИ УРОКА:. дать определение солям, рассмотреть состав солей, классифицировать ...Кислоты, их классификация и свойства
images.yandex.ru. Дайте характеристику оксидам. Металла(неметалла) Солеобразующий (несолеобразующий) Кислотный (основный). MgO CO SiO2 CO2 N2O5 Li2O. ...«Циклоалканы, их строение. Свойства циклоалканов.»
Цель: Изучить строение, состав, физические свойства и тип гибридизации электронных облаков атома углерода в циклоалканах. Общая формула - СnH2n. Циклоалканы ...Вещества и их свойства
Физические тела – любые предметы, имеющие форму и объем. Например, физическими телами являются самые разнообразные предметы: алюминиевая ложка, гвоздь, ...Классификация и свойства кислот
Неорганические кислоты- это сложные неорганические вещества, молекулы которых содержат один или несколько атомов водорода, способных замещаться на ...Классификация и свойства кислот
Кислоты – это сложные неорганические соединения, состоящие из протона водорода и кислотного остатка. Классификация кислот. По основности:. Одноосновные ...Биогенная классификация химических элементов
бром железо натрий. Элементы необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами. Введение в ...Кислородные соединения азота и их свойства
Цель урока:. Расширить, обобщить, закрепить, оценить знания по теме: «Кислородные соединения азота» Повторить свойства азотной кислоты Закрепить особенности ...Железо, его соединения и их свойства
Задачи:. Проверить знание основных теоретических вопросов темы “Железо и его соединения”; Развивать умения составлять электронный баланс и уравнения, ...Жиры, их строение и свойства
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Жиры и их свойства
Цель занятия: создать условия для осознания и осмысления блока новой информации посредством системы вопросов и нестандартных заданий для самостоятельной ...Дисперсные системы, их классификация.
Цели урока. 1.Получить представление о дисперсных системах в природе и производственных процессах. 2.Формировать понятие о единстве мира на примере ...Кетоны и их свойства
Строение кетонов. Кетоны - органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами. Общая формула ...Альдегиды и их свойства
Содержание Строение молекул Изомерия и номенклатура Физические свойства Получение Химические свойства Применение Контрольные вопросы. Альдегиды – ...Алкины и их свойства
Непредельные углеводороды с тройной связью С=С в молекулах. Простейший представитель ряда – ацетилен С2Н2, общая формула СnH2n-2 (n>2). Атомы углерода ...«Твердые тела и их свойства»
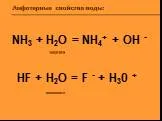
Твердые тела – тела, сохраняющие форму и объем в течение длительного времени. Аморфные тела. Кристаллические тела. Монокристаллы Поликристаллы. Кристаллические ...Амфотерные свойства воды
1. Катион – это: а) ион меди; б) атом серы; в) ион серы; г) атом меди. 2. Анион – это: а) ион натрия; б) ион аммония; в) карбонат-ион; г) ион водорода. ...Альдегиды, свойства, получение, применение
Цели урока.Продолжить знакомить учащихся с кислородсодержащими органическими соединениями на примере альдегидов. Познакомить учащихся с применением ...
Графит и его свойства
Графи́т -минерал из класса самородных элементов, одна из аллотропных видоизменений углерода. Структура слоистая. Слои слабоволнистые, почти плоские, ...Многоатомные Спирты и их строение
Глицерин (пропантриол-1,2,3) - простейший представитель трёхатомных спиртов. Представляет собой вязкую прозрачную жидкость, очень гигроскопична, смешивается ...Конспекты
Оксиды, их классификация и свойства
Тимофеева Ольга Николаевна. . Приложение 4.1.4. Конспект урока химии. Тема урока:. Оксиды, их классификация и свойства. Класс: 8. . Тип ...Основания, их классификация и свойства
Клюкина Ольга Владимировна, учитель химии МАОУ Банниковская СОШ. . Химия 8 класс. Тема урока: «Основания, их классификация и свойства». Цели:. ...Основания, их классификация и химические свойства в свете теории электролитической диссоциации
ТЕМА УРОКА :. Основания, их классификация и химические свойства в. . свете теории электролитической диссоциации. . . II. слайд:. ЦЕЛЬ УРОКА:. ...Кислоты, их классификация и свойства
. МАОУ «Голышмановская средняя общеобразовательная школа №2». Урок химии в 8 классе. Кислоты, их классификация и свойства. ...Кислоты, их классификация и свойства
Муниципальное образование Новокубанский район. . муниципальное общеобразовательное бюджетное учреждение основная общеобразовательная школа № 21 х. ...Кислоты, их состав, классификация, общие свойства
Информационный план-проспект урока. №. . Описание. . . . Тип урока. . Урок изучения нового материала с использованием химического ...Основания, их классификация и свойства
Урок №68. Тема урока:. Основания, их классификация и свойства. Л.р.№15 «Химические свойства оснований». Цели и задачи урока:. Углубить знания ...Оксиды, их классификация и свойства
Тема урока. Оксиды, их классификация и свойства. Цель:. Формирование целостного представления об оксидах, как классе неорганических соединений. ...Альдегиды. Их строение, свойства, получение, применение
Мультимедийный урок по теме: "Альдегиды. Их строение, свойства, получение, применение". . Цели:. 1.Организовать деятельность учащихся по восприятию, ...Алканы. Гомологический ряд, изомеры, номенклатура, свойства и получение алканов Цели: Изучить алканы, как один из классов ациклических соединений
План учебного занятия №. 19. Дата Предмет. Химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . Тема. :. Алканы. Гомологический ряд, изомеры, ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:10 сентября 2018
Категория:Химия
Содержит:17 слайд(ов)
Поделись с друзьями:
Скачать презентацию




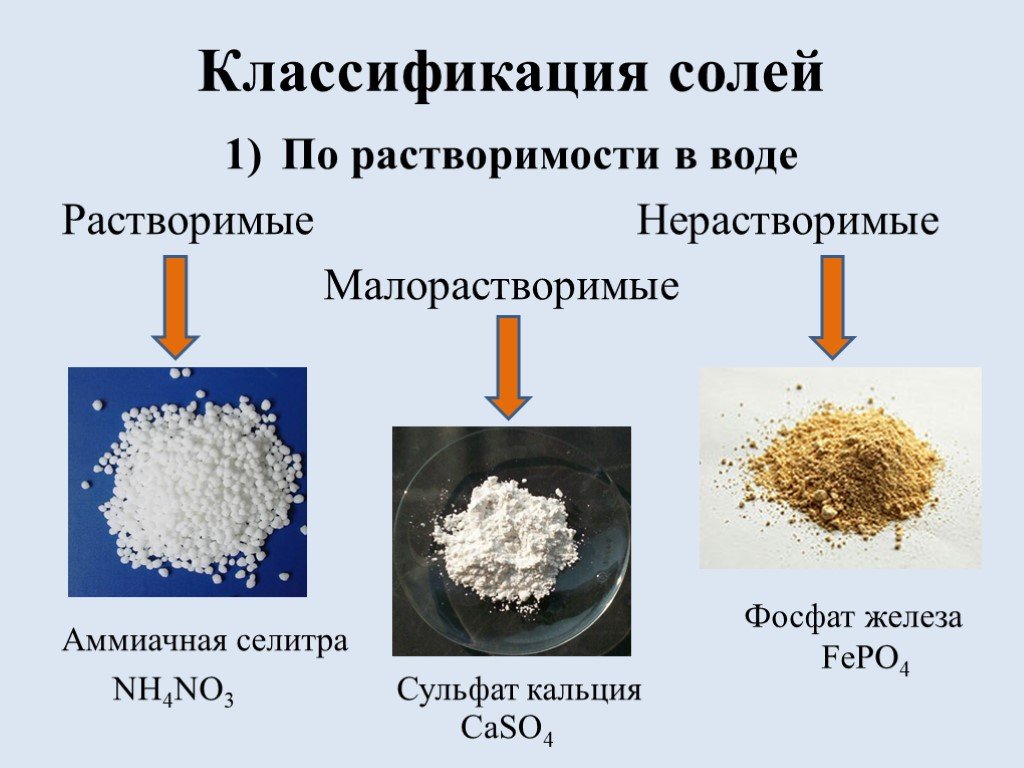
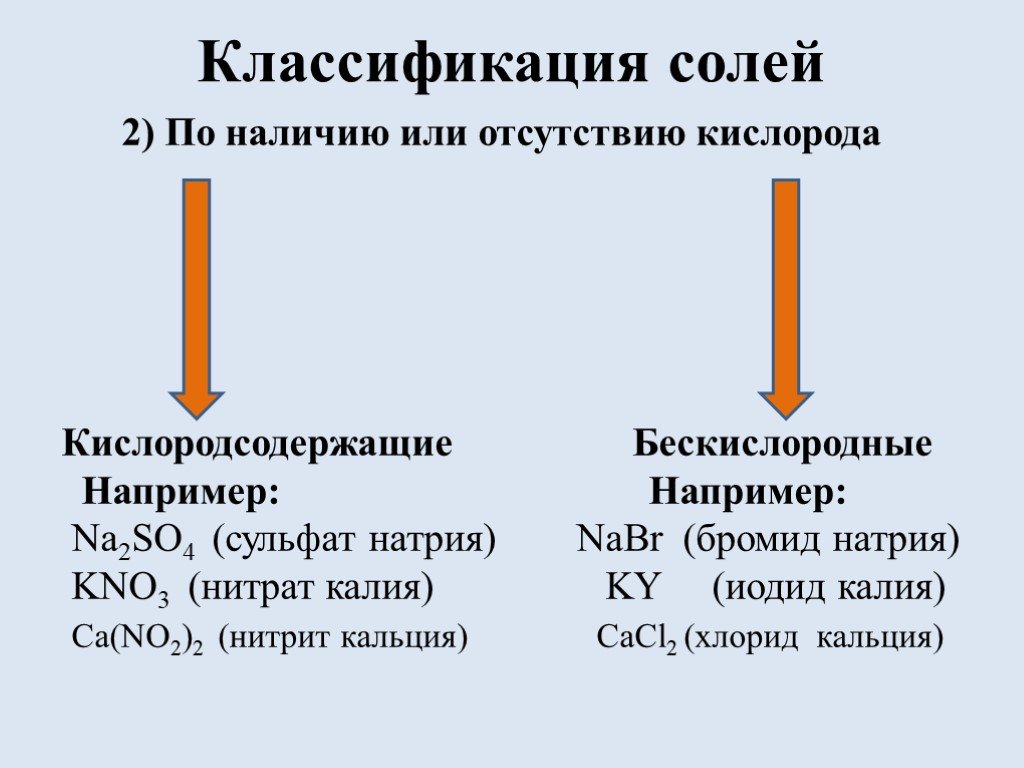



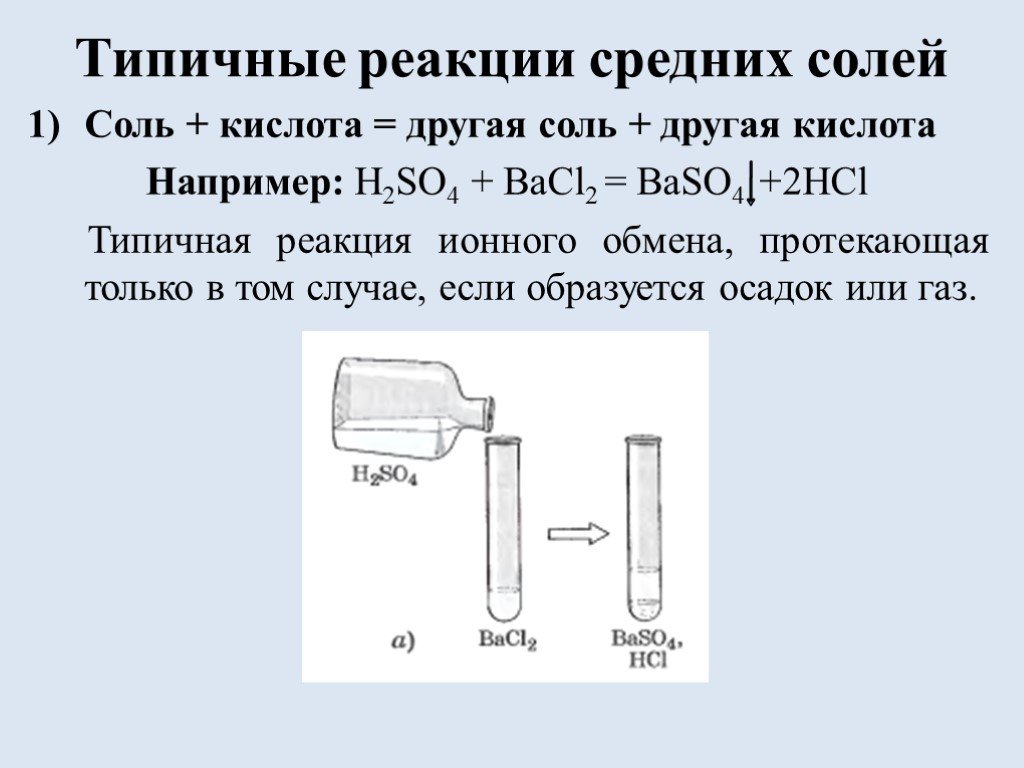
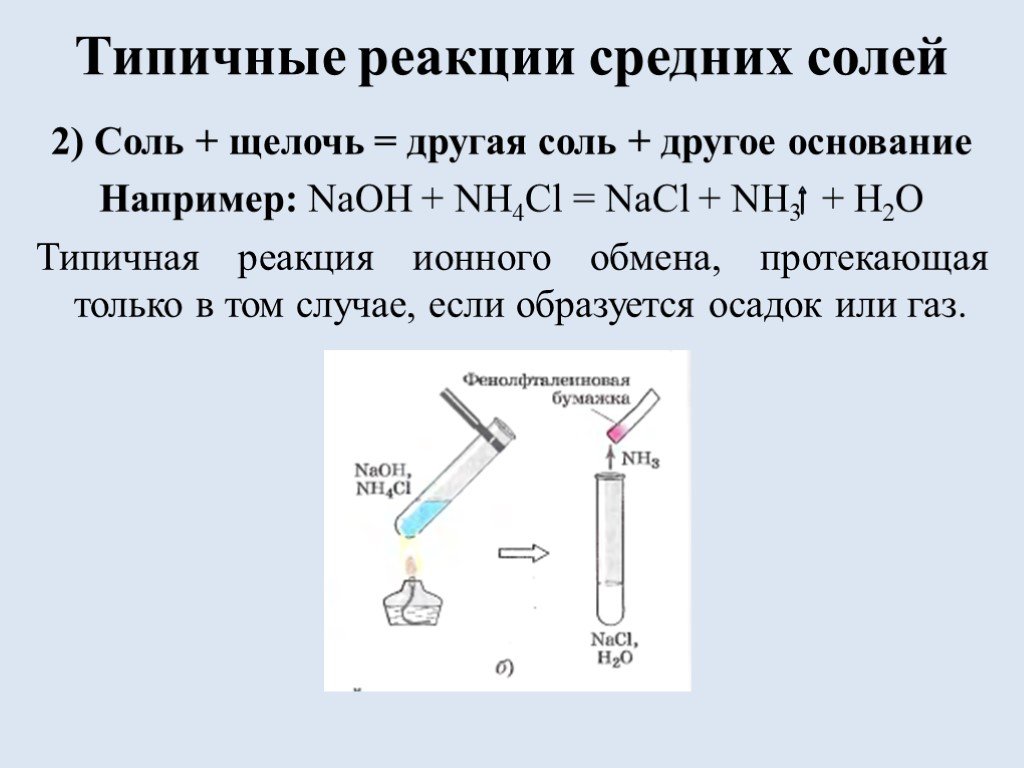











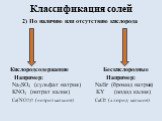











![Список источников. 1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил. Использованы фотографии: http://ru.wikipedia.org/wiki/Фосфат железа (III) фосфат железа http://www.freetorg.ru/lead/ammiachnaya-selitra- Список источников. 1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил. Использованы фотографии: http://ru.wikipedia.org/wiki/Фосфат железа (III) фосфат железа http://www.freetorg.ru/lead/ammiachnaya-selitra-](https://prezentacii.org/upload/cloud/18/09/73193/images/thumbs/screen17.jpg)